Система CRISPR с сериновой интегразой вносит в геном большие последовательности
Бактериофаги применяют сериновые интегразы для встраивания своей последовательности в бактериальные геномы. Исследователи из США использовали систему CRISPR-Cas9 для внесения в геном клетки сайта узнавания сериновой интегразы. После этого интеграза встраивала в геномы различных видов клеток последовательности ДНК длиной до 36 тыс. пар оснований. Авторы работали с праймированным редактированием генома, чтобы избежать появления двухцепочечных разрывов.
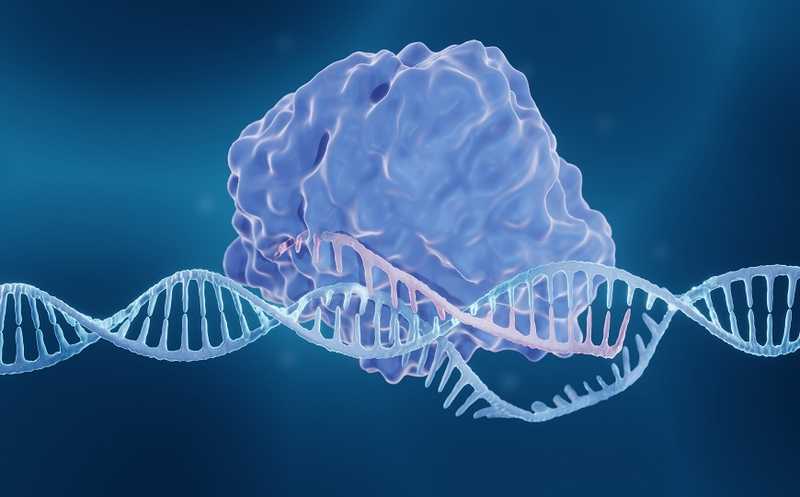
Система CRISPR-Cas9 представляет собой фермент Cas9, который вносит разрывы в цепь ДНК, и гидовую РНК (гидРНК), направляющую фермент к специфическому сайту. Система репарации клетки «чинит» разрыв. Если внести еще и желаемую последовательность ДНК, клетка может инкорпорировать ее в геном во время починки. Однако этот процесс подразумевает внесение двухцепочечных разрывов в ДНК, которые могут стать причиной хромосомных перестроек. Кроме того, данный подход можно использовать только на делящихся клетках. Ученые постоянно ищут пути улучшения технологии CRISPR.
Исследователи из США предложили добавить в эту систему сериновую интегразу. Это фермент используется бактериофагами для встраивания своей последовательности в бактериальные геномы. Примечателен тот факт, что сериновые интегразы могут вставлять фрагменты ДНК длиной до 50 тыс. пар оснований. Этим ферментам для встраивания в геном нужен специфичный сайт, который они используют как место посадки. Очень сложно изменить интегразу так, чтобы она узнавала другой сайт. Поэтому ученые воспользовались CRISPR, чтобы сначала внести нужный посадочный сайт в геном.
Систему назвали PASTE, что расшифровывается как Programmable Addition via Site-specific Targeting Elements. Под руководством гидовой РНК Cas9 разрезает ДНК в нужном месте. Там же происходит встраивание сайта, узнаваемого интегразой (аttB), длиной 46 пар оснований. Такую вставку производят без внесения двухцепочечных разрывов, так как одну цепочку ДНК добавляют с помощью обратной транскриптазы и особой гидовой РНК (праймированное редактирование генома). После инкорпорации аttB интеграза может встроить большую последовательность ДНК в геном.
«Мы считаем, что это большой шаг к осуществлению мечты о программируемом введении ДНК», - сказал Джонатан Гутенберг из Массачусетского технологического института, старший автор статьи. «Это метод, который можно легко адаптировать как к месту, которое мы хотим интегрировать, так и к грузу».
Авторы использовали PASTE, чтобы встроить 13 последовательностей ДНК длиной от 779 до 36 тыс. пар оснований в различные типы клеток, включая лимфобласты K562, первичные Т-клетки человека и неделящиеся первичные гепатоциты человека. Они также отредактировали клетки печени гуманизированных мышей in vivo. Чтобы улучшить систему, авторы проанализировали бактериальные геномы и метагеномы в поисках интеграз. Они обнаружили 25 614 новых ферментов и их сайтов интеграции.
Исследователи считают, что PASTE может использоваться, например, при лечении заболеваний, вызванных рецессивными мутациями с потерей функции (известно 4122 таких генетических заболевания).
У бактериофагов обнаружили CRISPR-системы всех известных типов
Двойное праймированное редактирование генома работает аккуратнее CRISPR-Cas9
Источники:
Matthew T.N. Yarnall, et al. Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases // Nature Biotechnology 2022, published onlime 24 Nov 2022 DOI: 10.1038/s41587-022-01527-4
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0