Составлен атлас клеточной и молекулярной динамики клеток при фиброзе сердца
Австралийские ученые создали первую интегрированную карту клеток сердца, которая позволяет визуализировать процесс фиброза сердечной мышцы — основную причину сердечной недостаточности. Они проанализировали различные состояния сердца у мышей и людей и выявили 11 субпопуляций сердечных фибробластов. Авторы выделили среди них триаду типов клеток, индуцируемую повреждением миокарда, и предположили, что эта триада служит ранним маркером повреждения.
Credit:
Science Advances. DOI: 10.1126/sciadv.adk8501 | CC BY
Сердечно-сосудистые заболевания (ССЗ) — ведущая причина смерти и инвалидности во всем мире. ССЗ сопровождаются фиброзом сердечной мышцы, который приводит к избыточному отложению дезорганизованного внеклеточного матрикса (ВКМ) из-за неконтролируемой или неправильной активации регенеративных путей. Во время и после сердечного приступа мышцы сердца повреждаются, что приводит к образованию рубцовой ткани, лишенной эластичности и способности к сокращению, присущих здоровой сердечной мышце. Эти повреждения постоянны и могут повлиять на способность сердца перекачивать кровь. Основные «виновники» фиброза миокарда — это активированные фибробласты и контрактильные миофибробласты, в норме поддерживающие целостность тканей. Однако при заболеваниях они трансформируются в профибротические клетки, провоцирующие воспалительные и сосудистые реакции и неконтролируемо откладывающие ВКМ. Хотя поначалу фиброз может играть защитную и репаративную роль, неспособность устранить повреждающие стимулы приводит к самоподдерживающемуся и усиливающемуся фибротическому каскаду, конечной стадией которого является сердечная недостаточность.
Ученые из Австралии при помощи секвенирования РНК единичных клеток (scRNA-seq) и транскриптомики провели анализ фибробластов в состоянии гомеостаза и после ишемических и неишемических повреждений у мышей и людей. Результатом исследования стал веб-инструмент CardiacFibroAtlas, который позволяет пользователям визуализировать и анализировать экспрессию генов как при инфаркте миокарда (ИМ), так и в интегрированных наборах данных по различным заболеваниям.
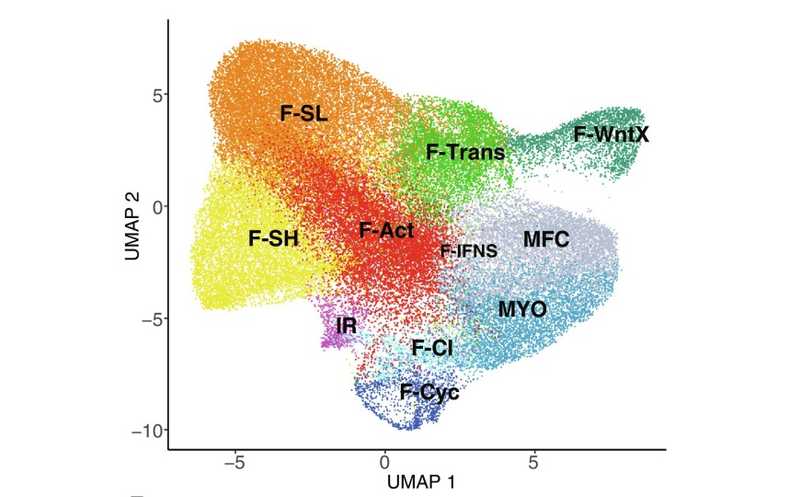
Исследователи проанализировали транскриптомику клеток желудочков сердца и выделили 11 субпопуляций сердечных фибробластов. Среди них присутствовали покоящиеся клетки, активированные клетки, воспалительная популяция, пул предшественников, делящиеся клетки и специализированные клетки, называемые миофибробластами и матрифиброцитами.
Затем ученые применили метод абстракции графов на основе разбиений (PAGA) для определения траекторий дифференцировки клеток после инфаркта миокарда (ИМ). Проанализировав здоровые фибробласты и фибробласты после инфаркта, ученые обнаружили значительную разницу в экспрессии генов, что указывает на разницу между популяциями в состоянии гомеостаза и при ишемии. Анализ дифференциальной экспрессии генов выявил, что популяции фибробластов, зависящие от ранних повреждений, повышали экспрессию генов, связанных с организацией ВКМ и коллагеновых фибрилл. Также были обнаружены сигнатуры клеточной смерти, заживления ран и миграции клеток, которые были общими для нескольких субпопуляций. Оценка временной динамики выявила, что миофибробласты, которые считаются основными виновниками рубцевания, но отсутствуют в здоровых сердцах, начинают формироваться через три дня после сердечного приступа в мышиной модели, достигая пика на пятый день. Затем они преобразуются в форму, называемую матрифиброцитами, что может препятствовать разрешению рубца.
Иммуногистохимический анализ выявил, что клетки, экспрессирующие маркеры стволовости, например, Sca1high-фибробласты (F-SH), находятся в адвентиции (наружном слое) средних и малых по диаметру коронарных артерий, но также могут присутствовать в интерстиции. Ученые также обнаружили, что активированные фибробласты тесно связаны с F-SH и присутствуют как в здоровых сердцах, так и на всех стадиях после повреждения и, вероятно, представляют собой раннюю стадию перехода к ответу на повреждение. После инфаркта миокарда возникают ранние популяции, индуцированные повреждениями — клетки ответа на повреждение (injury response, IR), промежуточные пролиферирующие (F-CI) и пролиферирующие фибробласты (F-Cyc). Анализ показал, что эти состояния представляют собой тесно связанную триаду, отличную от гомеостатических популяций. Эти субпопуляции могут быть маркерами раннего повреждения миокарда.
Ученые также проанализировали состояние фибробластов в других моделях сердечно-сосудистых заболеваний, таких как сердечная недостаточность, вызванная высоким кровяным давлением в результате стеноза аорты или гипертонии. Прогрессирование фиброза при различных типах сердечных заболеваний демонстрировало схожую динамику. Так, миофибробласты были обильно представлены на ранних стадиях гипертонии, а затем преобразовывались в матрифиброциты, как и после сердечного приступа.
Таким образом, проанализировав РНК-сигнатуры около 100 000 единичных клеток и сосредоточившись на тех, которые участвуют в фиброзе, ученые создали интегрированный атлас экспрессии генов в сердечных фибробластах. Это исследование — значительный шаг в понимании фиброза сердечной мышцы, который сопровождает практически все формы заболеваний сердца. Оно открывает новые возможности для разработки целевых препаратов, которые смогут предотвратить повреждение тканей после сердечного приступа.
Источник
Ralph Patrick et al., Integration mapping of cardiac fibroblast single-cell transcriptomes elucidates cellular principles of fibrosis in diverse pathologies. // Sci. Adv. 10, eadk8501 (2024). DOI: 10.1126/sciadv.adk8501


 Меню
Меню





 Все темы
Все темы



 0
0