Создана линия кальмаров-альбиносов для изучения активности нейронов in vivo
Американские ученые отредактировали с помощью технологии CRISPR-Cas9 геном кальмара Euprymna berryi. Мишенью стали два гена синтеза пигментов, и нокаутные по этим генам животные оказались альбиносами. Их ткани были прозрачными, поэтому такие кальмары подходят для неинвазивной прижизненной визуализации и изучения активности нейронов.
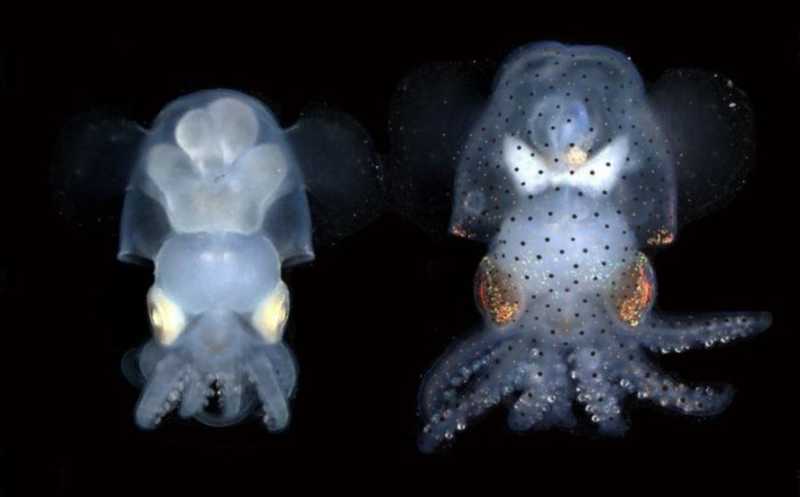
Детеныши кальмара Euprymna berryi: альбинос с отредактированным геномом (слева) и дикий тип (справа).
Credit:
Carrie Albertin and MBL Cephalopod Program.
Высокоразвитая ЦНС головоногих моллюсков и их способность к сложному поведению делает этих животных ценной моделью для изучения работы нервной системы. Однако для того, чтобы они нашли широкое применение в нейробиологии, необходима возможность манипуляции их геномами. Авторы новой работы, опубликованной в Current Biology, на примере кальмара Euprymna berryi показали, что геномы головоногих можно успешно редактировать с помощью системы CRISPR-Cas9. Более того, с помощью геномного редактирования ученые получили кальмаров-альбиносов, которые хорошо подходят для визуализации активности нейронов.
Вид Euprymna berryi выбрали из-за миниатюрности, легкости выращивания в лаборатории и относительно короткого жизненного цикла. Мишенью для редактирования был выбран ген tdo. Его продукт, триптофан-2,3-диоксигеназа (TDO), необходим для синтеза оммохромов – пигментов, окрашивающих глаза и хроматофоры в покровах головоногих. Для нокаута были синтезированы три разные гидовые РНК, которые вместе с белком Cas9 вводили в эмбрионы кальмара на стадии дробления (1-8 клеток). К удивлению ученых, на стадии вылупления эмбрионы, в которые были введены гидовые РНК и Cas9, оказались пигментированными и мало отличались от контрольных зародышей, несмотря на подтвержденную генотипированием высокую эффективность редактирования. Даже зародыши с гомозиготным нокаутом по tdo при вылуплении сохраняли полностью нормальную пигментацию. Добиться исчезновения пигментации удалось с помощью одновременного нокаута гена ido, кодирующего индолеамин-2,3-диоксигеназу, которая катализирует ту же реакцию, что и TDO. Действительно, без обоих ферментов из яиц вылуплялись прозрачные кальмары с красными глазами, однако они погибали в течение недели. Чтобы получить прозрачных кальмаров, которые доживают до взрослого возраста, исследователи провели дополнительные скрещивания и получили кальмаров с генотипом tdo+/-ido+/-. Они также были лишены пигментации, но оставались жизнеспособными, в отличие от полностью нокаутных по обоим генам животных.
Полученные кальмары прозрачны, поэтому на них удобно использовать различные флуоресцентные индикаторы активности нейронов. Авторы работы продемонстрировали это на примере индикатора кальция Cal-520, который вводили в зрительные доли животных. Затем такого кальмара заключали в агарозный гель, чтобы ограничить подвижность животного на время съемки, и с помощью двухфотонной микроскопии визуализировали кальциевые токи в ответ на зрительные стимулы. Использование для аналогичной задачи животных дикого типа ожидаемо не дало результатов.
Предложенный подход позволит минимально инвазивно исследовать нервную систему головоногих моллюсков. Авторы говорят, что следующим важным шагом будет разработка протоколов экспрессии индикаторов нейрональной активности для регистрации кальциевых токов и изменений мембранного потенциала. Они рассчитывают также, что в перспективе на таких кальмарах-альбиносах можно будет детально изучать работу ЦНС, используя свежие данные о функциональных типах клеток в мозге головоногих моллюсков и применяя редактирование РНК для высокоспецифичной регуляции экспрессии генов.
Новый вид осьминога дамбо описан минимально инвазивными методами
Источник
Namrata Ahuja et al. Creation of an albino squid line by CRISPR-Cas9 and its application for in vivo functional imaging of neural activity // Current Biology, Published June 20, 2023. DOI: 10.1016/j.cub.2023.05.066


 Меню
Меню





 Все темы
Все темы




 0
0








