Создана мРНК-вакцина против всех известных подтипов вируса гриппа
Изменчивая природа вирусов гриппа затрудняет создание новых вакцин и подготовку к будущим пандемиям. Ученые из США разработали мРНК-вакцину, кодирующую антигены гемагглютинина всех 20 известных подтипов вирусов гриппа А и В. Эта поливалентная вакцина мощный антительный ответ у мышей и хорьков и защищала их при заражении вирусами, отличающимися от тех, что использовались в вакцине. Предложенную авторами стратегию можно использовать и для других вирусов, например, коронавирусов.
Каждый сезон среди людей циркулируют подтипы H1N1 и H3N2 вируса гриппа А (IAV), а также один или два подтипа вируса гриппа B (IBV). Однако существует не менее 18 различных подтипов вируса гриппа А, которые циркулируют среди животных. Время от времени они приобретают мутации, которые позволяют им переходить в человеческую популяцию и вызывать пандемии гриппа.
Вакцины против сезонного гриппа мало защищают от таких штаммов вируса. Точно предсказать, какой подтип вируса гриппа вызовет следующую пандемию, не представляется возможным, что осложняет создание эффективных вакцин. Поэтому в настоящее время разрабатываются несколько универсальных вакцин, которые защищают от различных подтипов вируса. Большинство из них включают лишь ограниченное количество антигенов с консервативными для различных подтипов вируса эпитопами. Альтернативным подходом является разработка поливалентных вакцин, кодирующих антигены всех известных подтипов вируса гриппа. Это может быть нецелесообразным при использовании традиционных технологий производства вакцин. Однако эта стратегия хорошо подходит для мРНК-вакцин, например, таких как вакцины против SARS-CoV-2 от компаний Pfizer и Moderna.
Ученые из Медицинская школа Перельмана Пенсильванского университета (США) и коллабораторы ранее уже разработали мРНК-вакцины, кодирующие антигены гемагглютинина (НА) отдельных подтипов вируса гриппа А. Они обнаружили, что вакцинированные мыши и хорьки вырабатывают антитела как к головке, так и к ножке гемагглютинина. В новой работе эта же группа ученых создала вакцину на основе липидных наночастиц, которые содержат модифицированную мРНК, кодирующую НА всех 20 известных подтипов вирусов гриппа А и В. Такая поливалентная вакцина способствует выработке антител, которые защищают мышей и хорьков от различных штаммов вируса.
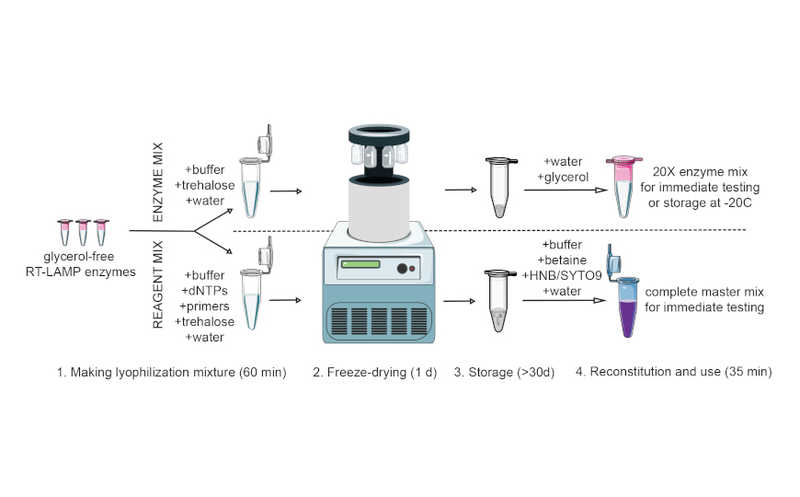
Сначала ученые подготовили 20 различных модифицированных мРНК, кодирующих HA, инкапсулированных в липидные наночастицы (HA mRNA-LNP). Они включили антигены каждого из известных подтипов вирусов гриппа А и В. Авторы вакцинировали мышей внутримышечно низкой дозой (3 мкг) каждой такой вакцины и подтвердили, что они иммуногенны. Затем они вакцинировали мышей одновременно всеми двадцатью HA mRNA-LNP комбинированной дозой 50 мкг (по 2,5 мкг каждой HA mRNA-LNP). В качестве контроля они иммунизировали мышей такой же дозой HA mRNA-LNP, кодирующих одиночные гемагглютинины вирусов H1N1, H3N2, IBV или mRNA-LNP, экспрессирующих люциферазу. В отличие от контроля, мыши, вакцинированные 20-HA mRNA-LNP, вырабатывали антитела, которые реагировали на все 20 антигенов, при этом их уровни оставались практически неизменными через четыре месяца после вакцинации. В их числе были нейтрализующие антитела группы 1 (H1N1 и H5N1) и группы 2 (H3N2 и H7N9), а также антитела, реагирующие с ножкой HA обеих групп. Ученые также доказали, что эти антитела являются как подтип-специфичными, так и перекрестно-реагирующими.
Для того, чтобы сравнить полученную мРНК-вакцину с традиционным подходом на основе белков, исследователи создали вакцину, содержащую 50 мкг 20 различных рекомбинантных HA (по 2,5 мкг на каждый). Мыши, иммунизированные такой поливалентной белковой вакциной, вырабатывали более низкие уровни антител против НА.
Далее ученые проверили, насколько хорошо новая вакцина защищает от антигенно отличающихся штаммов вируса. Через 28 дней после вакцинации они заразили мышей двумя вирусами подтипа H1N1 (A/California/07/2009 и A/Puerto Rico/08/1934), которые имели разный уровень сходства аминокислотных последовательностей гемагглютинина с компонентом вакцины (97,2% и 81,8%). Антитела, вырабатываемые вакциной, взаимодействовали с обоими вирусами, но нейтрализовали только первый. Первоначально после заражения вирусом A/Puerto Rico/08/1934 вакцинированные мыши теряли вес, проявляли клинические признаки заболевания, но через 7–8 дней начиналось выздоровление, и в результате 80% этих мышей выжили. Таким образом, вакцина 20-HA mRNA-LNP обеспечивала мышам разную степень защиты от совпадающих и несовпадающих с вакциной штаммов вируса.
Наконец, используя схему дозирования, первоначально применяемую для мРНК-вакцин против SARS-CoV-2, ученые завершили эксперимент с новой вакциной на хорьках. После однократной вакцинации каждый хорек вырабатывал антитела, реагирующие со всеми двадцатью подтипами HA, уровни которых увеличились после повторной вакцинации. Чтобы имитировать пандемию с неизвестным штаммом, они заразили вакцинированных и невакцинированных хорьков вирусом гриппа H1N1 (A/Ruddy Turnstone/Delaware/300/2009), который сильно отличался от вакцинного гемагглютинина H1 и был схож с ним только на 81,8%. К пятым суткам после заражения невакцинированные животные потеряли более 16% исходного веса, двое из четырех погибли. В это время вакцинированные хорьки потеряли лишь около 8,5% исходного веса, все они выжили. У вакцинированных животных вирус элиминировался более эффективно.
Таким образом, новая мРНК-вакцина вызывает образование у мышей и хорьков разнообразных антител, нацеленных как на вариабельные, так и на консервативные эпитопы гемагглютининов вирусов гриппа. Она защищает животных от симптомов заболевания и гибели после заражения антигенно отличающимися от вакцинных штаммами вируса. Эта стратегия может послужить базой для создания универсальных вакцин против гриппа и в будущем стать основной профилактической мерой в борьбе с пандемиями.
Аденовирусная вакцина против гриппа создает продолжительный иммунный ответ
Источник:
Arevalo C.P., et al. A multivalent nucleoside-modified mRNA vaccine against all known influenza virus subtypes // Science. 24 Nov 2022. Vol. 378, Issue 6622 P. 899-904. DOI: 10.1126/science.abm0271


 Меню
Меню





 Все темы
Все темы




 0
0