Созданы сверхмаленькие флуоресцентные метки для микропротеинов в живой клетке
Разработали новый метод флуоресцентного мечения белков и микропротеинов под названием STELLA. Интересующий белок несет на N- или C-конце единственную дополнительную аминокислоту с флуоресцентной меткой. Метод позволяет изучать перемещения в живой клетке маленьких белков, как клеточных, так и вирусных. Авторы испытали методику на белках коронавируса SARS-CoV-2.
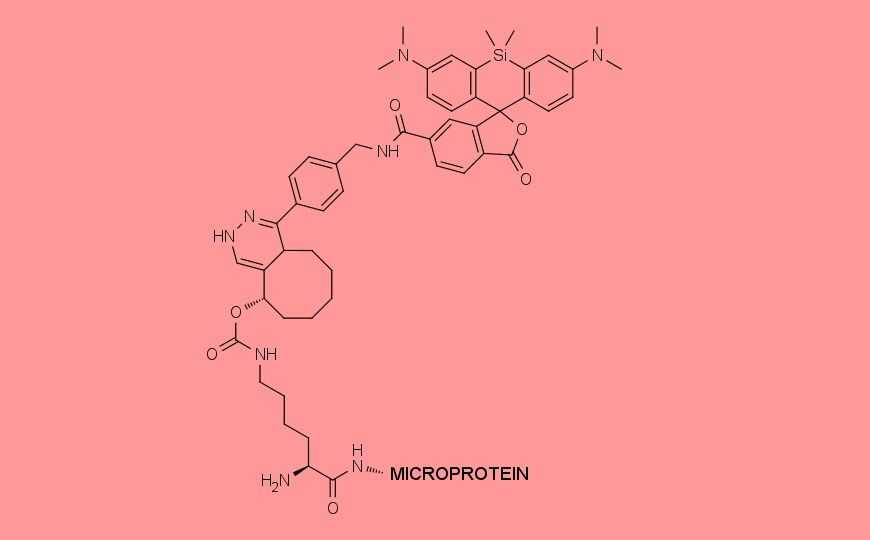
Исследователи из Каролинского института (Швеция) разработали метод, который позволяет прикреплять флуоресцентные метки к маленьким белкам с минимальным нарушением их функции. Метод называется STELLA (single-residue terminal labeling); его суть в терминальной маркировке белка единственной «дизайнерской» аминокислотой.
Новый метод подходит для мечения микропротеинов — белков размером до 60 аминокислот. Для мечения in vivo обычно получают гибридный белок (fusion protein) — слияние генов интересующего белка и флуоресцентного белка-метки, например GFP, дает флуоресцентный продукт, за которым удобно наблюдать. Но это невозможно в случае микропротеинов, поскольку флуоресцентные или ферментативные метки слишком большие, они состоят из сотен аминокислот, самые маленькие — из 6–20. Между тем микропротеинов в клетках млекопитающих тысячи, и многие из них функционально значимы.
Метод STELLA внедряет в микропротеин всего одну неканоническую аминокислоту, например пирролизин. Для этого создают генноинженерную клетку: в ней экспрессируется тРНК, которая распознает стоп-кодон TAG («янтарь») и несет остаток пирролизина. Таким образом, TAG в этой системе кодирует пирролизин, позволяя вставлять в белки дополнительную аминокислоту. В гене микропротеина первый кодон заменяют на TAG. Однако если поставить стоп-кодон сразу после старт-кодона, это сделает невозможной трансляцию с данного сайта инициации. Поэтому авторы создали гибридный ген: «ген убиквитина — TAG — ген интересующего микропротеина». После завершения трансляции убиквитин отщепляется клеточными деубиквитиназами, и образуется микропротеин с пирролизином на N-конце. К пирролизину можно присоединить флуоресцентную метку, например тетразин.
Авторы опробовали также вариант с мечением С-конца микропротеина, помещая кодон TAG перед стоп-кодоном.
N- и C-концевое мечение методом STELLA испытали на трех микропротеинах: NoBody, SMIM38 и PIGBOS; N-концевое мечение прошло успешно во всех трех случаях, С-концевое мечение PIGBOS было неудачным, но с двумя другими продуктами все получилось. Авторы предлагают метить по C-концу те белки, для которых невозможно N-концевое мечение, например, из-за процессинга N-конца.
Затем исследователи пометили несколько небольших белков, локализующихся в различных компартментах клетки: кавеолин-3 (плазматическая мембрана и аппарат Гольджи); CENP-A (центромеры); VAMP8 (мембраны везикул); ATP5F1 (субъединица митохондриальной АТФ-синтазы). Также пометили мембранный белок М SARS-CoV-2, локализующийся в аппарате Гольджи. Для всех этих белков N-концевое мечение показало ожидаемые субклеточные паттерны.
Как известно, вирусные геномы содержат множество альтернативных коротких открытых рамок считывания. Это относится и к новому коронавирусу. Авторы пометили с N-концов продукты трансляции белков ORF коронавируса и смогли визуализировать все, кроме ORF10. Интересно, что все они ассоциировались с мембранными компартментами цитоплазмы. По предположению авторов, ORF6 подавляет клеточный противовирусный ответ путем секвестрирования факторов ядерного импорта в эндоплазматический ретикулум, Этот белок ассоциировался с транспортными везикулами клетки-хозяина.
Таким образом, метод STELLA делает возможным флуоресцентное мечение маленьких белков, что, в свою очередь, позволяет изучать динамические процессы в живой клетке, протекающие с участием микропротеинов.
Источник
Lorenzo Lafranchi, et al. // Universal Single-Residue Terminal Labels for Fluorescent Live Cell Imaging of Microproteins // Journal of American Chemical Society (ACS), 2020, DOI: 10.1021/jacs.0c09574


 Меню
Меню





 Все темы
Все темы




 0
0








