День ДНК-2023. Двойной спирали 70 лет
Информационные и физические свойства ДНК, нанопоровое секвенирование в научных и клинических исследованиях, отечественные секвенаторы и другие новости российских компаний — все это обсуждалось в Пущино на традиционной ежегодной конференции «День ДНК».

Двадцать пятого апреля 1953 года в Nature вышли три статьи, посвященные открытию молекулярной структуры ДНК. Ровно через 70 лет в Институте теоретической и экспериментальной биофизики РАН (Пущино) состоялась очередная конференция «День ДНК».
Мы очарованы возможностями NGS, сказала Ирина Масулис (Институт биофизики клетки РАН); видим в ДНК только текст из миллионов знаков и упускаем из виду, что конформационные изменения этого биополимера влияют на его функцию. «Классическую» двойную спираль в природе трудно найти, реальная двойная спираль демонстрирует отклонение параметров от канонической формы, подраскрученное или перекрученное состояния. Эти особенности важны для ее взаимодействий с белками-онкосупрессорами, различными регуляторными белками, для продвижения репликативной машины, компактизации хроматина.
Наиболее мощный фактор, модулирующий структуру ДНК, — транскрипция, когда двойную спираль растаскивают на нити. Существует концепция, согласно которой в активно транскрибирующихся участках появляются домены суперспирализации, своего рода волны суперскрученности впереди и позади участка. Если интегрировать в плазмиду несколько промоторов в различной ориентации, можно наблюдать встречную миграцию участков отрицательной и положительной суперспирализации и их коллизию. Когда таких структур становится много, они затрагивают участки генома, вовлеченные в другие функциональные процессы.
Это были работы с индивидуальными участками ДНК, но интересно исследовать процесс на геноме в целом. Например, пятиминутное воздействие антибиотика — ингибитора гиразы приводит к масштабным изменениям экспрессии генов, которые можно зафиксировать с помощью микрочипов. Чтобы сгенерировать общую концепцию на основе огромных данных, полученных в подобных экспериментах, нужны математические модели. Такие модели есть, однако они, как правило, не учитывают последовательность нуклеотидов в ДНК. В статье Л.В. Якушевич (ИБК РАН) описана модель, представляющая нуклеотиды в виде маятников, которым присвоены различные массы, а нити ДНК — коэффициент жесткости.
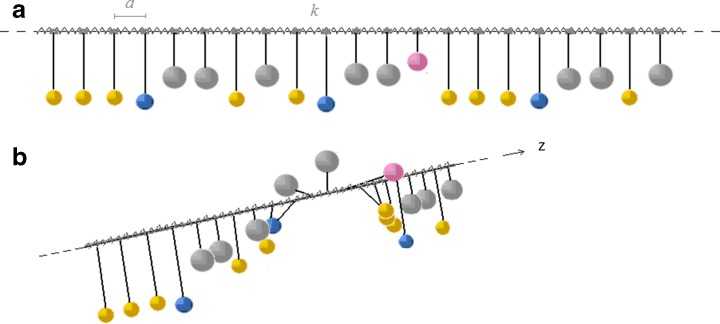
Здесь происходит конвергенция интересов теоретиков и экспериментаторов, отметила Ирина Масулис. Сама она занималась предсказанием промоторов в геномах — участков, формирующих открытые состояния. Разработали алгоритм, прогнозирующий участки с высокой плотностью промоторов, и сконструировали плазмиду для экспериментальной проверки прогноза. В этой плазмиде изучаемый участок встраивается между противоположно ориентированными генами флуоресцентных белков — зеленого GFP и красного mCherry, что позволяет обнаруживать разнонаправленные промоторы. В зависимости от ориентации встроенного участка меняется соотношение красной и зеленой флуоресценции.
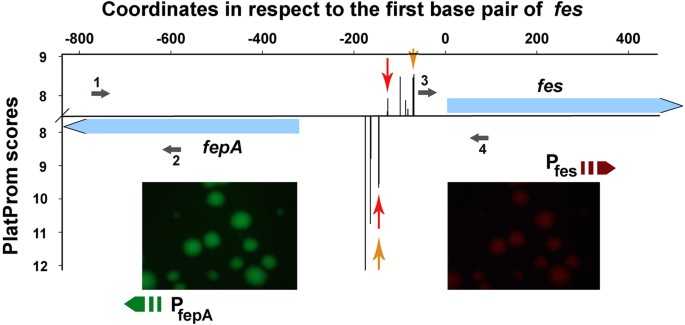
Конструкция позволяла детектировать и влияние топологии ДНК. Так, когда плазмиду внедряли в штамм бактерии с мутантной топоизомеразой, реакция промоторов зависела от ориентации встройки: в одной конструкции промотор существенно активировался, в другой этого не происходила. Дальше применили математическую модель, которая показала свою валидность в оценке механических эффектов, влияющих на транскрипцию. На данный момент эта модель остается одной из самых продвинутых, подчеркнула докладчица.
Николай Петрович Сирота (ИТЭБ РАН) рассказал о ДНК-повреждающих эффекты ускоренных ионов углерода. В совместном исследовании ИТЭБ, Института физики высоких энергий в Протвино и Физико-технического центра Физического института им. П.Н. Лебедева ускоренные ионы углерода, полученные на уникальной установке ИФВЭ, использовали для облучения клеток и нуклеоидов (то есть остаточных ядерных структур, получаемых при разрушении эукариотической клетки). ДНК-повреждающие эффекты были сильнее выражены в клетках, чем в нуклеоидах; это различие может быть связано с функционированием внутриклеточных систем контроля. Облучение дозозависимым образом влияло и на экспрессию мРНК. В планах исследователей — облучение опухолей в головном мозге; даже если они находятся на довольно большом расстоянии от поверхности, однако пик Брэгга может попасть как раз на опухоль.
Сразу несколько докладов было посвящено нанопоровому секвенированию. Анастасия Колотова (ИТЭБ РАН) вместе с коллегами из лаборатории исследований генома и лаборатории фармакологической регуляции клеточной резистентности ИТЭБ определили с помощью нанопора транскриптомный профиль миелоидного лейкоза. Острый миелоидный лейкоз — группа клональных заболеваний, связанных с мутациями в клетках-предшественниках гемопоэза, вызывающими бесконтрольную пролиферацию незрелых миелоидных клеток. Значительную роль играют мутации в гене рецепторной тирозинкиназы FLT3 — рецептора цитокинов. С неблагоприятным прогнозом коррелируют внутренние тандемные дупликации в этом гене.
Обычно для типирования заболевания по данным транскриптома и выбора препарата проводят секвенирование на приборах Illumina. Докладчица с коллегами проверили, можно ли ввести в клиническую практику нанопоровое секвенирование. Его плюсы — скорость, меньшая себестоимость запуска, возможность исследовать несколько образцов на одной ячейке, а также высокая чувствительность, большая длина прочтений; точность благодаря новой химии и новым порам также стала достаточно высокой.
Авторы исследования провели анализ транскриптомов двух клеточных линий — дикого типа (THP1-А) и с внутритандемной дупликацией в FLT3 (MV4-11), обработанных химиотерапевтическим препаратом квизартинибом (ингибитором тирозинкиназ, специфичным в отношении FLT3). Результаты показали, что нанопоровое секвенирование хорошо справляется с анализом транскриптомов
Николай Кольжецов (Институт биофизики клетки РАН, лаборатория функциональной геномики прокариот) рассказал о необычном применении нанопора — секвенировании геномов микроорганизмов из кишечника древнего животного. ДНК древних макрообъектов относительно хорошо сохраняется в костной ткани, микроорганизмам повезло меньше, однако в некоторых случаях удается получить достаточно материала для анализа. Нанопоровое секвенирование хорошо подходит для палеогенетики не только длинными прочтениями, облегчающими сборку, но еще и тем, что можно не использовать ПЦР-амплификацию, не привязываться к филогенетическим маркерам и не ожидать связанных с этим искажений.
Докладчик с коллегами исследовали пристеночное содержимое тонкого кишечника бизона, извлеченного из вечной мерзлоты на Чукотке. Бизон жил 50 тысяч лет назад. Авторы секвенировали тотальную ДНК и провели биоинформатический анализ, а также сделали попытка оживить метагеном. Отвечая на вопросы о возможной контаминации, Николай подчеркнул, что проба была взята «из глубины» бизона, вокруг находки сразу же разбили палатку и все манипуляции делали стерильными инструментами.
Образец был непростым для выделения и очистки: много гуминовых и желчных кислот, фенольных соединений из растительного корма, забивающих силикатные колонки. Приходится отказываться от очистки на колонках либо сорбировать мешающие компоненты. Авторы работы использовали для очистки набор PureLink Microbiome DNA компании Thermo Fisher. Секвенировали на MinION от Oxford Nanopore с качеством Q20 (не более 1% ошибок). Докладчик отметил, что пока еще встречаются ошибки на гомонуклеотидных прочтениях: нанопоровый секвенатор может «орать», повторяя одну букву.
В распределении бактерий по родам доминировали Pseudomonas и Psychrobacter. Интересно, что в метагеноме быка породы блэк ангус преобладают совсем другие клады — отделы Bacteroidetes и Firmicutes, и вообще состав микробиома сильно отличается. Психрофильные микроорганизмы (способные выживать при низких температурах) очевидно, получили преимущество после смерти животного.
Эксперимент по оживлению древней микробиоты увенчался успехом. В суспензии преобладали клостридии, в частности, Peptoclostridium sardelii, для которой удалось получить покрытие до 1000. Gо сравнению с современным штаммом контиг намного короче, в нем есть перестановки, так что, скорее всего, это именно древний организм. Исследователи планируют подбирать среды для оживления других организмов и секвенировать их
Следующий докладчик, Денис Гудков, исполнительный директор Центра внедрения геномных технологий МФТИ, созданного в 2020 году, рассказал о работе центра. Он был задуман как миницентр полного цикла, где есть и клиника, и собственные разработки, и биобанк. Центр занимается всем, от пробоподготовки до биоинформационного анализа. В основном решаются прикладные задачи, такие как подбор терапии в онкологии, генетическое тестирование. Активно используется нанопоровое секвенирование.
Среди проектов центра — жидкостная биопсия для диагностики лимфом, тестирование на SNP, ассоциированные с предпочитаемыми видами спорта, оптимальным рационом. В планах более сложные вопросы: жизнеспособность, стрессоустойчивость, риски по ряду заболеваний, а также система оценки состояния человека на основе нанопорового секвенирования — проект «Молекулярный человек». Исследоваться будет не только геном, но и миРНК, и метаболом. В Центре создали панель для исследований микроРНК. Панель для анализа стрессоустойчивости помогут создать исследования перетренированности у спортсменов — это состояние похоже на выгорание, объяснил Денис Гудков.
Доклад Ольги Сергеевой, зав.лабораторией биотехнологии РНК компании «ГенТерра» назывался «Использование малых интерферирующих РНК для валидации потенциальной терапевтической мишени РНК-хеликазы DDX3». Терапевтические препараты, содержащие в качестве активного компонента РНК, имеют большое будущее. В 2018 году был разрешен первый препарат на основе миРНК, во время пандемии COVID-19 отлично работали мРНК-вакцины. Синтетические мРНК, антисмысловые олигонуклеотиды и малые интерферирующие РНК, приводящие к деградации мРНК-мишени, а также аптамеры, которые непосредственно взаимодействуют с белками — лекарственные средства ближайшего будущего. (О компании «Гентерра», одна из задач которой — производство олигонуклеотидов, на PCR.NEWS.)
Преимущества РНК-терапии — возможность нацеливания на мишени, с которые не работают малые молекулы, быстрая разработка, экономическая эффективность. Основные минусы — малая стабильность, иммуногенность, проблема адресной доставки.
РНК-хеликаза DDX3 участвует во многих клеточных процессах и рассматривается как потенциальный онкомаркер, ее ингибиторы могут иметь онкоактивность. Авторы работы, о которой рассказывала докладчица, использовали миРНК для снижения уровня DDX3 в клетках и in vivo. Сравнивали транскриптомы до и после ингибирования на клетках мышиного рака печени Hepa 1-6. Было достигнуто снижение экспрессии мишени до 90%; два наилучших варианта миРНК в липидных наночастицах вводили в хвостовую вену мышам, одна миРНК, более «сильная», уже на шестой день вызывала воспаление в печени и привлекает туда клетки иммунной системы; длительное лечение приводило к появлению мертвых гепатоцитов. Эффекты второй, менее мощной миРНК были более мягкими. Анализ транскриптомов показал, что при менее сильном снижении экспрессии DDX3 транскрипционные события и клеточные фенотипы in vivo и in vitro отличаются, следовательно, клеточных исследований недостаточно: РНК-препараты необходимо валидировать на животных.
Алексей Чемерис, зам. директора Института биохимии и генетики УФИЦ РАН рассказал о применении ДНК как носителя информации в небиологических системах. ( Подробнее об этой интригующей теме в статье А.В.Чемериса с соавторами.) Он напомнил слушателям, что ДНК «старше», чем многие думают, — двойная спираль была открыта 70 лет назад, но ДНК как химическое вещество открыл Фридрих Мишер 150 лет назад (он назвал ее «нуклеином»). ДНК, полученная Мишером, до сих пор хранится в музее; в институте докладчика есть ДНК крупного рогатого скота, которой 50 лет.
Леонард (Лен) Адлеман, известный как один из создателей криптосистемы RSA, в 1994 году предложил использовать ДНК, «по сути цифровую молекулу», для вычислений (решения комбинаторных задач). Другая интригующая возможность — долговременное хранение информации на ДНК-носителе. О такой возможности упоминал еще Ричард Фейнман в своем знаменитом докладе «Внизу полным-полно места» (1960). В СССР детально раскрыл эту тему физик Михаил Самойлович Нейман в серии публикаций 1964–1965 года в журнале «Радиотехника»: он обращал внимание, что запись генетической информации в ДНК имеет чрезвычайно высокую степень миниатюризации, и обсуждал, как записывать эту информацию и как ее считывать.
Первые примеры использования ДНК в качестве носителя информации были скорее курьезами, как Microvenus Джо Дэвиса и Дэна Бойда (иконка, изображающая руну Альгис, «закодированная» в ДНК) или знаменитое JUNE 6 INVASION : NORMANDY (авторы не только переслали это секретное послание в микрокапле раствора ДНК на бумаге, но и смогли расшифровать его с помощью ПЦР и секвенирования).
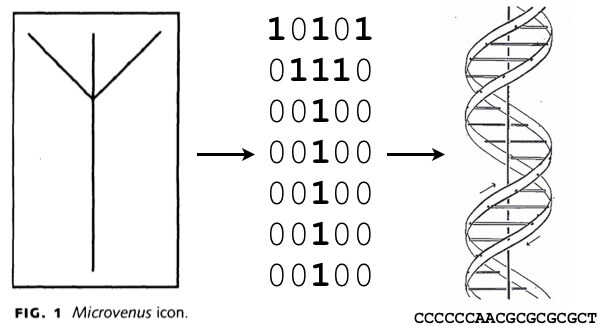
Отношение к теме стало более серьезным с появлением NGS. Предлагались различные способы кодирования, в частности, Джордж Черч в 2012 году предложил однобитное ДНК-кодирование: 0 — аденин и цитозин, 1 — гуанин и тимин. Возможность использовать А вместо С, Г вместо Т и наоборот позволит при конструировании олигонуклеотидов выбирать последовательности, лишенные гомополимерных участков и нежелательной вторичной структуры. (Чемерис отметил, что выбор нуклеотидов нелогичен: правильнее было бы сделать более маленькие пиримидины нулями, а пурины единицами.)
ДНК как носитель информации — это вся информация мира, занимающая полтрейлера, сказал докладчик. По некоторым прогнозам, к 2040 году кремния для нужд информатики может не хватить. А в одном грамме ДНК может храниться 500 эксабайт информации. Этим вопросом интересуются на самом высшем уровне, и не только в нашей стране; Агентство передовых исследований в сфере разведки (IARPA), находящееся в подчинении у директора национальной разведки США, создало программу MIST — Molecular Information Storage.
Для развития этого направления зарубежные компании Western Digital, Microsoft, Twist Bioscience (один из лидеров в области синтеза ДНК), Illumina и другие образовали консорциум. Есть нерешенные проблемы: стоимость секвенирования падает, но синтез олигонуклеотидов практически не дешевеет. Кроме того, хотя ДНК хранится долго (вспомним о достижениях палеогенетики), она подвержена действию ферментов-нуклеаз (ДНКаз); ферментативная атака может уничтожить информацию. Можно синтезировать неприродные молекулы ДНК — ПНК, ЛНК, но для них понадобится модифицировать методы секвенирования. Наконец, поправка по поводу информационной емкости: никто не будет работать с единичными копиями молекул, для считывания нужно стократное покрытие.
Докладчик с коллегами занимаются кодированием небиологической информации в ДНК в рамках работы по гранту РФФИ. В частности, они подали заявку на ДНК-чипы для хранения информации, сказал Алексей Чемерис.
Виктор Томилов (СибЭнзим) рассказал о NGS-анализе метилированных сайтов RCGY (любой пурин — CG — любой пиримидин). Метилирование этих сайтов играет ключевую роль в выключении генов, оно тканеспецифично и изменяется с возрастом; паттерны метилирования различаются у онкобольных и здоровых доноров.
В полногеномном эпигенетическом исследовании обычно используют чипы, которые выявляют статус метилирования для сотен тысяч сайтов по всему геному. В основе метода лежит бисульфитная конверсия ДНК. Но есть и другой подход — сайт-специфическая 5mС-зависимая ДНК-эндонуклеаза Gla1. Этот фермент разрезает сайты с С5-метилцитозинами, но не разрезает сайты без модификаций или с N4-метилцитозинами. Как отметил Виктор Томилов, этот подход проще бисульфитной конверсии: достаточно пришить адаптеры к тупым концам и далее секвенировать, например, на платформе Illumina, участки длиной 75-150 нуклеотидов. Данные секвенирования обрабатываются, фильтруются и картируются на референс человеческого генома; локализация концов фрагментов указывает на сайты метилирования.
Докладчик с коллегами проверили этот подход на малигнантных клеточных линиях (Raji и U-937, а также незлокачественной линии фибробластов легких. Удалось найти гораздо больше сайтов метилирования RCGY, чем имелось в базах.
Надо уметь определять положение всех 5mС в геноме человека, подчеркнул Виктор Томилов. Перспективным для исследований метилирования может быть отечественный вариант секвенаторов Oxford Nanopore; британские нанопоровые секвенаторы отличают 5-метилцитозин от цитозина.
Об использовании данных NGS в клинических целях говорила и Дарья Хмелькова (Genetico). Основные цели — поиск причины наследственного моногенного заболевания, скрининг на носительство рецессивных вариантов, оценка рисков развития наследственных заболеваний с поздним началом. Но могут быть и другие задачи, например, подбор таргетной терапии. Сначала они решались с помощью панелей, и со временем панели становились все больше. Потом появился клинический экзом, потом полное секвенирование экзома и полное секвенирование генома.
Ограничения, влияющие на результаты секвенирования, — неравномерное покрытие, артефакты; трудно выявлять мутации в областях повторяющихся последовательностей (это касается коротких ридов), мутации в генах, гомологичных псевдогенам; пробблемы представляют структурные перестройки, мозаицизм, эпигенетические варианты.
Докладчица напомнила, как генетические варианты классифицируются по патогенности: патогенные, вероятно патогенные, с неизвестной клинической значимостью, вероятно доброкачественные и доброкачественные (последние два в заключение не выносятся). Свои правила существуют в онкогенетике, где классифицируются в том числе соматические варианты.
Об этом важно говорить, так как на основании выводов о патогенности принимаются клинические решения, подчеркнула Дарья Хмелькова. Например, что касается вариантов с неопределенной значимостью (Variant of Uncertain Significance, VUS) — примерно половина онкологов с небольшим опытом не видят разницы между VUS BRCA1-2 и патогенными либо вероятно патогенными вариантами и отправляли пациенток на двустороннюю мастэктомию. Так же поступала четверть врачей с большим опытом.
Эффект варианта может быть оценен неверно. Ошибки скрываются в клинических и популяционных базах данных, в научных публикациях. Поэтому большое значение имеют использование зарубежного и отечественного опыта, скептическое отношение к информации и ее перепроверка. Всегда ценно второе мнение, поэтому полезны консилиумы и переанализ данных, подчеркнула докладчица.
Екатерина Кузнецова, руководитель направления «Геном ЗДОРОВЬЕ» в ООО «Эвоген», напомнила историю геномных исследований в России и в мире. Как известно, проект «Геном человека» завершился досрочно, в 2001 году вышли спецвыпуски Nature и Science, посвященные этому достижению, через два года анонсированы улучшенные черновики (оставшиеся 8% удалось секвенировать только к 2021 году). На смену классическим методам секвенирования по Сэнгеру и Максаму — Гилберту пришли технологии секвенирования путем синтеза, не использующие электрофорез, которые обычно называют NGS. Среди них появились ультрапроизводительные платформы, такие как NovaSeq от Illumina и DNBseq. Третье поколение представлено одномолекулярным секвенированием, в том числе нанопоровым.
Компания «Эвоген» специализируется на полногеномных исследованиях, имеет собственный парк оборудования, ПО и базы данных. Полногеномные исследования могут быть полезны здоровым людям для планирования потомства, выявления рисков заболевания и особенностей метаболизма лекарств; такие особенности обнаруживаются у всех пациентов, отметила докладчица. В 5% были выявлены мутации, ассоциированные с наследственными опухолевыми синдромами. Компания предлагает тесты на наследственные формы рака, исследование опухолевой ткани с целью подбора наиболее эффективного препарата, а также неинвазивное пренатальное тестирование (НИПТ).
Темой доклада Андрея Зимина (Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН) были бактериофаги — уникальные природные системы доставки ДНК в клетку. Упаковочному аппарату бактериофага все равно, что упаковывать, объяснил докладчик: во время репликации он изготавливает конкатемеры ДНК и помещает их в головку фага до полного заполнения. Структуру ДНК внутри головки до сих пор исследуют.
Бактериофаг Т4 дикого типа не может осуществлять трансдукцию (горизонтальный перенос генов), так как его ДНК содержит гидроксиметилцитозин вместо цитозина, и его геном кодирует ферменты, разрущающие цитозиновую ДНК бактерии. Но мутантный Т4 с цитозиновой ДНК и так называемые псевдо-Т-четные фаги (природные фаги, содержащие цитозин, такие как RB42, RB43, RB49), способны к трансдукции крупных плазмид. Это делает их перспективными инструментами генной инженерии
Затем докладчик рассказал о современном состоянии бактериофаговой терапии. Ее история насчитывает более ста лет, более 90 лет производятся препараты, содержащие фаги. Но в этом случае способность к трансдукции становится недостатком, так как может привести к переносу генов патогена.
В геномах фагов есть и другие неканонические основания, кроме гидроксиметилцитозина. Например, Б.Ф. Ванюшин нашел у фагов 2,6-диаминопурин, замещающий аденин. Есть фаги, у которых заменен не один нуклеотид. И весь этот антимир с альтернативной ДНК присутствует в кишечнике почти каждого из нас, заметил докладчик.
Андрей Зимин и его коллеги создали естественную модель фаговой трансдукции in vivo —для изучения переноса генетической информации в кишечнике мыши и беспозвоночного организма (двустворчатого моллюска). Оказалось, что горизонтальный перенос в естественных условиях идет интенсивнее, чем предполагалось; «после нашего исследования про метагеномику можно забыть», сказал Андрей Зимин.
Затем Наталья Демиденко рассказала об успехах компании SkyGen, которая в прошлом году отметила свое десятилетие. SkyGen — это в первую очередь NGS и продукты для молекулярной биологии. Компания поставляла в Россию продукцию NEB, Oxford Nanopore, 10x Genomics, Thermo Fisher и многие другие. Поставки не прекратились и в последний год, ассортимент пополнился новыми брендами. Например, за то время, пока сохранялась неопределенность с продукцией NEB, компания вышла на Vazyme Biotech, которая также предлагает интересные решения. Реагенты, совместимые с секвенаторами по Сэнгеру от Applied Biosystems производит нидерландская компания NimaGen.
Артём Ермаков (ИТЭБ РАН, лаборатория исследований генома) посвятил свой доклад возможностям нанопорового секвенирования нуклеиновых кислот и белков. Он напомнил, в частности, что у Oxford Nanopore появились китайские конкуренты, например, Qitan Tech. Ее портативный секвенатор QNome-3841 может вмещать одну проточную ячейку с нанопорами. Он имеет максимальную длину чтения не менее 2 МБ и может создавать до 3 ГБ данных секвенирования, тогда как выпущенный в июле 2022 года QNome-3841hex содержит шесть проточных ячеек. Qitan использует белковую нанопору и более термостабильную хеликазу, чем хеликаза Oxford Nanopore. У них также доступна безлигазная пробоподготовка с помощью клик-химии.
Артём Ермаков поделился своим опытом нанопорового секвенирования транскриптома миелоидных клеток и микроРНК. Замена реагентов для пробоподготовки на отечественные, в частности продукцию компаний «Люмипроб» и «Евроген», дала хорошие результаты, в частности, удавалось секвенировать очень короткие молекулы, от 20 нуклеотидов.
Елизавета Жданова (ИТЭБ РАН) рассказала, как повысить точность таксономического определения микробиоты и микобиоты с помощью нанопорового секвенирования. Обычно подготовка к таксономическому исследованию микроорганизмов включает культивирование и амплификацию фрагментов. Однако многие виды являются некультивируемыми, а амплификация и короткие чтения накладывают ограничения. Нанопоровые же секвенаторы позволяют получить длинные прочтения с достаточно высокой точностью; дополнительные преимущества — быстрота подготовки библиотек и низкая стоимость запуска. Результаты нанопорового секвенирования хорошо коррелировали с полученными на платформе Illumina, отметила докладчица.
Алексей Ватлин («Альгавитапро», Nextgenseq.tech) представил немецкий геномный центр CeGaT, провайдера услуг по NGS (подробнее на PCR.NEWS). Среди преимуществ работы с CeGaT — возможность участия в торгах и госзакупках, русскоговорящий персонал. Компания располагает секвенаторами Illumina NovaSeq 6000, сейчас появились также NovaSeq X Plus и Pac Bio. CeGaT предлагает секвенирование геномов, экзомов, анализ транскриптома, секвенирование малых РНК, секвенирование отдельных клеток млекопитающих, анализ микробиома и многое другое.
Денис Ребриков, выступая от имени компании «ДНК-технология», назвал свой доклад «обзорным и рекламным». В РФ локализовано несколько NGS-платформ для клиники, отметил он. Наряду с Illumina и другими появились приборы MGI (КНР), их локализацией занимается компания «Экзопласт». Отечественные секвенаторы производит «Синтол», и они близки к выходу в клинику. С точки зрения Росздравнадзора, для клинического применения РУ нужно получать на всё от очистки ДНК до анализа данных. Но иногда регистрирующая организация объединяет это в пакет. В настоящее время у нас 20 РУ на приготовление библиотек для различных клинических применений, 10 РУ на секвенирование и 7 — на анализ данных. Библиотеки регистрируют «ДНК-технология», «Р-Фарм», «Атлас», «ПарсекЛаб», «Ферст Генетикс», «МедТех», «ИнтерЛабСервис».
«ДНК Технология» предлагает оборудование и реагенты для различных этапов выделения и анализа нуклеиновых кислот, в частности, станции для автоматизации выделения нуклеиновых кислот; две такие станции проработали весь ковид в Центре мозга ФМБА, где во время пандемии организовали ковидный центр. Также получены РУ на скрининг анеуплоидий по крови матери, а также HLA-типирование методом NGS для регистра доноров костного мозга. ФМБА взяла под свой контроль все регистры. Российские базы сейчас включают 300 тысяч потенциальных доноров костного мозга в РФ, в США — порядка 9 млн. Хотелось бы, чтобы отечественный регистр рос.
О первом отечественном полногеномном секвенаторе «Нанофор СПС» рассказал Яков Алексеев, директор по науке и сооснователь компании «Синтол». На рынке генетических технологий сейчас доминируют США и Китай, роль российских гентехнологий очень скромная. Сами технологии различаются по востребованности. секвенирование и ПЦР лидируют, за ними с большим отрывом следуют технологии синтетической биологии — синтез ДНК и РНК, геномное редактирование. Так или иначе, по некоторым оценкам, в 2028 году мировые объемы рынка генетических технологий достигнут 100 миллиардов долларов, то есть вырастут втрое по сравнению с сегодняшним днем. И здесь российские компании должны найти свое место, возможно, за счет экспорта в страны Латинской Америки и Африки.
На рынке генетических технологий доминируют ThermoFisher, Illumina, MGI, Oxford Nanopore, Pacific Bioscience плюс новый игрок — китайская компания GeneMind, которая начала поставки и в Россию. В этой связи Яков Алексеев отметил, что классические сэнгеровские секвенаторы китайского производства внутри Китая торгуются по цене 20000 долларов, а на российской земле цена вырастает в десять раз.
Над российскими приборами уже много лет работает консорциум трех организаций. Институт аналитического приборостроения из Санкт-Петербурга, разработчик первых и единственных на сегодня отечественных секвенаторов; акционерное общество «Эзан» из Черноголовки занимается серийным производство этих приборов; компания «Синтол» — это маркетинг, реагенты, продажа, продвижение. В прошлом году консорциум поставил 70 классических секвенаторов «Нанофор 5», в этом году планируется поставить 100. Разработаны и отечественные наборы GenSeq,для секвенирования по Сэнгеру, и ПО для анализа данных.
Консорциум стремится выстраивать полностью российские технологические линейки, не зависящие от поставок ни от запада, ни от востока, сказал докладчик. Переход на отечественную химию и расходники должен был снизить затраты на секвенирование в пять раз. На самом деле снижение еще больше, если учесть относительно невысокую стоимость эксплуатации «Нанофоров». Появились наборы для распространенных задач, в частности, набор GeneProfile Human для ДНК-идентификации личности по 28 STR-маркерам. Начата разработка прибора «Нанофор 06», который позволяет работать на 8, 16 или 24 капиллярах в зависимости от потока.
Сравнение GenSeq с ушедшими американскими аналогами показало, в частности, что GenSeq, в отличие от BigDye, может читать первый нуклеотид сразу за праймером, что важно для чтения коротких ампликонов. Как пример, докладчик продемонстрировал результат секвенирования образца, сохраненного в парафиновом блоке, которое проводилось в Институте онкологии (Санкт-Петербург) в группе Евгения Имянитова. Блоки FFPE — сложный случай для секвенирования, тем не менее все 100 нуклеотидов были прочитаны и найдена интересующая замена.
«Нанофор» также можно использовать в качестве альтернативы прибору Agilent Bionalazer, то есть проводить на нем оценку качества и относительного количества геномных библиотек.
Что касается секвенатора «Нанофор СПС» (секвенирование путем синтеза, то есть это уже NGS), 21 апреля был подписан лицензионный договор с Министерством здравоохранения РФ; фактом подписания этого договора получено разрешение на производство, и до конца года планируется получение установочной серии. (Подробнее об этом приборе на PCR.NEWS.)
Докладчик напомнил, что способ размножения молекул ДНК — получения «молекулярных колоний», который использует в том числе Illumina, запатентовал еще в 1990-е годы Александр Борисович Четверин из Института белка в Пущино. «Что касается ячеек — мы наладили их серийное производство, и опять же, в основе химии, которую мы используем, лежат разработки российских ученых, лаборатории, которой длительное время руководил Андрей Дарьевич Мирзабеков».
Яков Алексеев рассказал о проблемах, которые решаются и будут решаться в ближайшее время — с инкорпорирующей смесью, параметры и эффективность которой научились контролировать, с оптической системой прибора, которую нужно оптимизировать, чтобы повысить количество прочтений.
В дальнейших планах — российская платформа для одномолекулярного секвенирования. «Наш коллектив в консорциуме еще с несколькими организациями — туда входят Институт спектроскопии РАН, ФИЦ информационных и вычислительных технологий, МГТУ им. Баумана, Алферовский университет — заканчивает разработку опытного образца первого отечественного одномолекулярного секвенатора, аналога PacBio», — сказал Яков Алексеев.
В заключение выступил ведущий организатор конференции Владимир Зубов (ИТЭБ РАН) с традиционным обзором новинок секвенирования. Он напомнил, как Джеймс Уотсон во время своего визита в Россию в 2008 году сказал, что секвенировать геном человека стоит 60-80 тысяч долларов, то есть примерно столько же, сколько «Порше», а для культурного человека иметь секвенированный геном гораздо важнее, чем машину. Сейчас стоимость опустилась примерно до 400 долларов, в некоторых местах еще дешевле; это уже цена не самого дорогого электросамоката.
Illumina близка к тому, чтобы потерять свое лидерство. NovaSeq 6000, лидирующий по производительности, появился шесть лет назад, новые модели NovaSeq X и NovaSeq X+ могут секвенировать с 30-кратным покрытием 64 человеческих генома в день. Но приходят конкуренты: Singular Genomics с платформой G4, Element Bioscience с Element AVITI, Ultima Genomics c UG 100. Pacific Biosciences выпустила секвенатор Revio нового поколения за 779 долларов, который позволяет секвенировать длинными ридами геном человека за 1000 долларов. Самые опасные конкуренты американских компаний — это китайцы, причем приборы у них на 30% дешевле, а работают они не хуже. Американцы могут противопоставить этой экспансии только санкции, как и произошло с BGI. Но у китайцев есть и другие компании, например GeneMind. Докладчик предположил, что последняя модель в ее линейке, напоминающая Illumina MiSeq, но более производительная, может оказаться основным конкурентом нашему «Нанофор СПС». Быстро дешевеет и начинает вытеснять другие платформы нанопоровое секвенирование.
Докладчик напомнил, что в ноябре 2021 года «Роснефть» оценила инвестирование в центр геномного секвенирования на первом этапе в 22,5 миллиарда рублей. В Китае (при цене за геном 175 долларов) за такие деньги сейчас можно отсеквенировать 1,5 миллиона геномов, в России — не менее 200 тысяч; «Роснефть» собиралась отсеквенировать 100 тысяч геномов.
Но есть и хорошие новости: за границей регулярно выходят подробные обзоры рынка секвенирования. И вот в марте 2023 года появился российский обзор под названием «Секвеномика», подготовленный Росконгрессом, хотя и небольшой по объему. Владимир Зубов напомнил, что полногеномное секвенирование уже приносит значительную прибыль компаниям, которые им занимаются, и отрасль заслуживает внимания и серьезного отношения.


 Меню
Меню





 Все темы
Все темы




 0
0








