Евгений Кунин: «Есть ли объективные характеристики геномов и белков высокопатогенных коронавирусов?»
Евгений Кунин и его коллеги опубликовали препринт работы, посвященной анализу геномов коронавирусов, патогенных для человека. Они обнаружили общие генетические характеристики у всех трех вирусов с высокой летальностью — SARS-CoV, MERS-CoV и SARS-CoV-2. Эти черты отличают высокопатогенные коронавирусы, от четырех других, сезонных, вызывающих легкие заболевания. (Евгений Кунин — эксперт с мировым именем в области компьютерной и эволюционной биологии, сотрудник Национального центра биотехнологической информации Национальных институтов здравоохранения США, Бетесда.)

Евгений, откуда возникла идея вашей работы?
Общая идея работы довольно понятна, но я должен сделать экскурс в мою собственную историю. Я по образованию вирусолог и в давние годы, более 30 лет назад, мы сделали довольно важные работы по коронавирусам. Тогда появились первые расшифрованные геномы. Они, как теперь уже известно многим, самые большие и самые сложные среди РНК-овых вирусов. И они очень сильно отличаются от других, в их протеинах есть довольно много необычного. И вот тогда, когда они появились в поздние 80-е годы, просто ничего не было понятно! Что там вообще такое кодируется?!
Тогда уже были известны человеческие вирусы, или вы работали с животными?
Нет, никаких человеческих не было, были птичьи и мышиные. Никаких внятных идей, что это может быть важно для человека, не было, хотя подумать об этом можно было и тогда. Нам было просто интересно. Мы сделали пару статей, которые были довольно основополагающими в этой области, что видно по цитированию в последующие годы. Это такой краткий экскурс…
Теперь, 30 лет спустя, имeя большой опыт работы с эволюцией РНК-овых вирусов, было бы как-то даже стыдно «сидеть на печи». Поэтому я стал думать: а что мы можем на эту тему сделать? В последнее время мы довольно широко пользовались методами машинного обучения. И я подумал, что нужно применить эти методы, совместить их с нашей экспертизой в области анализа геномов и попытаться ответить на простой вопрос: есть ли какие-то объективные характеристики геномов и белков высокопатогенных коронавирусов, по сравнению с низкопатогенными и непатогенными?
Вы поставили самый острый вопрос из всех возможных.
Надо полагать, что да. Но мы были морально подготовлены к этому, потому что не так давно сделали аналогичную работу по вирусам папиллом, стараясь отличать онкогенные штаммы от неонкогенных. Это было несколько месяцев назад. И что-то там получилось. Те подходы, которые там были применены, мы сюда и перенесли. И эти самые нейронные сети обучали на геномах высокопатогенных штаммов против низкопатогенных и непатогенных штаммов, требуя от них выделить те особенности, какими бы эти особенности ни были, которые их различают статистически достоверно. Методы машинного обучения хороши тем, что работают быстро, и тем, что они нечто гарантируют. Они говорят: вот, мы нашли такие особенности, и эти особенности лучше для того, чтобы дифференцировать одну кучку от другой. Патогенные штаммы от непатогенных.
Вы нашли, насколько я понял из статьи, 11 участков в геномах, которые их отличают, из них 4, которые коррелируют с изменениями в белках.
Да.
Но вы смотрели почему-то, этого я не понял, только большие участки — инсерции и делеции. А единичные замены нуклеотидов не смотрели. Или машина не умеет?
Понимаете, это не совсем так, если внимательно смотреть на то, что там говорится. Там, где дело касается сигналов ядерной локализации, шла речь и о единичных заменах. Но нужно еще раз подчеркнуть, что эти самые методы машинного обучения умеют то, что они умеют. Они дают некую «гарантию», что это — лучшие черты, лучшие особенности. Но эти лучшие особенности должны быть относительно большими. Если есть одна позиция, эти методы такого не улавливают. Мы сейчас развиваем эти исследования, стараемся смотреть более точно и внимательно, где можно дойти до одной позиции. Здесь разрешение пониже, зато «фирма гарантирует». Вставки и делеции — это более драматическая вещь.
Когда вы или программа смотрите на выравнивание последовательностей, то очень четко видно, когда туда что-то вставлено (выравнивание — как раз и есть сравнение последовательностей РНК вирусов, когда эти последовательности размещают друг под другом, чтобы увидеть сходство или различие в «текстах» геномов; в данном случае сравнивались последовательности, кодирующие белки, — PCR.news). Это, грубо выражаясь, легко заметить. Человеческому глазу, когда он смотрит на такое количество материала, труднее, хотя и можно. А такой программе это легко… И мы кое-что нашли — статистически достоверные различия в двух белках. А именно: в так называемом нуклеокапсидном белке и, что особенно интересно и немедленно привлекает внимание, в белке спайка.
Поясните, пожалуйста, что это за белки.
Нуклеокапсидный белок — это белок, который находится внутри вирусной частицы и там одевает вирусную РНК. А спайк — это белок, который «торчит» с поверхности вирусной частицы, взаимодействует с рецептором клетки хозяина и отвечает за слияние вирусной мембраны с клеточной.
Обнаружилась вот какая особенность: обнаружилось, что у этих высокопатогенных штаммов значительно более выраженные сигналы ядерной локализации нуклеокапсидных белков, а также их экспорта из ядра.
Наверное, я плохо разбираюсь в жизненном цикле этого вируса, я не совсем понял, что такое «ядерная локализация»?
Конечно, вы плохо разбираетесь в жизненном цикле этого вируса, но это не ваша проблема, а проблема общая. Мы все в нем плохо разбираемся. Ядерная локализация — это когда протеин находится в ядре клетки.
Зачем ему туда?
А хрен его знает, зачем ему туда! Знал бы, так не скрывал.
Это не может быть потому, что внешняя ядерная мембрана — это то же самое, что мембрана эндоплазматического ретикулума, а вирус туда заходит, когда собирается в частицы?
Да, конечно. Как и любой, практически, РНК-вирус, он размножается и созревает, создавая какие-то свои мембранные фабрики в эндоплазматическом ретикулуме. Это правильно. Что касается того, потому ли он попадает в ядро, что ядерная мембрана — это как бы часть эндоплазматического ретикулума, что само по себе правда, или по другим причинам, не знаю. Это очень плохо понятно. Какого черта он делает в ядре, мы не знаем, но известно, что он туда в каких-то количествах попадает. Путаница усугубляется тем, что усилен сигнал как ядерной локализации, так и выхода из ядра. Мы не знаем, «болтается» ли этот нуклеокапсидный белок между ядром и цитоплазмой сам по себе или вместе с вирусной РНК. Но мы можем сказать совершенно объективно и подтвердить статистическими расчетами, что у высокопатогенных штаммов этот ядерный сигнал намного сильнее.
То есть, они гораздо активнее залезают внутрь ядра?
Белки нуклеокапсида внутрь идут активнее и, вероятно, наружу идут активнее, двигаются между цитоплазмой и ядром.
У вас есть какие-то предположения, почему это ядерное «хождение туда-сюда» так вредно, повышает летальность?
По-хорошему — нет. Это нужно изучать. Имеются какие-то данные, что это как-то нарушает клеточный цикл и может оказывать дополнительный цитопатогенный эффект на зараженные клетки…
По одной из ссылок, которые вы даете в статье, есть работа по первому вирусу SARS на эту тему…
А первый ничуть не хуже второго! Это важно упомянуть, что эти два SARS принадлежат к одной эволюционной ветке всех коронавирусов. А МERS — к другой ветке, и сильно от них отличается. И, тем не менее, эти особенности, которые мы нашли, накапливаются независимо в обоих вирусах SARS и в MERS. Что заставляет нас довольно сильно верить в то, что они действительно важны для патогенности.
И тут появляется вопрос: а как это эволюционно может возникнуть? Чистая конвергенция?
Да, да, конвергенция. На таком уровне это вполне реально, мы еще к этому вернемся. Когда говорят, что какие-то «энзимы» возникли конвергентно — это очень часто люди понимают неправильно. Этого статистически не может быть. Но вот такие небольшие особенности могут возникнуть конвергентно. И возникают.
А заимствовать они не могут у какого-то другого вируса?
Никаких указаний, что они могут заимствовать именно это, не существует. Это должен быть довольно сложный процесс рекомбинаций. Думаю, что это исключительно маловероятно.
Понятно с белком нуклеокапсида. А что по второму белку, в котором вы нашли черты, характерные для высокопатогенных вирусов?
Это спайк-белок, который вызывает больший интерес у всех по очевидным причинам, потому что непосредственно взаимодействует с рецептором на поверхности клеток хозяина. Он сложный, состоит из двух частей. В одной части находятся те участки, которые взаимодействуют с рецептором, а в другой части находятся те участки, которые, обеспечивают слияние вирусной мембраны с клеточной после взаимодействия с рецептором. Что мы там наши? Мы нашли вставки, которые различают патогенные и непатогенные штаммы, а также штаммы, перешедшие к человеку, от не перешедших. И вставки эти обнаружились не абы где, а ровно в этих интересных местах, которые отвечают за узнавание рецепторов и за слияние мембран.
Что важно: мы нашли вставки непосредственно в районе, который взаимодействует с рецептором, и у двух SARSов и у MERSа. Это очень драматично. Потому что у обоих SARSов рецептор один и тот же — ACE2, а у MERSа — совершенно другой мембранный белок. Но вставки есть у всех трех вирусов, разные по последовательностям, но в одном районе. Они дают дополнительные взаимодействия, по-видимому, усиливая аффинность. У SARS-2 есть еще одна вставка, которая, по-видимому, увеличивает эффективность расщепления хозяйской протеазой, так называемым фурином, этого самого спайк-протеина на два фрагмента. И еще дополнительно увеличивает аффинность к ACE2.
Расскажите про фурин. Для чего вирусу нужно, чтобы его спайк-белок расщеплялся?
Фурин — это «хозяйская» протеаза, то есть, энзим, который расщепляет белки. Он расщепляет этот самый спайк-гликопротеин коронавирусов на две части. Это нужно для узнавания рецептора и проникновения в клетку. И он расщепляет на то, что нужно для узнавания рецептора, и на то, что нужно для слияния. У второго SARS действительно есть вставка в области узнавания фурином, который увеличивает эффективность этого процесса. Другие люди это пронаблюдали, и мы в этой статье ее не изучали, потому что наш подход был заточен на то, чтобы обнаруживать особенности, которые характерны для всех высокопатогенных штаммов, не для одного.
Как эволюционно могло произойти так много мутаций, и какой срок должен быть для производства такого количества инсерций и делеций, чтобы появился новый, высоколетальный коронавирус, который поражает человека? Там же не одна мутация, вы же описываете четыре значимых места.
Там четыре значимых места, а вероятно и больше. Но ничего такого удивительного в этом нет. Мутации происходят все время, они происходят в каждом цикле продукции вируса. Дело тут не столько в мутации, сколько в их фиксации в популяции. То есть, в селекции. И если есть позитивная селекция, то этот процесс может быть очень быстрым, может занимать короткие годы.
А не будет ли от этих мутаций плохо вирусу в предыдущем хозяине?
Это отличный вопрос! Судя по всему, не очень плохо. Я так говорю потому, что каждый из этих вирусов имеет весьма близких родственников в летучих мышах. В частности, если мы посмотрим только на ветку SARS, то там у первого SARS есть свои летуче-мышиные родственники, а у второго SARS — свои. То есть, два SARS – они близкие родственники, но у них есть в мышах родственники еще ближе. То есть, они происходили независимо от мышей. И уже мышиные вирусы все это имеют. И ничего, чувствуют себя достаточно хорошо, чтобы жить в этих мышиных популяциях. Из чего следует довольно отрезвляющий вывод: там еще полно этих штаммов, которые могут «перепрыгнуть» в человека, когда им этого захочется. И от каких-то дополнительных мелких особенностей может зависеть их конкретная патогенность. К этому нужно быть готовым.
Но почему коронавирусы с высокой летальностью так часто перепрыгивают из животного резервуара к людям именно в последнее время? Третий случай за двадцать лет.
На самом простом уровне ответ «не знаю». Дальше следуют мои достаточно банальные догадки по этому поводу. А заключаются они в следующем: это ерунда, что они «перескакивают» часто именно в последнее время. Они всегда «перескакивали» достаточно часто. Много лет. Вероятнее всего, много сотен лет, если не тысяч. Почему мы этого не знали? А потому, что была другая экология нашего социума, если можно так выразиться. Была низкая плотность населения, низкая интенсивность передвижения, почти никакой связи между азиатскими странами и Европой. И того, что несколько десятков или даже несколько сотен человек в Китае в какой-то сезон умерли от какой-то пневмонии, никто не знал. Не говоря уже о том, что не было никакой диагностики. До появления SARS никто не обращал никакого внимания на существование коронавирусов, на их циркуляцию. Никто и не думал, что они что-то там вызывают. А до последних 30 лет никто вообще ничего не знал про коронавирусы.
Такой подход, который вы применили в вашей работе, может иметь предсказательную силу? Можно предсказать, какие вирусы имеют опасный потенциал?
Да, конечно.
Помните историю с птичьим гриппом, когда две группы, голландская и американская, провели ряд экспериментов. Это была «мокрая» биология, исследователи утверждали, что вывели вирус птичьего гриппа, который может передаваться воздушно-капельным путем от человека к человеку. Nature и Science, насколько я помню, отказались даже это публиковать. Не есть ли некоторая опасность в том, что мы будем предсказывать такие вещи заранее? То есть, каждый будет знать, что если сюда вставить такое… «Мокрых» биологов полно, сделать легко, а потом результат — раз — и «убежал» из лаборатории.
Любые эксперименты с патогенными вирусами — дело опасное. Такие эксперименты вне соблюдения условий безопасности даже и задумывать нельзя. Но техники безопасности более-менее отработаны. Естественно, если вы делаете все эти вещи не вслепую, а на основе определенного знания, которое получено при изучении природных изолятов, опасность еще выше. Это понятно. Все это, конечно, опасно и достаточно страшно, но… Вот вернемся к мышам. Опасные штаммы уже циркулируют среди этих мышей, и нет оснований думать, что вы получите с высокой вероятностью суперштамм, который будет хуже всего, что есть в природе. А получить то, что так же плохо, как то, что есть в природе, — да, это возможно. Но оно уже там есть! Поэтому мне не кажется, что, проводя такого рода исследования, мы увеличиваем опасность каких-либо экспериментов. Она уже существует.
А можно ли предсказать, какие сейчас у природы есть выборы для дальнейшей эволюции этого коронавируса, который уже попал в человеческую популяцию?
Все направление эволюции или путей эволюции очень сильно зависят от конкретного хода этой эпидемии. Я бы не хотел здесь вдаваться в подробности, потому что не анализировал это сам. Может быть, мы в какой-то момент дойдем до этого в нашей работе, но это дело тонкое и более долгое. Все, что я хочу сказать: тут есть большая неоднозначность.
В чем практическая значимость вашего исследования? На что это может иметь выходы?
Во-первых, на предсказания новых патогенных штаммов. Во-вторых, на разработку новых противовирусных препаратов разного типа, как химических ингибиторов, так и антител. Есть еще много, что можно исследовать, и мы это продолжаем. Как говорится, следите за объявлениями.

Схематическое изображение выравнивания участков геномов коронавирусов для обнаружения регионов, которые отличают штаммы с высокой летальностью. В верхней части — 4 штамма с низкой летальностью, в нижней — высокопатогенные штаммы SARS-CoV, MERS-CoV и SARS-CoV-2. Показаны инсерции у высокопатогенных штаммов
Credit: Ayal B. Gussow et al.
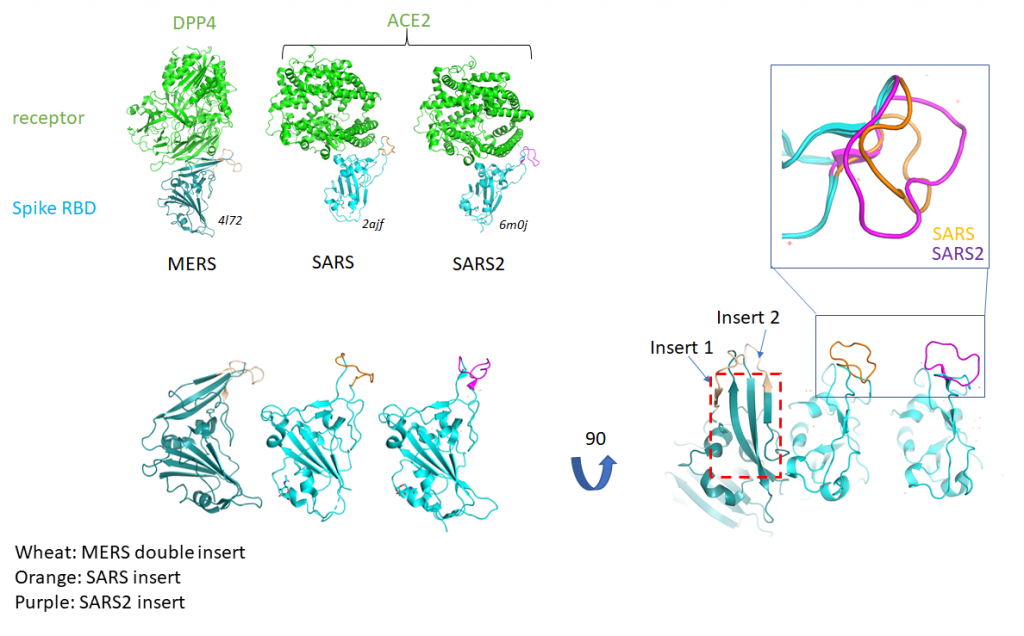
Структура белков спайка. Верхняя панель: взаимодействие между рецептор-связывающими мотивами и соответствующими рецепторами клеток человека. Нижняя панель: структуры рецептор-связывающих мотивов MERS, SARS-CoV и SARS-Cov-2. Справа: вставки в белках высокопатогенных вирусов.
Credit: предоставлено Евгением Куниным.


 Меню
Меню





 Все темы
Все темы




 0
0








