Грипп птиц: насколько опасен и как с ним бороться
Различаются ли вирусы гриппа людей, птиц и свиней? В чем разница между высокопатогенными и низкопатогенными? Какова эпидобстановка по гриппу в России? Распространяется ли высокопатогенный грипп птиц среди людей и опасны ли контаминированные вирусом пищевые продукты? Как быстро выявить вирус гриппа и секвенировать его геном? Ведущие специалисты обсудили эти вопросы на вебинаре «Грипп птиц и риски распространения потенциально пандемических вирусов на территории России», организованном при поддержке PCR.NEWS.

Дарья Даниленко, заместитель директора по научной работе НИИ гриппа имени А.А. Смородинцева, напомнила, что такое сезонный и пандемический грипп, высокопатогенный грипп птиц и потенциально пандемические вирусы. Существуют четыре типа вирусов гриппа: А, В, С и D. Типы А, В и С были открыты давно, а тип D — относительно недавно. Объектом внимания на вебинаре были исключительно вирусы гриппа типа А. Они были открыты американским патологом и ветеринаром Ричардом Шоупом в начале 1930-х годов. Вирусы гриппа А чрезвычайно разнообразны. На сегодня известно по крайней мере 18 подтипов гемагглютинина и 11 подтипов нейраминидазы. Все это разнообразие циркулирует в мире, но количество вирусов, обнаруженных для каждого подтипа, сильно различается. Так, подтипы H17N10 и H18N11 характерны только для вирусов гриппа летучих мышей, поэтому на вебинаре их не рассматривали, уделяя внимание только вирусам подтипов H1-H16 и N1-N9.
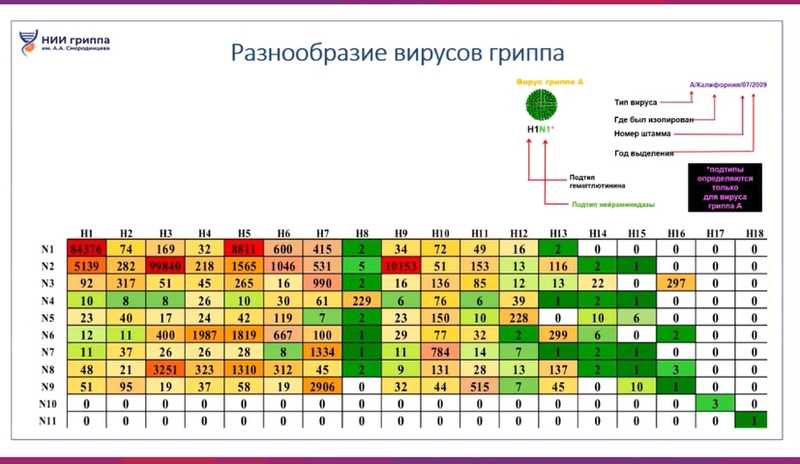 Тепловая карта подтипов вирусов гриппа. Чем краснее цвет, тем большее количество вирусов выделено и описано
Тепловая карта подтипов вирусов гриппа. Чем краснее цвет, тем большее количество вирусов выделено и описано
Существует два основных механизма изменений вирусов гриппа. Один из них — антигенный дрейф, то есть постепенное накопление мутаций. Вирусы гриппа высокоизменчивы, и когда вирус размножается в клетке хозяина, в его геноме постоянно возникают мутации. Вот почему вакцины от гриппа ежегодно обновляют по одному или даже по нескольким компонентам. Второй механизм — антигенный шифт. Если разные вирусы заражают одну клетку одновременно, их геномы могут перемешиваться внутри клетки, подобно колоде карт.
Дарья Михайловна рассмотрела эти механизмы подробнее. Первый пример: некий вирус циркулирует среди свиней, передается от одного животного к другому, каждый цикл репликации приводит к небольшому изменению вируса, и в какой-то момент времени возникает вирус, который будет лучше распространяться в свиньях и вызывать инфекцию с более выраженным клиническим течением. А ученые отслеживают эти изменения, чтобы адаптировать стратегии профилактики.
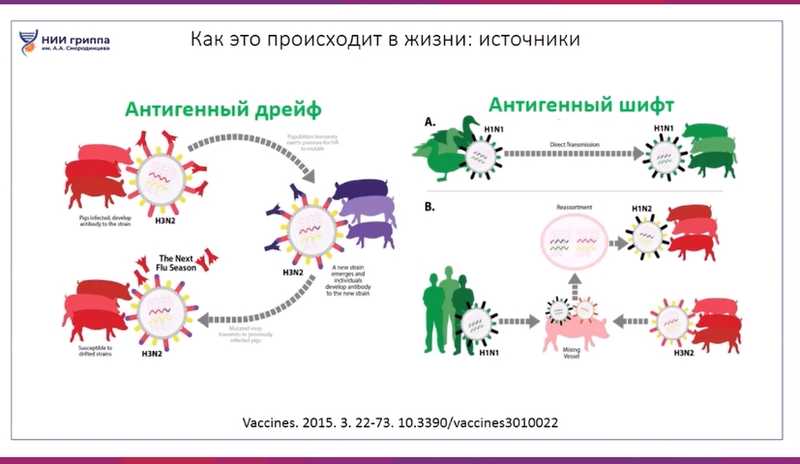
Второй пример иллюстрирует антигенный шифт — более сложное явление, в котором, как правило, задействовано несколько хозяев. Например, это может быть человек, зараженный сезонным вирусом гриппа H1N1, и свиньи, среди которых циркулирует вирус гриппа H3N2. И вот одно животное одновременно получило вирусы от своих соседей-свиней и от работника, который за ними ухаживает. В результате возник реассортантный штамм, содержащий гены и того, и другого вируса, с другой антигенной формулой, и он проникает в популяцию свиней.
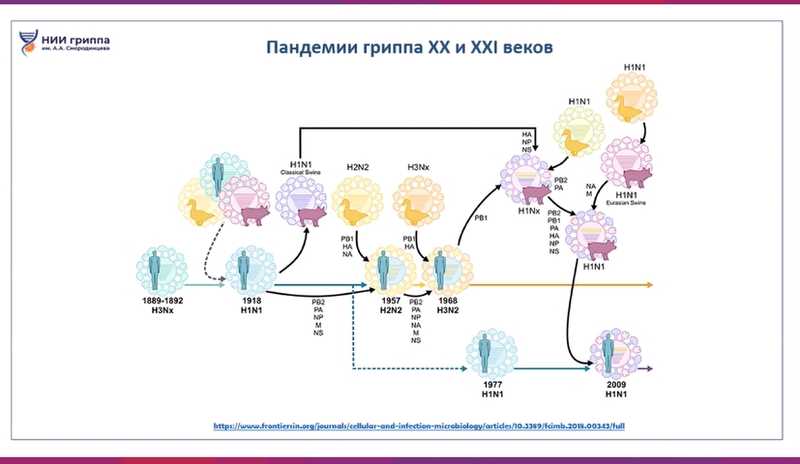
В XX и XXI веках были пандемии гриппа, вызванные штаммами, которые сформировала реассортация вирусов гриппа птиц, свиней и людей. Это небыстрый процесс, и пандемии происходят через разные промежутки времени. Между «испанкой» и пандемией 1957 года прошло почти 40 лет, следующая началась всего через 10 лет, а после 1968 года был перерыв до 2009-го.
Природный резервуар всех вирусов гриппа А — водоплавающие птицы. В птицах сосуществуют все вирусы гриппа А и, как правило, оказывают минимальное влияние на их здоровье: из 16 подтипов гемагглютинина и 9 подтипов нейраминидазы только ограниченное их число имеет ветеринарную значимость. При этом можно разделить вирусы на низкопатогенные (H5, H6, H7, H9) и высокопатогенные (H5, H7).
Распространенность вирусов гриппа среди водоплавающих птиц изучали десятилетиями (залив Делавер, 1985-2008 гг., Канада, 1976-2007 гг.). Вирусы широко распространены среди молодых особей, кроме того существует временная и пространственная вариация уровня инфицированности птиц. Самое главное, что эти вирусы долго сохраняют инфекционность в окружающей среде; например, в холодной воде — более 200 дней. Известно, что в природе существуют естественные резервуары отдельных подтипов вирусов гриппа птиц, например, H13 чаще всего встречается у чаек. Процесс реассортации происходит постоянно, тем не менее подтипы, встречающиеся у птиц, могут меняться от сезона к сезону. И конечно, вирусы гриппа от разных птиц способны обмениваться геномными сегментами.
Почему обычный низкопатогенный вирус становится высокопатогенным? Как правило, высокая патогенность связана с наличием полиосновного сайта расщепления в гемагглютинине. Приобретение такого сайта делает вирус высокопатогенным, вызывающим летальные инфекции у птиц. Вирусы подтипа H5 и H7 — на сегодня единственные, описанные как высокопатогенные.
О том, насколько опасен вирус, говорит его индекс патогенности. Цыплят заражают вирусом гриппа, и ежедневно оценивают их состояние от 0 (все в порядке) до 3 баллов (смерть). Если индекс равен 0 на протяжении 10 дней, то вирус низкопатогенный. А если индекс равен 3, это означает, что все птицы погибли за 24 часа, и это максимальный уровень патогенности.
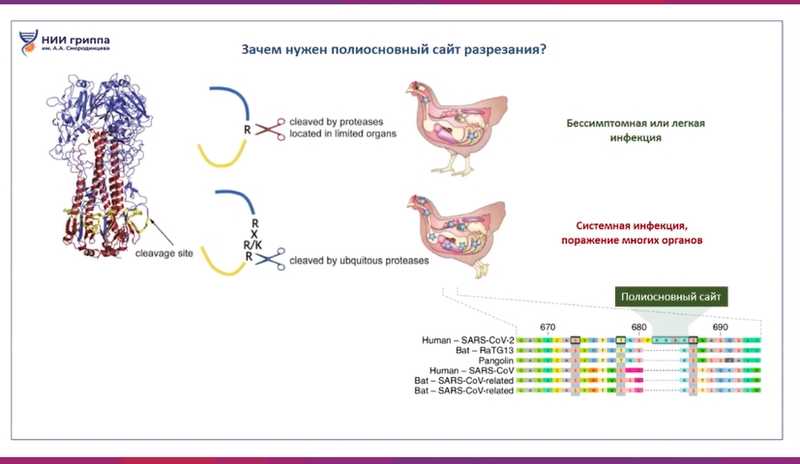
Зачем нужен полиосновный сайт? Разрезание гемагглютинина очень важно для инфекционной активности вируса. Вирус с обычным сайтом разрезается протеазами только в ограниченном количестве органов и тканей. У птиц такие вирусы вообще не вызывают инфекции, либо она протекает легко. Вирус же с полиосновным сайтом разрезается протеазами практически во всех органах и тканях и вызывает тяжелую системную инфекцию.
Те варианты, что регистрировались до 1996 года, как правило, не сохранялись в природе и вымирали. До 2002 года высокопатогенные вирусы гриппа редко встречались у диких птиц. Но с недавнего времени появился особый генетический вариант, который закрепился в популяции и распространяется не только среди домашних, но и диких птиц. Это распространение происходит массово – в 2024 году вирус добрался и до Антарктиды (подробнее на PCR.NEWS).
В 2024 году впервые было установлено, что высокопатогенный грипп птиц H5N1 вызывает инфекцию у коров. Таким образом, риски вышли на новый уровень — это млекопитающие, которых разводят в промышленных масштабах, популяция коров очень велика. Этот вирус не очень хорошо выявляется в респираторном тракте, но при этом отлично сохраняется и является инфекционным в молоке. Это молоко, по всей видимости, с помощью капель может заражать животных и людей. Кошки, жившие на фермах, массово умирали от инфекции H5N1.
Работники на этих фермах тоже заражались такими вирусами. Первые три случая описаны очень подробно. Интересно, что у всех этих людей развивался конъюнктивит, в мазках из глаз был обнаружен вирус гриппа. У одного из них вирус выделялся при кашле, и потенциально он мог бы распространять этот вирус. Все заразившиеся люди выздоровели. Всего в 2024 году в США зарегистрировано 14 случаев инфицирования людей вирусами Н5.
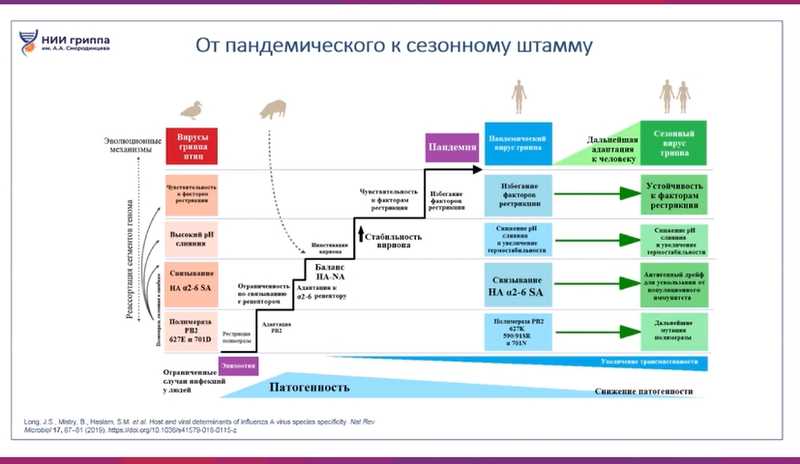
Дарья Михайловна подчеркнула, что хотя переход от пандемического вируса к сезонному вирусу происходит через снижение его патогенности, важно эффективное реагирование специалистов: своевременное выявление новых вирусов как на клиническом, так и на ветеринарном уровне, а также на уровне мониторинга инфекции среди птиц, сельскохозяйственных животных и, безусловно, среди людей.
Второй докладчик, Василий Марченко, руководитель сотрудничающего Центра ВОЗ по изучению вирусов гриппа в точках пересечения экосистем людей и животных, рассказал о высокопатогенном вирусе гриппа птиц в России.
В 2023 году в мире зафиксировано несколько тысяч отдельных вспышек среди диких и домашних животных более чем в 70 странах, что превышает показатели прошлых лет. Наиболее распространенный в настоящее время вариант вируса гриппа H5N1 клады 2.3.4.4b стал чаще заражать млекопитающих, продолжают регистрироваться случаи заболевания среди людей. Поэтому необходим постоянный комплексный мониторинг высокопатогенного вируса в местах наиболее вероятного контакта человека с основными хозяевами.
В структуре Роспотребнадзора действует комплексная система мониторинга вируса гриппа, в которую входят сотрудничающий Центр ВОЗ и 48 региональных учреждений Роспотребнадзора: центры гигиены и эпидемиологии, противочумные станции. Они взаимодействуют с учреждениями Минздрава и Россельхознадзора, обеспечивают сбор и первичную диагностику биоматериала на наличие вируса гриппа. В случае выявления вирус направляется в Центр для изоляции и углубленного изучения. Деятельность региональных лабораторий контролируется тремя опорными базами: управлениями Роспотребнадзора по Хабаровскому краю, Новосибирской области и Краснодарскому краю.
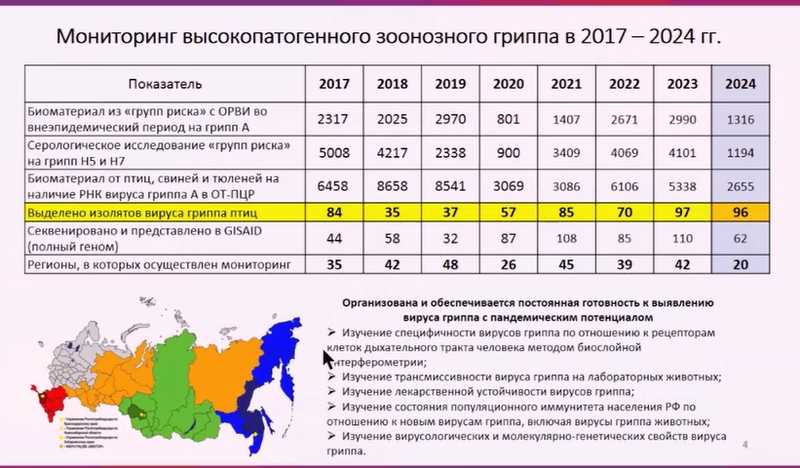
Ежегодно мониторинг вируса гриппа проводится более чем в 30 регионах России. Специалисты собирают тысячи образцов от людей и животных: птиц, свиней, морских млекопитающих. Это позволяет своевременно выявлять наиболее актуальные циркулирующие варианты вируса гриппа и изучать их с помощью широкого спектра методов, таких как анализ рецепторной специфичности, исследование трансмиссивности на лабораторных животных и чувствительности к противовирусным препаратам.
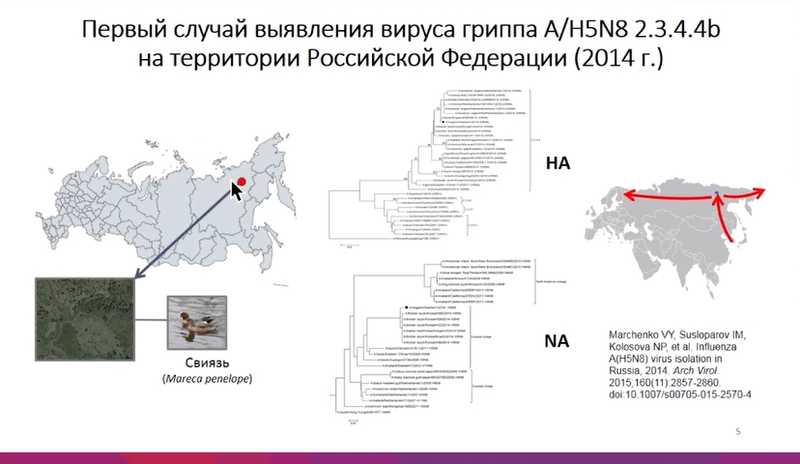
Система мониторинга доказала свою эффективность при раннем обнаружении вирусов гриппа. Так, в 2014 году на территории Республики Саха был выявлен первый случай заноса на территорию России вируса H5N8, новой в то время клады 2.3.4.4b. Он был занесен из Юго-Восточной Азии и впоследствии распространился в Европу.
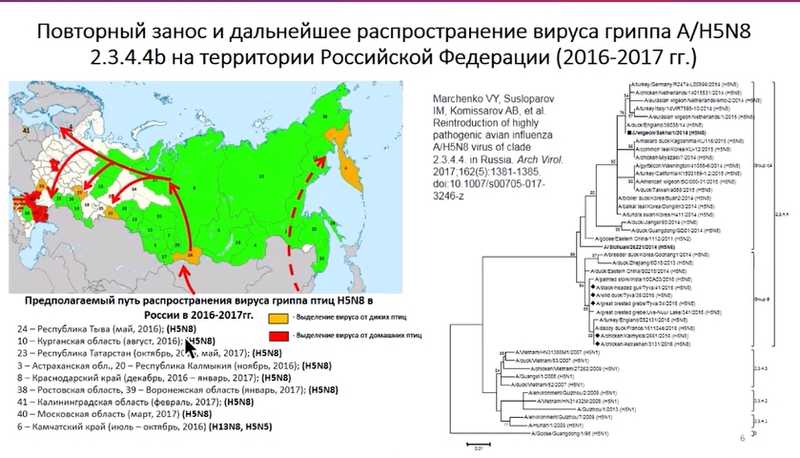
Повторный занос вируса H5N8 был зарегистрирован на территории республики Тыва в ходе большой совместной экспедиции весной 2016 года. Вирус «прилетел» с дикими птицами и распространился на запад, вызывая вспышки среди диких и домашних птиц в южных регионах России, а затем «полетел» дальше и дал начало масштабной эпизоотии в Европе, которая продолжается и в настоящее время.
В 2020 году специалисты Центра зафиксировали первый случай инфицирования человека вирусом гриппа H5N8 — у сотрудника птицефабрики на территории Астраханской области. Случай протекал бессимптомно и не имел серьезных последствий. Позднее штамм из Астрахани был выбран Всемирной организацией здравоохранения в качестве кандидатного вакцинного штамма подтипа H5N8 клады 2.3.4.4b, и он актуален до сих пор.
В июне 2021 года ГНЦ ВБ «Вектор» получил статус сотрудничающего центра ВОЗ по изучению гриппа и стал одним из семи подобных центров. Распространение высокопатогенного вируса в мире с начала эпизоотии 2016-2017 гг., вызванной вирусами клады 2.3.4.4b, стало беспрецедентным, и эпидситуация в нашей стране постоянно отслеживалась. География распространения вируса расширилась, особенно в последние годы. К 2023 году специалисты зарегистрировали циркуляцию вируса гриппа H5N1 более чем в половине из 42 регионов России, где проводили мониторинг. Значительное количество положительных образцов, особенно в западных регионах и Центральном федеральном округе, были получены от диких птиц – чаек, которые принесли вирус из Европы.
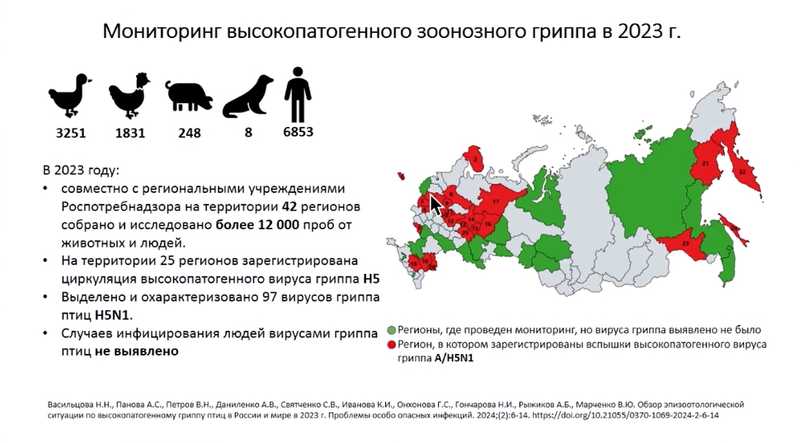
Все вирусы гриппа H5N1 из России относились к кладе 2.3.4.4b, наиболее распространенной в мире и связанной с подавляющим большинством зарегистрированных вспышек. Они обладают значительным сходством с кандидатным вакцинным штаммом из Астрахани, в том числе по антигенным свойствам в реакции торможения гемагглютинации.
Важный аспект работы по оценке пандемического потенциала — изучение рецепторной специфичности вирусов, то есть анализ их способности присоединяться к рецепторам клеток человека или животного. Метод биослойной интерферометрии показал, что все вирусы, циркулирующие в последнее время, взаимодействуют только с так называемыми рецепторами «птичьего» типа (a2-3).
Не менее важно изучение трансмиссивности, то есть способности к аэрозольной передаче вирусов гриппа. Ученые разработали специальную аэродинамическую установку, которая позволяет моделировать аэрозольную передачу между животными (обычно это хорьки) при заданных параметрах температуры, влажности и скорости воздушного потока. Вирусы, способные к стабильной передаче между млекопитающими, пока не обнаружены. В целом риск распространения таких вирусов гриппа в человеческой популяции оценен как минимальный.

Однако периодически антитела к зоонозным вариантам вируса гриппа в сыворотках крови людей все-таки выявляются. В 2023 году антитела к вирусу H5 обнаружены только в одной сыворотке. При этом докладчик обратил внимание на увеличение числа случаев обнаружения антител к вирусам гриппа H9N2 в последние годы. В 2023 году таких случаев было 39.
Специалисты Центра проводят ежегодную оценку качества ПЦР-диагностики гриппа среди учреждений Роспотребнадзора. Они рассылают в организации специальные наборы инактивированных вирусов, включающие как зоонозные варианты, так и вирусы сезонного гриппа. Результаты такой внешней оценки качества показывают, что диагностика в нашей стране находится на высоком уровне, и ее качество растет.
Василий Юрьевич отметил, что деятельность Центра не ограничивается территорией Российской Федерации. С 2016 года его специалисты проводят мониторинг вируса гриппа в 12 провинциях Вьетнама. За это время собрано и исследовано более 3000 образцов от животных и людей в ходе 35 экспедиций, выделено и исследовано более 100 вирусов гриппа различных подтипов.
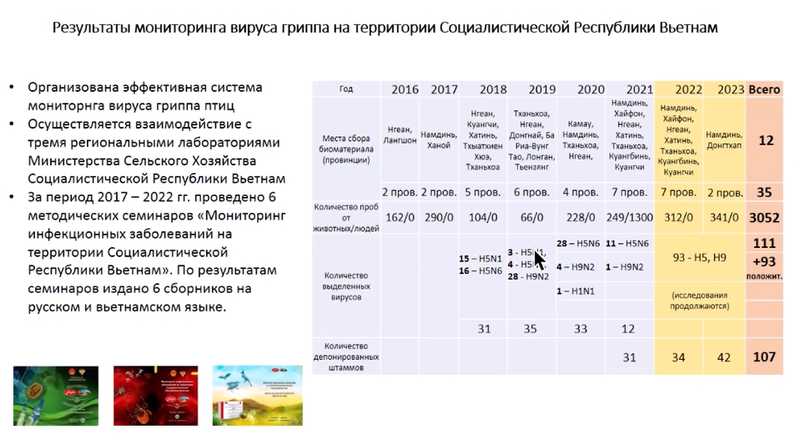
Ситуация по высокопатогенному гриппу остается напряженной. Продолжаются вспышки в странах Европы, Африки и Юго-Восточной Азии, сохраняется риск заноса новых вариантов на территорию нашей страны. Дальнейшее развитие ситуации во многом будет зависеть от комплекса своевременно принятых противоэпизоотических и противоэпидемических мер.
Прозвучал вопрос от слушателя: каким образом в представленной системе мониторинга учитываются результаты проб от диких птиц, исследованных другими организациями, не входящими в систему Роспотребнадзора? Василий Юрьевич ответил, что они с коллегами учитывают опубликованные данные, кроме того, налажено взаимодействие с учреждениями Россельхознадзора, в частности, ВНИИЗЖ. Центр также взаимодействует с НИИ гриппа.
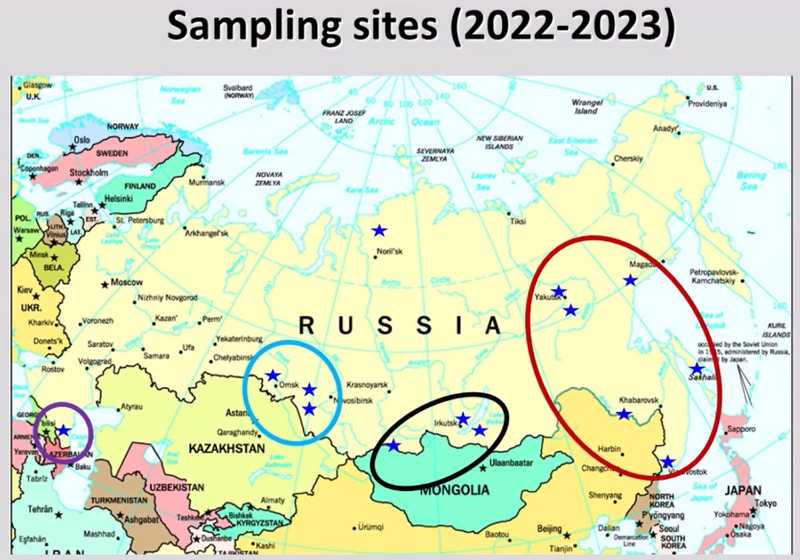
Доклад о распространенности вирусов гриппа у диких перелетных птиц на территории России прочитал Кирилл Шаршов, заведующий лабораторией молекулярной эпидемиологии и биоразнообразия вирусов Института вирусологии ФИЦ ФТМ. Он рассказал об исследованиях, которые они с коллегами провели в 2021-2023 годах, показал на карте места, где выделяли вирус гриппа у диких птиц. Это Дальний Восток, Центрально-Азиатский регион, включая Забайкалье и границу с Монголией, юг Западной Сибири и небольшой участок Каспийского региона.
В 2022 году было получено более 1000 образцов, примерно в 8% были выделены вирусы гриппа. Для многих из них получены полные последовательности генома. Докладчик подчеркнул, что кроме вируса гриппа они выделили и парамиксовирусы, которые являются серьезной проблемой для ветеринарии (вирус болезни Ньюкасла), а также обнаружили коинфекции разными вирусами и пока не идентифицированные вирусы, которые также могут иметь значение для ветеринарии. В 2023 году картина была схожей, низкопатогенный вирус гриппа обнаружили в 49 случаях.
Ключевые точки сбора образцов были рассчитаны на основе экологических данных о перелетах и сезонных изменениях в образе жизни птиц. Такими условными ключевыми точками были юг Западной Сибири, граница с Монголией, Забайкалье и две точки на Дальнем Востоке на границе с Китайской Народной Республикой. Кроме вируса гриппа у диких уток, специалисты обнаружили сочетанные инфекции с другими вирусами — птичьим парамиксовирусом и птичьим коронавирусом. На Дальнем Востоке был даже один случай инфекции тремя вирусами одновременно.
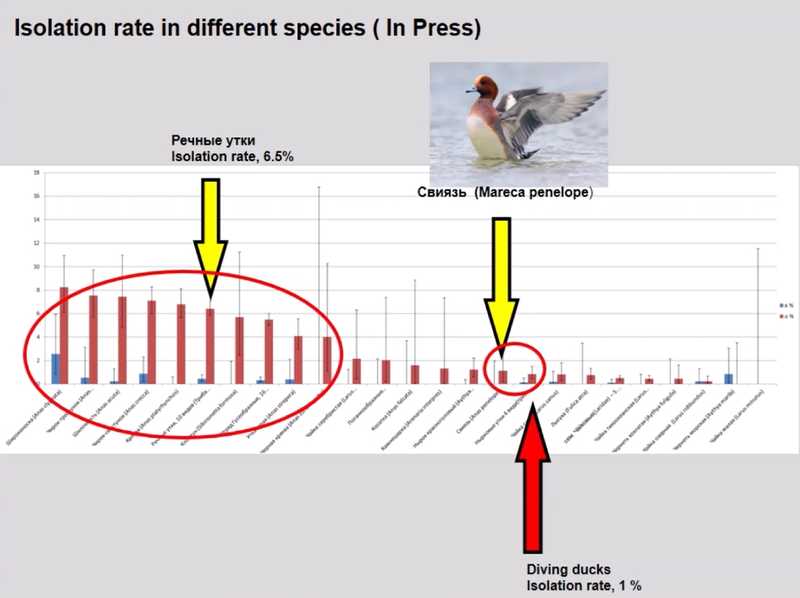
Кирилл Александрович рассказал о резервуарах низкопатогенного вируса гриппа в Азии. Оттуда происходят эпидемиологически значимых вирусов, о которых говорилось предыдущих двух докладах. Мониторинг на протяжении 10 лет показал, что среди 29 вовлеченных видов (тех, образцы от которых хоть один раз были положительными на грипп) до 10 % содержали низкопатогенный вирус гриппа. Наибольший объем генного пула вирусов гриппа — это речные утки (до 10% выделения вируса), чайки и некоторые другие виды птиц. Интересно, что один вид речной утки (свиязь Mareca penelope) выбивается из общей картины и имеет низкий процент вирусоносительства, по этому показателю он сравним с чайками. Это наблюдается не только в нашем регионе, но и в Северной Америке.
Далее докладчик представил информацию о субтипах, которые они с коллегами обнаружили в азиатской части России. Из 44 субтипов низкопатогенного гриппа наиболее распространенными были Н3N8 и H4N6, однако присутствовали и другие, более актуальные для ветеринарии, например, H6N6 и H3N6.
Исследователи изучили связь субтипов гемагглютинина с видами хозяев. Например, чирок-трескунок и кряква имеют совершенно различные наборы субтипов. Для чирка-трескунка показана строгая ассоциация с H3. Специалисты предполагают, что эти закономерности зависят от биологии видов-хозяев, но также и от конкуренции вирусов разных субтипов. Существует еще ассоциированность некоторых субтипов с регионами, и на разных территориях также проявляются конкурентные взаимоотношения между вирусами.
Известно, что в Китае, эндемичном для различных вирусов гриппа, они весьма разнообразны. Ученые надеются обнаружить связи между вирусами гриппа у диких птиц, которые перелетают весной в северные регионы, и картиной их распространения среди домашних птиц.
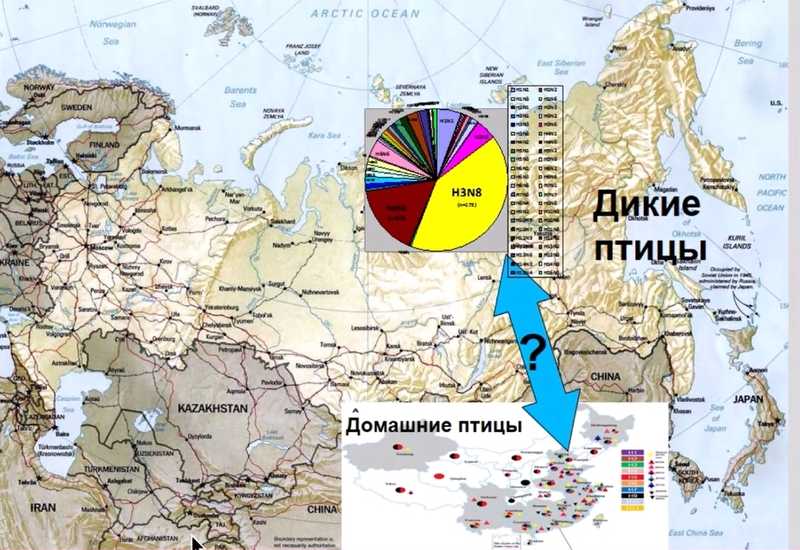
Для работы они выбрали субтип H6Nx и обнаружили, что даже в одной стае диких уток есть два абсолютно разных генетических варианта вируса — клада вируса диких уток и ветвь вируса домашних птиц из Китая. Анализ всех восьми геномных сегментов показал, что часть вирусов имеет полностью «домашние» или полностью «дикие» геномы, а часть – смешанный состав сегментов вследствие событий реассортации. Антигенный анализ (реакция торможения гемагглютинации) подтвердил различия этих двух групп. Таким образом, две ветви вируса в одной и той же популяции уток антигенно и генетически различаются.
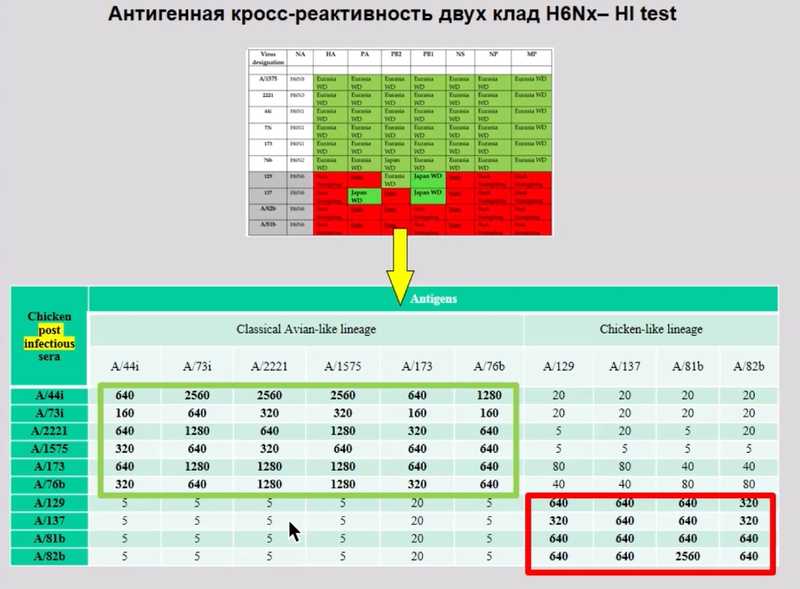 Состав генома вируса гриппа и результаты РТГА. Зеленым обозначения относятся к диким уткам, красные — к домашним.
Состав генома вируса гриппа и результаты РТГА. Зеленым обозначения относятся к диким уткам, красные — к домашним.
Ученые также оценили процессы реассортации у диких птиц на Дальнем Востоке. Среди них есть сложные реассортанты различных линий, также обнаружен один чистый американский вирус. Таким образом, показан генетический обмен сегментами между вирусами от домашних и диких птиц на Дальнем Востоке.
Затем докладчик остановился на высокопатогенных вирусах H5Nх, циркулировавших в последние годы в России. Одна из стандартных точек сбора образцов находится на границе Монголии и Российской Федерации. Среди вариантов, которые ученые выделили с 2021 года (о них уже упоминали ранее) есть реассортантные вирусы; один из таких вариантов появился в 2021 году, распространился на юге Западной Сибири, в Казахстане и стал основой для одного из генетических вариантов, проникших в Европу. Его геном содержит сегменты вирусов как диких, так и домашних птиц.
В 2022 году в Каспийском регионе произошла большая эпизоотия среди диких птиц. Погибло много диких птиц — в основном чайки, включая каспийских чаек и черноголовых хохотунов, и некоторые виды крачек. Гемагглютинин вируса принадлежал кладе 2.3.4.4b, которая в настоящее время активно распространяется по планете.
В 2023 году сложилась уникальная ситуация: вирус гриппа H5N1 начал поражать млекопитающих. На прошлой неделе у докладчика с коллегами вышла статья о вспышке H5N1 среди тюленей на острове Сахалин. Выделенный вирус принадлежит к кладе 2.3.4.4b, которая распространяется в том числе в Антарктиде и Приантарктическом регионе.
В целом многолетняя работа вирусологов показывает несколько вариантов переноса вирусных генов дикими птицами от домашней птицы и из районов зимовки, которые являются эндемичными (Китай и некоторые страны Восточной Азии). При этом происходит снижение патогенности и адаптация. Например, это показано для высокопатогенных вирусов H5Nx; в реассортацию были вовлечены в основном гены полимеразного комплекса.
Среди проблем, с которыми сталкиваются исследователи, докладчик выделил большое количество последовательностей, которые выкладывают коллеги из разных лабораторий и организаций, что затрудняет проведение анализа, а также проблему ресурсов, особенно компьютерных мощностей. В завершение доклада Кирилл Александрович подчеркнул, что эта огромная работа была сделана большим коллективом, с участием в международных проектах.
С точки зрения промышленного птицеводства проблему высокопатогенного гриппа осветил Николай Тарлавин, ассистент кафедры зоологии Санкт-Петербургского университета ветеринарной медицины. Болеют высокопатогенным гриппом и переносят его домашняя курица, индейка, утка и серый гусь - наиболее распространенные сельскохозяйственные птицы в России. Также вирус переносят чайка, дикая кряква, европейская свиязь, полярная крачка и лебедь шипун. Полярная крачка, мигрирующая между полюсами, может быть ответственной за проникновение высокопатогенного гриппа в неиммунные популяции пингвинов в Антарктиде.

Для крупных промышленных птицехозяйств наиболее актуальны аэрогенный, алиментарный и контактный пути передачи. Трансовариальный путь характерен для острого течения болезни у кур-несушек. Трансмиссивный и ятрогенный пути обычно связаны с нарушениями технологий содержания и кормления птицы, а также с отсутствием контроля размножения мух, комаров и клещей, дезинфекции персонала, тары и автотранспорта.
Факторы риска при эпизоотиях вируса гриппа птиц в личных подсобных хозяйствах и на крупных птицефабриках отличаются. Для личных хозяйств риски повышает отсутствие вакцинации, близость к птицефабрикам, свободный выгул птицы, обмен техникой с соседями и неконтролируемый въезд автотранспорта. Обилие водоемов также способствует распространению вируса. Для птицефабрик риски связаны с отсутствием биозащиты, неорганизованным входом посторонних, отсутствием изоляторов и площадок убоя, контаминированным подстилочным материалом и скученным содержанием птицы.
Традиционно в ветеринарии принято разделять грипп на H5N1, который считается крайне высокопатогенным и вызывает до 100% смертности среди бройлеров и несушек, и H9N2, который считается низкопатогенным, более опасным для бройлеров (вызывает гибель 10–30% бройлеров и 2–10% несушек). H9N2 также обладает иммунодепрессивными свойствами, подобно вирусам болезни Гамборо и инфекционной анемии цыплят, поэтому оценить смертность при низкопатогенном гриппе птиц сложнее — накладываются вторичные инфекции.
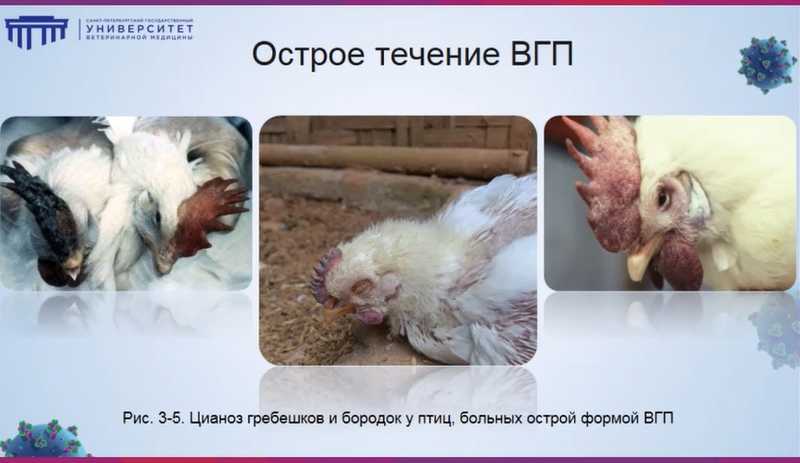
Высокопатогенный грипп протекает в четырех формах: сверхострой, острой, подострой, хронической и субклинической. Сверхострое течение характеризуется угнетенным, коматозным состоянием и быстрой смертью птиц. При остром течении наблюдаются цианоз гребешков и бородок, состояние опистотонуса, когда птицы выкручивают шею и погибают в неестественных позах. При подостром течении клинические признаки менее выражены, вероятность смертельного исхода ниже, а также добавляется диарея с включениями зеленого цвета. Субклиническое течение высокопатогенного гриппа встречается редко и проявляется отеками подчелюстных бородок и пятнами на лапах. Болезнь у индеек и кур протекает сходно. У уток больше проявляются нервные симптомы, у гусей — тяжелые поражения глаз.
Патоморфологические изменения при гриппе крайне разнообразны и очень ярки: геморрагическое поражение трахеи и легких, которые становятся черными или черно-красными. Классическим признаком является поражение желудка — «кровавый поясок» на границе мышечного и железистого отделов.

Личные подсобные хозяйства не имеют собственных лабораторий, поэтому для диагностики используются контроль падежа, клинический осмотр (характерные симптомы должен уметь распознавать любой фермер); есть возможность отправить пробы в областные ветеринарные лаборатории или референс-центр по гриппу птиц. Крупные птицефабрики обладают большими возможностями; помимо контроля падежа и состояния здоровья, проводятся убойно-вскрывочные мероприятия (диагноз по патологоанатомической картине), контроль выделения вируса методом ПЦР, контроль антител в сыворотке крови (РТГА, ИФА) и мониторинг областной эпизоотической ситуации. Ветеринарный врач должен уметь отличать высокопатогенный грипп от других заболеваний, таких как болезнь Ньюкасла, болезнь Гамборо, инфекционная анемия цыплят, инфекционный бронхит кур, респираторный микоплазмоз.
Методы профилактики на птицефабриках включают механизмы обеспечения биозащиты: дезинфекцию транспорта, обустройство санпропускников для сотрудников, формирование естественной резистентности с помощью витаминов и пробиотиков, запрет на совместное содержание разнопородной и разновозрастной птицы и разделение фабрики на чистую и грязную зоны.
А как же вакцинопрофилактика? Вакцинацию птиц против высокопатогенного гриппа проводят специалисты госветслужбы в хозяйствах, за исключением птицефабрик (Приказ Минсельхоза России от 24.03.21 № 158). Минсельхоз отмечает не только несомненные плюсы вакцины, но и такие минусы, как маскировка болезни и слабый иммунный ответ у вакцинированных особей, что влечет за собой риск скрытого распространения вируса, ускоренные мутации и запрет на экспорт за пределы региона. Поэтому вакцинация в личных хозяйствах и на птицефабриках в неблагополучных регионах проводится с разрешения ветслужбы и Россельхознадзора.
Докладчик с коллегами разработали метод DIVA-диагностики в условиях запрета на вакцинацию птицы, актуальный для текущей ситуации в России. Они использовали две вакцины: Флу Проект Н5 (цельновирионная) Ставропольской биофабрики и Volvac B.E.S.T. (субъединичная, с антигеном гемагглютинина) производства Boehringer Ingelheim. Провакцинировали две группы птиц и проверили двумя разными тестами: на обнаружение общего для гриппа NP-белка и гемагглютинина. Вакцина Флу Проект дает положительный результат на оба маркера, а Volvac B.E.S.T. вызывает образование антител только к гемагглютинину, то есть птица, получившая эту вакцину, с одной стороны, защищена от инфекции, а с другой стороны, не контактировала с вирусом или вакцинным штаммом, и тестирование позволяет это доказать.

В заключение Николай Владимирович ответил на волнующий вопрос: можно ли заразиться высокопатогенным гриппом через мясо птицы и яйца? Ответ: и да, и нет. Нет, потому что, во-первых, основной путь заражения человека высокопатогенным гриппом от птиц — аэрогенный, воздушно-капельный. Во-вторых, большинство продуктов птицеводства проходит термическую обработку, и вирус погибает. В-третьих, рецепторы, к которым способен присоединиться вирус H5, находятся преимущественно в глубоких отделах дыхательной системы, а в кишечнике человека практически отсутствуют. Именно поэтому люди редко заражаются высокопатогенным гриппом H5, чаще происходит заражение вирусами H1 и H3. Тем не менее есть вероятность заразиться вирусом при приготовлении пищи, когда мы трогаем яйца или разделываем мясо — но не когда едим приготовленное блюдо.
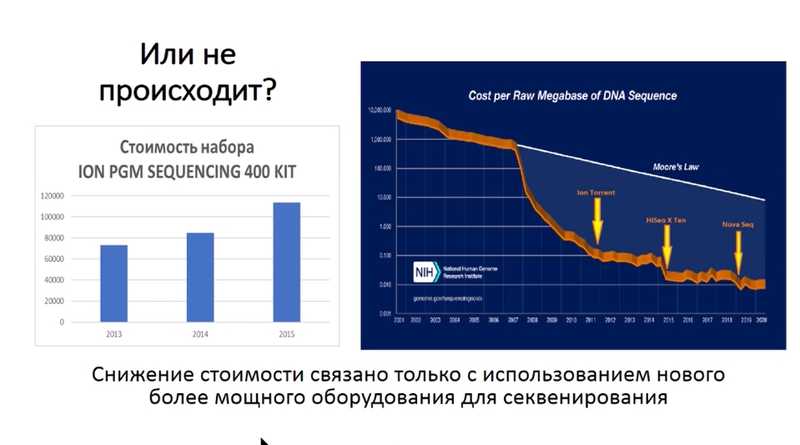
Александр Богун из лаборатории физиологии микроорганизмов ИБФМ РАН рассказал о методах анализа геномов в эпидемиологической работе. С 2021 стоимость геномного секвенирования постоянно снижается — так заявляют производители оборудования. Но когда специалисты начинают делать такой анализ на своей базе и закупают оборудование, такая закономерность, как ни странно, не видна. Снижение, которое так любят показывать на графиках, получается за счет введения более мощных систем секвенирования, имеющих более высокую стоимость запуска, требующих большего количества образцов и обеспечивающих меньшую стоимость нуклеотида. Эти системы могут быть неудобными для работы с маленькими геномами патогенов.
Действительно, при традиционном shotgun-секвенировании можно получить порядка 95-98% генома бактерий и еще больше для вирусов. Гибридное секвенирование позволяет получить полногеномные последовательности бактериальных хромосом и плазмид. Можно выявлять гены устойчивости к лекарственным препаратам, изучать факторы вирулентности и проводить филогенетический анализ. Данные, полученные с помощью геномного секвенирования, мало зависят от используемого оборудования. Большие плюсы — возможность переключаться на другие гены и проводить анализ с использованием только биоинформационных методов, избегая «мокрого» эксперимента.
А хорошо известный минус — необходимость использования реактивов, совместимых с конкретной моделью оборудования. Если модель уходит с рынка, запас реагентов может оказаться бесполезным. Дополнительные сложности с поставками реагентов создают санкции.
В последние годы наблюдается тенденция к переходу на нанопоровое секвенирование. Однако, по мнению Александра Геннадьевича, нанопоровое секвенирование пока подходит для практического применения. Ошибки при сборке данных приводят к сдвигу рамки считывания, переводят гены в псевдогены, что затрудняет понимание их функциональности. Кроме того, при большом количества ошибок клинические изоляты из одной кластерной группы, эпидемически связанные, оказываются разобщены из-за различий в последовательностях. Это мешает построению филогенетического дерева. Ситуация намного лучше, когда нанопоровое секвенирование используется для картирования на референсный геном. Например, данные о геноме коронавируса в этом случае достаточно надежны и интерпретируемы.
Массовое внедрение технологий геномного секвенирования было связано с гриппом и началось около 2009 года, когда ВОЗ рекомендовала определенный подход к секвенированию. Была создана система GISAID, позволяющая анализировать данные без предварительной модерации, которая дает надежные данные, но занимает время, так что к моменту публикации инфомрация устаревает. В то время использовались различные модели капиллярных секвенаторов — одна из технологий, которая может быть полностью сделана на российской базе, так как есть отечественный секвенатор Нанофор. Но сегодня чаще применяются системы массированного параллельного секвенирования — полупроводниковые системы от Thermo Fisher и оптические системы от Illumina.

Системы полупроводникового секвенирования имеют преимущество перед конкурентами: возможность провести анализ быстро (на следующий день). Это важно, если мы используем данные для принятия быстрого решения по эпидситуации, а не для ретроспективного анализа. Аналоги, доступные в России включают оборудование компании GeneMind, которое по иронии не представлено в США и Западной Европе, и компании MGI. Производительность приборов бывает разная, от низкой до высокой, они способны генерировать необходимые объемы данных для анализа малых геномов, включая возбудителей инфекционных заболеваний.
Если мы начинаем работу и не знаем, что нас ожидает, часто возникает необходимость провести тотальное секвенирование. В случае коронавируса, например, оно позволяет восстановить полногеномную последовательность. Однако даже при высоком уровне вирусной нагрузки образцы содержат большое количество нуклеиновых кислот организма-хозяина, что требует дополнительных усилий для анализа данных. При тотальном секвенировании, как правило, нужно нескольких миллионов прочтений для интерпретации данных, в случае таргетного обогащения — несколько сотен тысяч прочтений на образец. Зато для тотального секвенирования не нужны специфические расходные материалы под конкретного возбудителя. Таргетное обогащение, напротив, требует мультиплексных панелей на основе ПЦР и надежного протокола.
Важно получить хорошее распределение ридов по секвенированному геному. Обычно какие-то регионы оказываются гиперпредставленными, и приходится корректировать количество праймеров или олигонуклеотидов в реакционной смеси, чтобы получить равномерное покрытие. Иногда даже хорошие образцы дают недостаточное покрытие и низкую степень реконструкции генома. Для вирусных геномов может быть достаточно небольшого числа прочтений при равномерном покрытии. Интересно, что иногда удается получить более высокую степень покрытия на маленьких архивах, которые являются частью больших архивов, чем при использовании исходных больших архивов. Это происходит потому, что при анализе данных программа неправильно проводит картирование больших архивов. Некоторые регионы содержат десятки тысяч прочтений, а регионы рядом с ними не содержат прочтений совсем. С другой стороны, при работе с маленькими архивами программа работает более корректно и обеспечивает более равномерное покрытие.
Еще один важный момент — как правило, все системы для таргетной амплификации содержат праймеры, которые отжигаются на геноме и также секвенируются. Если на эти зоны не обращать внимания, то в некоторых случаях мы секвенируем последовательности, которые находятся в праймере, а в других случаях перекрывающиеся ампликоны дают последовательности, которые находятся в изучаемом геноме. Когда мы их картируем на референсный геном, если программа видит, что в 90% случаев в ридах есть мутация, она определяет наличие мутации. Но если содержание мутации ниже 90%, программа обычно ее не видит. Если мы не удалили праймеры из данных секвенирования, существует риск получения около 15% так называемых серых зон при реконструкции геномов, которые не могут быть корректно проанализированы.

При эпидемиологическом мониторинге обычно предъявляются определенные требования к оборудованию (о них докладчик недавно рассказывал на конференции по секвенированию в РНИМУ). Важны скорость, особенно когда задача срочная, и высокая точность прочтения. Для скрининга достаточна производительность на уровне 25–100 млн прочтений. Также желательны низкая стоимость запуска, так как расходы на секвенирование увеличиваются, если образцов недостаточно для полной загрузки системы. Очень важна длина прочтения не меньше 250 нуклеотидов, что позволяет использовать любые таргетные панели. Хорошее преимущество — возможность работы с двумя каналами. Можно запустить собственный эксперимент, который может быть более длительным, например, метагеномный анализ, требующий прочтения в режиме PE300, и одновременно обрабатывать срочные образцы. Нужна техническая поддержка на территории РФ, поскольку любое оборудование может сломаться.

На сегодняшний день доступно оборудование от китайских производителей, такое как GenoLab, GeneMind FASTASeq, DNBSEQ-G50, DNBSEQ-G99, среди которых последняя система считается самой быстрой. Время анализа — около 12 часов в режиме прочтения PE150 — сопоставимо с системой Genexus от Ion Torrent. Можно поставить анализ на ночь и утром получить данные, тогда как если анализ занимает 20 часов, данные будут только через день.
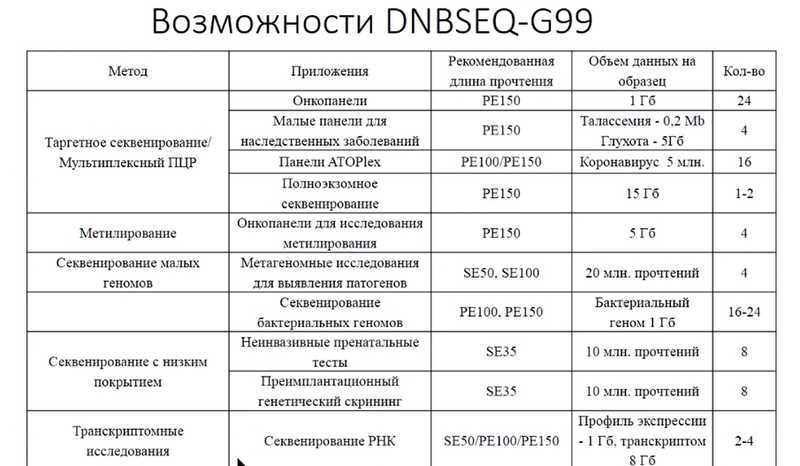
Таким образом, для тех случаев, где важна скорость принятия решений, этот прибор является хорошей альтернативой. Для приложений, где скорость анализа не так критична, можно использовать большинство представленных на рынке секвенаторов. Главное — правильно подойти к процессу подготовки к секвенированию и удалению адаптеров. Согласно заявлениям производителя DNBSEQ-G99, прибор подходит не только для анализа небольших геномов, но и для других исследований, включая транскриптомные.
Владислав Иванов завершил вебинар докладом «Эффективные подходы к быстрой диагностике гриппа у людей и животных». Он рассмотрел методы диагностики и новейшие экспресс-тесты, разработанные компанией «Рапид Био». Докладчик отметил, что в 2022 году было зарегистрировано более 88 000 случаев гриппа и более 42 миллионов случаев острых респираторных инфекций в России. По оценкам ВОЗ, ежегодно гриппом заболевает около миллиарда человек в мире. Кроме того, в мире зафиксировано более 8,6 миллиона случаев заболевания высокопатогенным гриппом птиц. Поэтому необходимы эффективные методы диагностики.
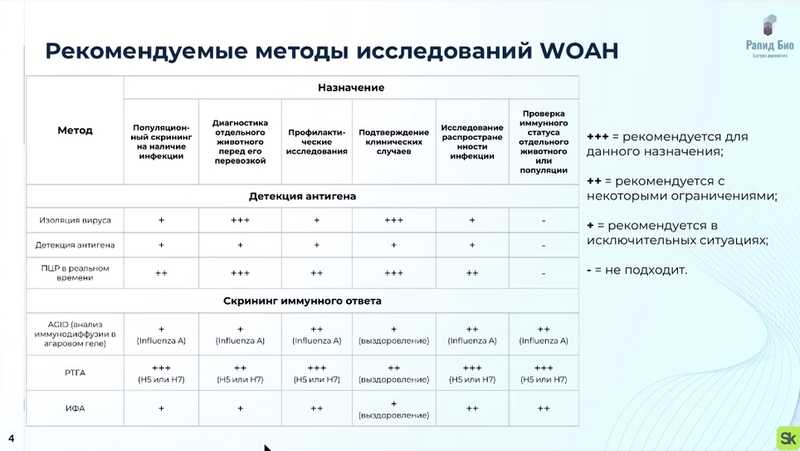
ВОЗ рекомендует следующие методы для диагностики гриппа птиц: для детекции — изоляция вируса, детекция антигена и ПЦР в реальном времени; для скрининга иммунного ответа — анализ иммунодиффузии в агарозном геле, РТГА и ИФА. Однако данные методы (особенно это касается скрининга иммунного ответа) не могут помочь вовремя убрать зараженную птицу из поголовья.
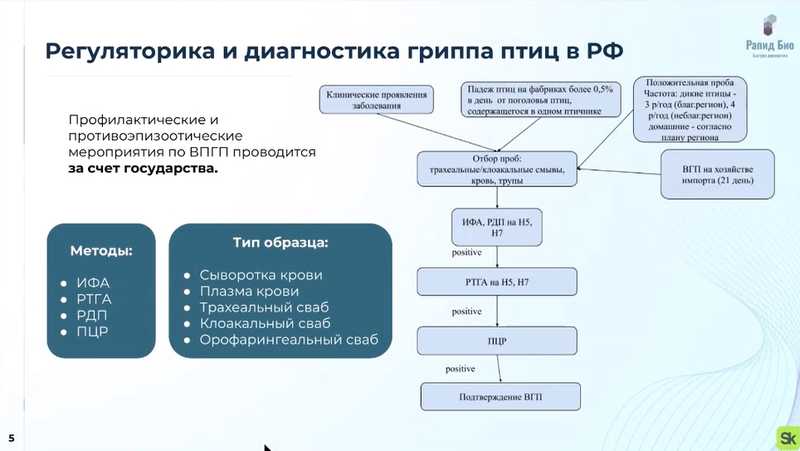
Докладчик остановился на вопросах регуляторики и диагностики гриппа птиц в России. Для контроля и предотвращения распространение вируса применяют такие методы, как ИФА, ПЦР, РТГА и РДП. Анализируют сыворотку и плазму крови животных, трахеальный, клоакальный и орофорингеальный свабы (мазки).
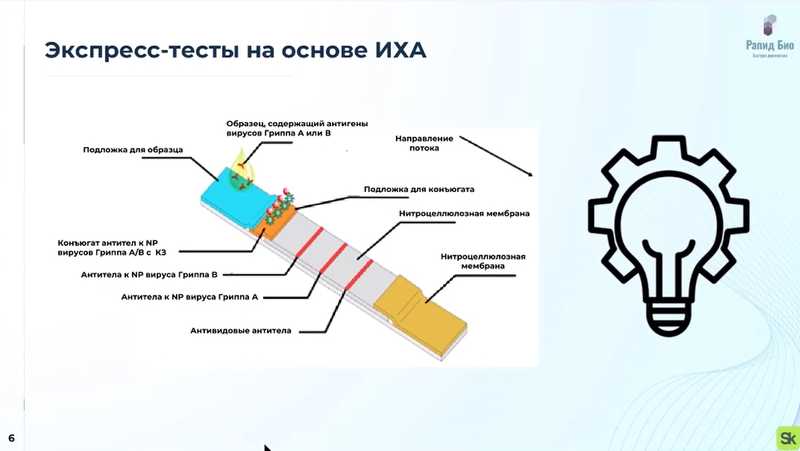
Владислав представил экспресс-тест, разработанный компанией «Рапид Био». В общем случае экспресс-тест на основе иммунохроматографии представляет собой мультимембранную композицию, состоящую из нескольких слоев мембран, каждая из которых выполняет свою функцию. У теста есть подложка, на которую наносится образец, в данном случае содержащий антигены вирусов гриппа А и В. Затем образец взаимодействует с конъюгатом — коллоидным золотом, на котором иммобилизованы антитела к NP вирусов гриппа А и В. Если в образце есть антигены, они взаимодействуют по принципу «ключ-замок» — происходит высокоспецифичное взаимодействие антигена с антителом. Далее этот комплекс перемещается по поверхности мембраны, достигает первой тестовой зоны, где определяется грипп В, и если в образце он есть, то мы видим красное окрашивание. Аналогично детектируется грипп А в соответствующей зоне. Остатки образца далее диффундируют по поверхности мембраны до контрольной линии, которая окрашивается всегда и служит контролем качества теста. Излишки образца впитываются в нитроцеллюлозную мембрану.
Докладчик поделился результатами апробации экспресс-тестов на штамме вируса гриппа H1, проведенной совместно с НИИ гриппа имени А.А. Смородинцева. В результате применения монотеста проявлялось четкое окрашивание в зоне тестирования гриппа А. Также специалисты провели определение штамма H9 с помощью комбо-теста, который одновременно определяет вирусы гриппа A и B, а также COVID, и наблюдали окрашивание в зоне тестирования гриппа. Помимо этого, апробацию тестов проводили на штаммах гриппа А H1N1pdm09 и H3N2, гриппа В Victoria и Yamagata. Тест может определять антиген гриппа A в концентрации 103 и гриппа В – 104.

Кроме экспресс-тестов на возбудителей респираторных инфекций (респираторно-синцитиальный вирус, стрептококк, вирусы гриппа, коронавирусы), компания «Рапид Био» предлагает ряд других тестов для выявления инфекций, передаваемых половым путем, и вирусных гепатитов. Компания продолжает развивать ветеринарную диагностику, например, создан тест для определения остаточного количества антибиотиков в молоке.
Один из слушателей задал вопрос, могут ли экспресс-тесты использоваться для сложных образцов от животных, например, мазков или молока. Владислав ответил, что это возможно, но зависит от вирусной нагрузки в молоке; нужно провести дополнительные исследования и проверить применимость тестов на практике. Дарья Михайловна отметила, что это помогло бы расширить возможности диагностики на местах и упростить работу ветеринарным специалистам. В завершение она поблагодарила выступающих за интересные и разноплановые доклады, слушателей за активность и организаторов — за возможность комфортно проводить вебинары.
Информация о докладчиках
Дарья Михайловна Даниленко, к.б.н., заместитель директора по научной работе НИИ гриппа имени А.А. Смородинцева
Василий Юрьевич Марченко, д.б.н., руководитель сотрудничающего Центра ВОЗ по изучению вирусов гриппа в точках пересечения экосистем людей и животных
Кирилл Александрович Шаршов, к.б.н, заведующий лабораторией молекулярной эпидемиологии и биоразнообразия вирусов Института вирусологии ФИЦ ФТМ.
Николай Владимирович Тарлавин, к.в.н., ассистент кафедры зоологии Санкт-Петербургского государственного университета ветеринарной медицины.
Александр Геннадьевич Богун, к.б.н., лаборатория физиологии микроорганизмов ИБФМ РАН
Владислав Иванов, ведущий ученый ООО «Рапид Био».


 Меню
Меню





 Все темы
Все темы




 0
0






