Как сделать CAR. Эксперты обсуждают инновационную терапию онкозаболеваний
Шестнадцатого мая 2023 прошел вебинар «Лимфоциты с химерными антигенным рецептором (CAR-Т и NK-CAR): текущее состояние исследований и перспективы клинического применения»; организаторы — ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России и портал PCR.NEWS. Ведущие специалисты в области иммунотерапии рассказали о тонкостях инновационного метода и поделились результатами своих исследований.
Credit:
Pharmaceutics 2020. DOI: 10.3390/pharmaceutics12020194 | CC BY 4.0
Иммуногенетическая терапия злокачественных опухолей становится все актуальнее, подчеркнул модератор вебинара Сергей Ларин. В ситуациях, когда «отрезать» уже нечего или у пациента наблюдаются тяжелые побочные явления от химио- и радиотерапии, эффективным может быть обращение к ресурсам самого организма.
Что представляют собой клетки с химерным антигенным рецептором (CAR)? CAR — это рецепторы, полученные в результате генно-инженерных манипуляций и состоящие из нескольких модулей. Генетическую последовательность рецептора с помощью вирусной трансдукции, электропорации или мРНК-трансфекции вводят в заранее полученные иммунные клетки пациента. Это могут быть Т-лимфоциты, NK-клетки или макрофаги. Затем клетки культивируют до необходимого количества и вводят пациенту. Главное преимущество химерных антигенных рецепторов — их самодостаточность и независимость от главного комплекса гистосовместимости (ГКГ, MHC-I), что упрощает процесс распознавания опухолевых клеток. CAR выполняет две основные функции: распознает антиген-мишень опухоли и активирует иммунные реакции несущей его клетки (Т-лимфоцита, NK-клетки, макрофага).
На сегодня существует четыре поколения CAR, которые отличаются друг от друга составными частями. У первого поколения внутриклеточный модуль состоит только из сигнального домена. Во втором уже есть и сигнальный, и костимулирующий домены. У третьего поколения была добавлена дополнительная последовательность костимулирующего домена. При разработке четвертого поколения во внутриклеточный модуль ученые добавили последовательность индуктора цитокинов.
В теории создать CAR-Т несложно. Достаточно выбрать опухоль-мишень и определить ее антиген, подумать над способом доставки гена, его детекции после успешного внесения, выбрать метод определения специфичности полученных CAR-Т лимфоцитов, показать результаты на животной модели и попробовать разработку на пациентах. На практике, конечно же, ученые сталкиваются с множеством проблем.
Старший научный сотрудник лаборатории иммуногенетики ИМКБ СО РАН (Новосибирск) Андрей Горчаков выступил с докладом «CD19-специфические химерные антигенные рецепторы: основы дизайна для обеспечения оптимального соотношения токсичности и эффективности».
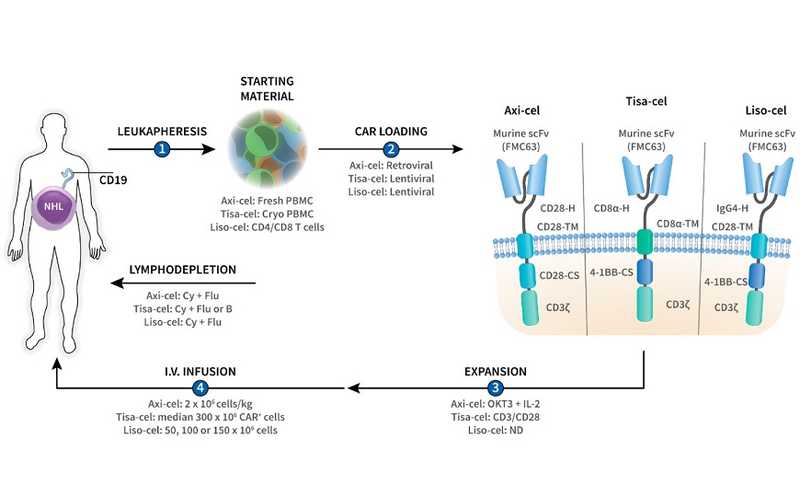
Сейчас существует четыре препарата на основе CAR-Т, специфичных к CD19. Клинические испытания проводятся для трех из них: Axi-cel, Tisa-cel, Liso-cel. Отличия между ними заключаются в разных модульных частях, типе первичного материала, способах доставки генов в лимфоциты, экспансии лимфоцитов и обратной инфузии. С определенными оговорками самым эффективным считается продукт Axi-cel (Axicabtagene ciloleucel, коммерческое наименование продукта Yescarta), самым безопасным — Liso-cel (Lisocabtagene maraleucel, Breyanzi).
Андрей Горчаков подробнее рассказал о структуре химерных антигенных лимфоцитов. CAR-Т-рецепторы состоят из антигенраспознающего, шарнирного, трансмембранного модулей и внутриклеточных последовательностей, выполняющих костимулирующую и сигнальную функцию. В основе большинства антигенраспознающих модулей CD19-CAR-Т лежит последовательность мышиного моноклонального антитела FMC63. CAR-последовательность обязательно должна находиться под контролем промотора, иначе не будет экспрессии.
В силах ученых модифицировать каждый из модулей. Так, возможно изменить силу промотора. Кажется, если взять сильный промотор, то мы получим много CAR-рецепторов на поверхности и «злую» Т-клетку. Однако на практике это не работает, подчеркнул докладчик; важно придерживаться золотой середины. Можно увеличивать специфичность промоторов, чтобы доставляемая последовательность экспрессировалась строго в Т-клетка, или изменять индуцибельность. Под индуцибельностью понимают способность промотора менять свою активность в зависимости от состояния клетки. Это позволит определить момент, когда CAR-Т лимфоциты начинают работу, — в организме пациента или еще во время экспансии. У антигенраспознающего модуля можно изменить аффинность, иммуногенность, стабильность и сам эпитоп, который будет распознаваться рецептором. У шарнирной последовательности поменять его длину, гибкость, способность к димеризации и регуляторные качества. В трансмембранной последовательности можно изменить уровень экспрессии CAR и способность к димеризации. У внутриклеточного модуля — поменять силу проводимого сигнала и тип клеток, на поверхности которых будет располагаться CAR. В общей структуре рецептора имеет смысл проводить деиммунизацию мест стыковки модулей между собой.
Андрей Горчаков показал типичный CAR-T-клеточный рецептор Axi-cel. Для клеточного продукта с таким рецептором характерны высокая токсичность, включающая цитокиновый шторм и нейротоксичность, и непродолжительная персистенция в организме. Как можно улучшить Axi-cel? Во-первых, сменить антигенраспознающую часть: мышиное моноклональное антитело заменить на человеческое. Во-вторых, изменить последовательности шарнирного и трансмембранного модуля от CD28 на CD8a. В итоге мы получим CAR-рецептор с низкой токсичностью и долгой персистенцией. Также можно вставить во внутриклеточный модуль последовательность CD3e, который может связываться с негативными регуляторами активности TCR, что приближает химерный рецептор к физиологичной норме. На животных моделях такой дизайн снижает токсичность и увеличивает персистенцию. Ожидаются результаты исследования подобной конструкции на пациентах.
Китайские ученые модифицировали продукт Tisa-cel (tisagenlecleucel, Kymriah). Они добавили аминокислотную последовательность к шарнирному и трансмембранному модулям, что также снизило токсичность и продлило персистенцию. Кроме того, сейчас проходят исследования рецепторов с замененными внутриклеточными модулями и измененными промоторами.
Андрей Горчаков упомянул про важную роль гликозилирования в распознавании CD19. Если опухолевая клетка слишком слабо или сильно гликозилирует CD19, то узнавания не происходит. Логичным выходом кажется создание CAR, которые не зависят от степени гликозилирования CD19. В заключение докладчик представил общий список проблем в области создания CD19-CAR-Т-клеток и их возможных решений.
Доклад Гаухар Юсубалиевой назывался «Подходы NK-CAR в терапии солидных опухолей». В своей работе она сосредоточилась на глиобластоме: на опухоли этого типа приходится 60–70% от всех диагностированных злокачественных новообразований головного мозга. В борьбе с глиобластомой могут помочь ранняя диагностика, усовершенствование способов резекции, повышение точности доставки терапевтических агентов, использование прогностических биомаркеров и выявление мутаций, определяющих подтип ГБМ. Альтернативные решения — иммунотерапия солидных опухолей, а также ее комбинация с химио- и радиотерапией. Лечение собственными или донорскими NK-клетками уже сейчас применяется в клинике, однако NK-клетки не отличаются долгим сроком жизни, а у некоторых пациентов отбор клеток может быть затруднен. Поэтому перспективной представляется разработка NK-CAR-клеток. Как активировать полученные NK-клетки и заставить их дольше персистировать в организме? Можно повысить экспрессию белков — позитивных регуляторов, понизить экспрессию белков — негативных регуляторов, а также получить универсальные клетки-киллеры. Все это успешно выполнено докладчицей с коллегами. Гаухар Юсубалиева обращает внимание на то, что культуры клеток из опухолей головного мозга требуют особых условий. Необходимо разработать новые среды, чтобы максимально сохранить гетерогенность и функции клеток.
Затем Гаухар Маратовна рассказала о результатах экспериментов с NK-CAR-клетками. В качестве мишени был выбран EGFRvIII, который активно экспрессируется на поверхности клеток глиобластом. Последовательность NK-CAR-EGFRvIII с помощью лентивирусной трансдукции вводили в NK-клетки. Полученные NK-CAR-EGFRvIII-клетки помещали в культуры клеток, полученных из глиобластомы человека. Ученые увидели, что они активно подавляют и адгезию, и пролиферацию опухолевых клеток. Чтобы максимально приблизить условия эксперимента к реальности, исследователи оценили действие NK-CAR-EGFRvIII на опухолевые сфероиды. С помощью флуоресцентных меток они наблюдали, как всего через пять часов после внесения NK-CAR-клеток в лунки со сфероидами они начинают проходить внутрь сфероида и разрушать его центральную часть. Также Гаухар Юсубалиева проводит исследования онколитических вирусов, которые способны поддерживать CAR-терапию. В этом направлении ожидаются новые интересные результаты, отметила она.
Затем выступила Мария Лукашина с докладом «Успехи экспансии NK-клеток в условиях внутрибольничного (point-of-care) производства». На данный момент в России понятие «внутрибольничное производство» отсутствует, а если оно где-то и существует, то на нелегальном положении. Такая ситуация сложилась из-за особенностей законодательства РФ. Исследователи надеются на его пересмотр и внесение правок.
Мария Лукашина перечислила преимущества использования NK-клеток: не нужна презентация антигена, нет реакции «трансплантат против хозяина» и цитокинового шторма, множественные механизмы цитотоксичности. Получить NK-клетки можно из пуповинной и периферической крови, клеточных линий и стволовых клеток. Технология создания NK-клеток состоит из стандартных этапов — выбора источника, самого производства (культивирования), обязательного контроля качества и хранения.
Докладчица с коллегами в качестве источника выбрали периферическую кровь. Полученные клетки культивировали в системе с фидерными клетками. Из мононуклеарной фракции выделили NK-клетки. На третьей неделе культивирования среднее увеличение от посадочной плотности было в 150 тысяч раз. В конечной популяции содержание NK-клеток превысило 90%. Контроль качества включал проверку остаточных фидерных клеток и измерение содержания целевых клеток в популяции. Оно достигло 97,04% — увеличение от стартовой популяции в 52 раза. Также была измерена функциональная активность NK-клеток по их способности к дегрануляции и в прямом цитотоксическом тесте. Криоконсервирование NK-клеток возможно на средах с человеческой сывороткой, однако при разморозке выживаемость клеток снижается до 1%. Поэтому исследователи создали свою среду, в которой выживаемость при разморозке и последующем 24-часовом культивировании достигает 61,7%. После разморозки фенотип клеток сохраняется, но цитотоксичность немного уменьшается.
В качестве мишени ученые выбрали CD19. С помощью ретровирусной трансдукции успешно были созданы CD19-NK-CAR-клетки. В прямом цитотоксическом тесте они прекрасно показали себя, задержав рост опухолевых клеток.
Доклад «ScFv-less CAR-T: теоретические предпосылки и экспериментальные исследования» представила Варвара Майорова. ScFv-less CAR-T — это те же CAR-T, но в антигенраспознающем модуле вместо последовательности антитела ставят последовательность лиганда рецептора и получают безантительный химерный рецептор.
Химиотерапия для острого миелоидного лейкоза (ОМЛ) действует неспецифично и сопровождается системной токсичностью. У детей выживаемость составляет 60%, у взрослых — 20%. ОМЛ развивается гетерогенно, бластные клетки растут клонально и могут адаптироваться к терапии; в таких условиях сложно выбрать только одну мишень для лечения. Сейчас более десятка ОМЛ-ассоциированных антигенов тестируется в качестве возможных молекулярных мишеней для CAR-T-терапии. Как известно, при дизайне CAR необходимо выбрать последовательность моноклонального антитела, который будет специфичен к опухолевому антигену. На практике может возникнуть такая ситуация, когда выбор антигенраспознающей последовательности невозможен или за ним следует трудоемкий процесс подтверждения безопасности и эффективности. Вот почему возникла идея вместо последовательности антител использовать последовательность рецепторных натуральных лигандов. Это обеспечивает высокоспецифическое узнавание и позволяет пропустить фазу предварительных исследований.
Варвара Евгеньевна и ее коллеги выбрали тирозинкиназный рецептор (Flt3), так как он в большом количестве представлен на поверхности бластных клеток при ОМЛ. В норме Flt3-лиганд стимулирует активацию внутриклеточных пролиферативных путей, а также уход Flt3-рецепторов с поверхности клеток-мишеней. Мембраносвязанная форма Flt3-лиганда может отщепляться с поверхности клетки и попадать в системный кровоток. Чтобы обойти возможные побочные эффекты, ученые использовали измененный вариант Flt3-лиганда с точечной заменой в последовательности — Flt3-L27P-лиганд. Они простимулировали Flt3-позитивные клетки THP-1 лигандами дикого типа и измененными. При концентрации 2 нг/мл Flt3-лиганд дикого типа стимулировал уход рецепторов с поверхности клеток, а измененный Flt3-L27P-лиганд — нет. Ученые пришли к выводу, что Flt3-L27P-лиганд с меньшей вероятностью может вызвать антигеннегативный рецидив при лечении ОМЛ. Активность Flt3-L27P-лиганда получилась меньше, чем у дикого типа, поэтому можно предположить, что пролиферация бластных клеток будет стимулироваться с меньшей вероятностью, а попадание измененного лиганда в кровоток не будет оказывать влияние на функции остальных Flt3-лигандов.
Генетические конструкции, кодирующие безантительный Flt3m-CAR рецептор, доставляли в клетки с помощью лентивирусных векторов. Чтобы подвердить, что Flt3m-CAR проявляет токсичность только за счет Т-клеточных механизмов киллинга, получили неактивные Flt3m-CAR-Т-клетки на основе Jurkat-клеток, не обладающих цитотоксичностью. Действительно, безантительные Flt3m-CAR Jurkat-клетки не разрушали Flt3-позитивные клетки. Избыток Flt3-лиганда дикого типа приводит к снижению процента киллинга Flt3-CAR-T, в то время как Flt3m-CAR-Т-опосредованная цитотоксичность не зависела от концентрации рекомбинантного Flt3-L27P-лиганда.
В случае попадания Flt3-L27P-лиганда в системный кровоток Flt3m-CAR-Т-клетки продолжают быть цитотоксичными в отношении Flt3-позитивных клеток-мишеней. Таким образом, ученые получили эффективные безантительные CAR-Т-клетки. В дальнейшем планируется расширение на другие рецепторы опухолей-мишеней.
Доклад Сергея Ларина назывался «Возможности CAR-T и CAR-NK: теория, практика, ожидания». В своем докладе он подробнее рассказал о том, почему этим методом сложно лечить солидные опухоли. В частности, сложно выбрать антиген, чтобы он одновременно и был уникальным, и таргетировался известными терапевтическими антителами. В своей работе Сергей Ларин и коллеги выбрали антиген GD2 и нейробластому. Известно, что GD2-позитивные опухоли составляют порядка 10% от всех онкозаболеваний. Преимущество антигена GD2 в том, что он не презентируется в комплексе с MHC, но это же является его недостатком из-за сложностей детекции. В лаборатории были созданы анти-GD2 CAR-Т второго и третьего поколения (химерные рецепторы третьего поколения, в отличие от второго, имеют дополнительную последовательность костимулирующего домена). Из-за проблем с детекцией полученных продуктов ученые были вынуждены самостоятельно выделить и очистить необходимые им антитела. На культуре клеток нейробластомы анти-GD2 CAR-Т-лимфоциты эффективно убили опухолевые клетки. Сергей Ларин с коллегами также поставили на поток определение растворимого GD2 в плазме крови, что позволяет лучше прогнозировать ответ на иммунотерапию.
Вебинар завершился докладом Владимира Боженко из Российского научного центра рентгенорадиологии о CAR-T терапии солидных опухолей. Несмотря на то, что CAR-T терапия солидных опухолей уступает по распространенности CAR-T терапии гематологических опухолей, по количеству клинических испытаний отставание не такое значительное. Основной мишенью терапии солидных опухолей является опухоль-ассоциированный антиген (ОАА, или TAA). На первом месте в мире по количеству клинических протоколов по видам терапии солидных опухолей стоит Китай, за ним следуют США.
В работе Владимира Боженко с коллегами мишенью терапии был раково-эмбриональный антиген (РЭА). После успешной проверки функционирования полученных CAR-T-лимфоцитов ученые перешли к экспериментам на мышах. У мышей с колоректальным раком, которых лечили CAR-T-лимфоцитами, опухоль не развивалась, при этом побочные явления полностью отсутствовали. В 60% случаев удалось добиться полного излечения. При фармакокинетическом анализе обнаружилось, что даже через три недели CAR-T-клетки все еще присутствуют в периферической крови.
Авторы работы использовали в качестве носителя гена CAR не лентивирусы, а плазмиды, которые вводятся в клетки методом электропорации. Как считает Боженко, такой подход имеет ряд преимуществ: процесс производства сокращается с 20–30 дней до 48–72 часов, нет необходимости в наращивании биомассы клеток.
Докладчик также напомнил слушателям о проблемах законодательства. С 2025 года продукты CAR будут относиться не к биомедицинским клеточным продуктам (БМКП), а к высокотехнологическим лекарственным препаратам (ВТЛП). Это повлечет за собой значительное увеличение стоимости всего процесса за счет расходов на расширение производственных площадей, создание и обслуживание «чистой» и «грязной» зон, контроль и хранение образов всех входных материалов для каждой серии, а при CAR-T-терапии один пациент — одна серия.
В заключение Владимир Боженко перечислил возможные варианты усиления действия CAR-Т терапии солидных опухолей: усиление миграции за счет коэкспрессии специфических рецепторов; подавление экспрессии PD-L1, CTLA-4; коэкспрессия активирующих цитокинов; лимфодеплеция для снижения количества супрессорных клеток; создание «активируемых» конструкций CAR.
CAR-клеточная терапия — перспективное и быстро развивающееся направление иммунотерапии. Ученые надеются, что соответствующие положения в законодательстве РФ, которые Андрей Горчаков назвал «ингибирующими», смягчатся, и станут возможными массовые клинические испытания.
Информация о докладчиках
МОДЕРАТОР: Ларин Сергей Сергеевич, к.м.н., заместитель директора Высшей школы молекулярной и экспериментальной медицины ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России (Москва)
Горчаков Андрей Александрович, к.б.н., старший научный сотрудник лаборатории иммуногенетики Института молекулярной и клеточной биологии СО РАН (Новосибирск)
Юсубалиева Гаухар Маратовна, к.м.н., ст. научный сотрудник лаборатории клеточных технологий Федерального научно-клинического центра ФМБА России (Москва)
Лукашина Марина Игоревна, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
Майорова Варвара Евгеньевна, ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
Боженко Владимир Константинович, д.м.н., профессор, зав. отделом молекулярной биологии и экспериментальной терапии опухолей «ФГБУ Российский научный центр рентгенорадиологии» Минздрава России (Москва)


 Меню
Меню





 Все темы
Все темы




 0
0








