Молекулярная диагностика ВПЧ-инфекции для профилактики рака шейки матки
Инфекция онкогенными подтипами вируса папилломы человека (ВПЧ) приводит к развитию рака шейки матки и некоторых других онкозаболеваний. Участники научно-практического вебинара PCR.NEWS обсудили организацию скрининга на ВПЧ и выбор тест-систем, эпидемиологию и перспективы профилактической вакцинации в нашей стране, а также роль ВПЧ-инфекции в прогрессии патологических изменений шейки матки и в их прогнозе.
Ежегодно 28 мая проводится Международный день защиты женского здоровья. К нему был приурочен вебинар на платформе PCR.NEWS «Вирус папилломы человека (ВПЧ): фундаментальные исследования и молекулярная диагностика». Специалисты обсудили роль ВПЧ в развитии рака шейки матки, важность своевременной диагностики и профилактики ВПЧ-инфекции.
Вступительное слово произнесла Ольга Шипулина (АО «ЛабКвест»). Она рассказала о текущем состоянии молекулярной диагностики ВПЧ-инфекции в России и о перспективах ее развития.
Первичный ВПЧ-скрининг, в отличие от цитологического анализа, отличается более высокой чувствительностью и точностью, при этом он менее вариабелен. Кроме того, такой скрининг женщины могут проводить самостоятельно с помощью специальных наборов. У первичного ВПЧ-скрининга, однако, есть и недостаток — сниженная специфичность из-за того, что инфекция может быть транзиторной (преходящей). Из-за этого после получения положительного результата на ВПЧ нужно получать дополнительное подтверждение с помощью других методов.
В 2020 году ВОЗ приняла глобальную стратегию по ускорению элиминации рака шейки матки к 2030 году, поставив цель — снизить заболеваемость до 4 случаев на 100 000 женщин в год. Для этого ВОЗ разработала программу «90–70–90», которая описывает критерии выполнения цели: 90% девочек к 15 годам должны быть вакцинированы от ВПЧ, 70% женщин должны пройти скрининг на основе высокоэффективного теста хотя бы в 35 и 45 лет, а 90% женщин с предраком и инвазивным раком шейки матки должны пройти лечение. Согласно рекомендациям ВОЗ, женщины должны регулярно проходить скрининг — каждые 5-10 лет начиная с 30 лет. Если женщина ВИЧ-инфицирована, необходим более частый скрининг: каждые 3-5 лет начиная с 25 лет.
Схожие рекомендации — скрининг с 25 лет с частотой 5 лет — выпустило Американское онкологическое общество (ACS) в 2012 году. В 2020 году ACS внесло изменения в рекомендации, теперь начинать скрининг предполагается с 21 года. В 2020 году также были опубликованы рекомендации Минздрава РФ, согласно которым профилактический скрининг считается успешно выполненным при охвате более 80% женского населения. В реальности такие показатели остаются недостижимыми. И в американских, и в российских документах рекомендуется проводить котестирование с применением цитологического анализа (ПАП-тест) и ВПЧ-типирования.
Далее Ольга Юрьевна рассказала о доступных коммерческих тест-системах для выявления ВПЧ. Такие тесты должны выявлять только типы высокого онкогенного риска, при этом их спектр должен быть достаточно широким — 12-13 типов. Наибольшее внимание отводится типам 16, 18 и 45, как наиболее онкогенным: они ответственны за 75–83% случаев плоскоклеточной карциномы и за 94% случаев аденокарциномы шейки матки. Вместе с этим тест-система должна «уметь» оценивать качество взятия клинического образца по числу клеточных геномов, а также определять порог клинически значимого количества вируса. Например, в Digene-тесте установлен порог в 1 пкг, т. е. 105 копий ДНК ВПЧ в 1 мл биоматериала. В тест-системах российского производства чаще всего используется порог в 3,0 lg на 105 клеток.
Для разработки тест-систем на ВПЧ также следует правильно подбирать мишень, поскольку от этого напрямую зависит чувствительность теста. Так, известно, что экспрессия белка капсида ВПЧ L1 со временем теряется, но именно этот белок является мишенью теста Cobas HPV Test от компании Roche. Зато экспрессия белков E6 и E7 постоянна. На их детекцию направлены российские тест-системы АмплиСенс® ВПЧ ВКР скрин-титр-FL, АмплиПрайм® ВПЧ ВКР 14 и РеалБест ВПЧ ОнкоСкрин. Те же производители выпускают тест-системы для генотипирования ВПЧ.
Важная проблема скрининга ВПЧ заключается в его организации. Многие женщины не проходит тестирование и отказывается от взятия цервикального мазка. Соответственно, они входят в группу повышенного риска развития рака шейки матки. Для решения этой проблемы стали появляться тест-системы, позволяющие взять мазок самостоятельно. Этот метод одобрен ВОЗ как способ, который поможет в достижении рекомендованных охватов ВПЧ-скрининга. При самостоятельном взятии образца качество биоматериала не уступает качеству той же процедуры, проведенной специалистом.
В России пока что нет организованного ВПЧ-скрининга, в том числе с самостоятельным сбором мазка. По данным 2017 года, 75% жительниц России репродуктивного возраста не проходит тестирование, даже при наличии тревожной симптоматики, из-за нехватки времени и средств, боязни боли, стыда и т. д. Поэтому техника самостоятельного взятия мазка может быть особенно актуальна, и она была одобрена для этих целей Минздравом РФ в 2017 году.
В России для самостоятельного взятия мазка зарегистрировано шведское устройство Qvintip, доступное в некоторых частных лабораториях. В «ЛабКвест» это устройство используется в линейке тестов Q test, которые позволяют диагностировать ИППП, в том числе ВПЧ, и исследовать бактериальную микрофлору влагалища (с использованием тестов NCMT и ФЛОРОСКРИН). Тем не менее государственных программ, которые бы были нацелены на распространение подобных тест-систем и организацию ВПЧ-скрининга, пока нет. Также еще предстоит разработать устройство для самостоятельного взятия мазка российского производства и валидировать имеющиеся ВПЧ-тесты, использующие эту технологию.
С докладом «Заболевания, ассоциированные с папилломавирусной инфекцией, в России: эпидемиологические аспекты» выступил Платон Лопухов (Институт общественного здоровья им. Ф.Ф. Эрисмана Сеченовского университета).
Ежегодно в мире регистрируется больше 700 тыс. ВПЧ-ассоциированных случаев рака, прежде всего рака шейки матки (РШМ). Снижается охват вакцинации против ВПЧ: в период с 2019 по 2021 гг. он составил всего 15%, снизившись на 25%. Ежегодно в мире ВПЧ заражается около 6 млн человек в мире, а в течение жизни до 80% сексуально активного населения сталкивается с этой инфекцией. В большинстве случаев она носит транзиторный характер, однако в некоторых случаях приводит к развитию рака. Так, в РФ частота заражения онкогенными штаммами ВПЧ среди женского населения может достигать 40%.
Среди всех типов ВПЧ в России наиболее распространен высокоонкогенный тип 16 тип: он вызывает почти 65% случаев РШМ, а вместе с типом 18 — примерно 80% ВПЧ-ассоциированных случаев рака. ВПЧ может вызывать не только онкозаболевания, характерные для женщин. Эта инфекция также является причиной развития рака полового члена, ротоглотки, анального канала и других болезней.
РШМ занимает четвертое место по распространенности среди всех видов рака у женщин и второе — у женщин в возрасте 15-44 лет. В среднем заболеваемость РШМ в мире составляет 13,3 на 100 000 женщин в год (данные стандартизованы по возрасту). Наибольшее бремя РШМ характерно для стран с низким и средним уровнем дохода, что связано с распространенностью ВПЧ-инфекции и недостаточностью мер по ее профилактике и лечению. Ожидается, что к 2030 году, если не будет принято никаких мер, ежегодно будет диагностироваться 700 000 новых случаев РШМ и регистрироваться 400 000 смертельных исходов.
В России в доковидный период регистрировалось стабильное повышение заболеваемости РШМ, однако в последние годы она начала снижаться. На 2022 год стандартизированная по возрасту заболеваемость в РФ составляет 13,8 на 100 000 женщин в год. В последние годы повышается заболеваемость среди молодых женщин (до 40 лет). Это может оказать влияние в том числе на демографию: численность женщин в возрасте 30-40 лет падает в России по естественным причинам, но ее также снижают заболевания. В связи с этим нужно разрабатывать мероприятия профилактики ВПЧ-инфекции, которые сократят ее бремя, особенно в этой возрастной группе.
Смертность от РШМ в РФ остается на стабильном уровне. На 2022 год стандартизированный по возрасту показатель составлял 4,7 на 100 000 женщин. При этом смертность также повышена в молодом возрасте.
Для всех других ВПЧ-ассоциированных злокачественных заболеваний в 2019 году отмечался рост показателей заболеваемости по сравнению со среднемноголетними данными за 2007-2018 гг. Также, согласно официальным данным, после пандемии наблюдается рост распространенности ИППП, хотя до этого заболеваемость ими стабильно снижалась. В частности, растет заболеваемость аногенитальными бородавками, которые появляются при заражении ВПЧ: в РФ они занимают 4-е место среди других ИППП, а в Москве — 2-е. Особо высокие показатели заболеваемости аногенитальными бородавками характерны для женщин и мужчин в возрасте 15-30 лет. У пациентов с этой инфекцией выявляются не только низкоонкогенные типы ВПЧ 6 и 11, но и высокоонкогенные — 16, 18, 52.
Платон Дмитриевич анонсировал выход исследования, посвященное определению доли ВПЧ-ассоциированных предраковых состояний и аногенитальных бородавок среди всех пациентов, которые обращаются в специализированные клиники в РФ. Публикация выйдет в журнале «Вестник Российской академии медицинских наук». В исследовании участвовало более 11,5 тысяч пациентов 28 медицинских центров в 21 субъекте РФ. Среди них более 10% обращались с жалобами на ВПЧ-ассоциированные предраковые состояния в гинекологические и дерматологические отделения клиник. В последние годы растет доля пациенток с цервикальной интраэпителиальной неоплазией (CIN): если в 2000 году она составляла около 3%, то в 2019 году выросла до 11%.
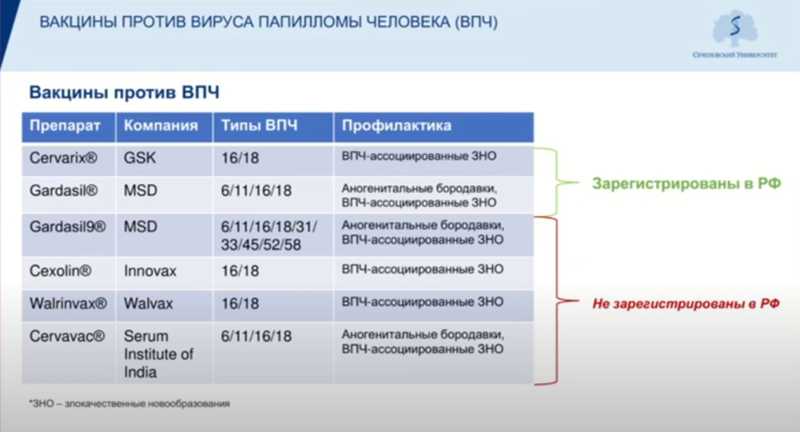
Отсутствие прогресса в сдерживании распространения ИППП связывают с недостаточным внедрением доступных и эффективных методов диагностики, а также с отсутствием или ограниченным применением средств для специфической профилактики. Так, вакцинация против ВПЧ сейчас не входит в национальный календарь прививок, однако может проводиться в ходе дополнительных программ или входить в региональные календари прививок. На 2022 год профилактическая вакцинация подростков против ВПЧ-инфекции включена в календари прививок 16 регионов РФ.
Особенно важно разработать отечественную вакцину против ВПЧ. В мире используется шесть различных вакцин, но в РФ зарегистрированы лишь две — Cervarix (против 16 и 18 типов) и Gardasil (против 6, 11, 16 и 18 типов). Сейчас проводятся клинические испытания и отечественного препарата.
Платон Дмитриевич подчеркнул важность модификации системы эпидемиологического надзора над ИППП, так как сейчас не ведется сбор всей потенциально полезной информации. Для этого нужно создавать специализированные аналитические центры.
С точки зрения клинициста о важности молекулярной диагностики ВПЧ-инфекции рассказала Любовь Короленкова (НМИЦ онкологии им. Н.Н. Блохина Минздрава России). CIN возникают на фоне персистирующей ВПЧ-инфекции. Хотя и есть вероятность их регрессии или стабильного течения, CIN считаются предраковыми поражениями, которые предшествуют инвазивному раку. В связи с этим любой случай инвазивного рака шейки матки можно считать последствием упущенной диагностики и лечения непосредственно CIN2-3.
CIN и микроинвазивный рак шейки матки возникают в зоне трансформации, в переходной зоне стыка двух эпителиев и в эндоцервикальных криптах. При этом ВПЧ размножается в стволовых полипотентных и амплифицирующихся клетках. У одной и той же пациентки в разных участках эпителия шейки матки могут сочетаться разные степени поражения, при этом диагноз ставится по наибольшей из них. Со временем поражения могу проникать глубже в цервикальный канал, что приводит к затруднениям в диагностике: биоптат, взятый с эктоцервикса, может представлять не ту степень поражения, которая достигнута на самом деле.
Цитологический метод анализа недостаточно чувствителен для диагностики CIN: для CIN и микроинвазивного рака шейки матки его чувствительность всего 30-40%. При проведении всего одного раунда цитологического скрининга может быть пропущено до 28–35% случаев микроинвазивного рака. Также цитологический анализ может недостаточно точно предсказывать степень поражений — в том числе из-за неадекватного взятия мазка, так как обычно берется только материал эктоцервикса. Примерно в трети случаев предраковые поражения могут присутствовать только в эндоцервиксе, но традиционными методами они не могут быть обнаружены. Чтобы провести забор биоматериала и с экто-, и с эндоцервикса, нужно использовать либо специальную щетку, либо две отдельные щетки.
При проведении цитологического скрининга могут возникать ошибки. После получения аномальных результатов мазков пациентку отправляют к онкологу, который назначает повторный цитологический анализ. Однако результаты повторных мазков, взятых в течение 1,5 месяцев, имеют низкую воспроизводимость — лишь 54%. У каждой второй пациентки повторные мазки могут не содержать аномалий, несмотря на наличие предраковых процессов. В результате пациентки возвращаются к гинекологу, не получив препаратов для лечения.
Напротив, ВПЧ-тест — главный инструмент скрининга и ранней диагностики предраковых поражений и рака шейки матки. Его чувствительность близка к 100%, а при анализе дополнительных молекулярных маркеров такой тест потенциально способен стать заменой цитологического анализа. Вместе с тем ВПЧ-тест отличается низкой специфичностью, из-за чего ВПЧ-положительных женщин необходимо далее сортировать по группам риска наличия или развития CIN2+ и CIN3+ в ближайшие 3-5 лет. Такая сортировка, в основном проводящаяся с помощью цитологического анализа, ВПЧ-генотипирования или иммуноцитохимии на p16 или p16/Ki-67, помогает избежать ненужных медицинских процедур (кольпоскопия, эксцизия) в случаях, когда ВПЧ-инфекция персистирует, а CIN не развивается.
Для лечения пациенток с CIN3 и микроинвазивным раком шейки матки эффективна ЭХВЧ-конизация, которая оказывается успешной в 97% случаев. Только у 7% пациенток после конизации сохраняется положительный тест на ВПЧ, а из них только у 3% обнаруживается резистентность в лечению. Перед эксцизией для снижения вирусной нагрузки может применяться комбинированная терапия — инъекции аллокина-альфа. При такой терапии у 78% пациенток с CIN3/CIS снижалась вирусная нагрузка с медианой в 5,2 раз. Но если даже после конизации продолжается рост вирусной нагрузки, это говорит о рецидиве CIN. После эксцизии всех очагов неоплазии ВПЧ-тест становится отрицательным у подавляющего большинства пациенток.
Взгляд молекулярного биолога на ВПЧ-ассоциированные патологии шейки матки представила Марина Ибрагимова (НИИ онкологии Томского НИМЦ). Она отметила, что в течение жизни ВПЧ инфицируется около 90% женщин репродуктивного возраста. Такая высокая распространенность связана с путями передачи вируса.
Инфекция может передаваться не только половым путем, но и вертикальным и горизонтальным. Вертикальный путь передачи ВПЧ — самая частая причина заражения детей: ВПЧ определяется в околоплодных водах 15–23% беременных женщин. При горизонтальном пути заражение происходит через любые предметы, которые были контаминированы вирусом. Как показано в одной из работ, примерно 18% образцов гинекологического оборудования (32 из 179) были контаминированы ВПЧ, в том числе заражены 9% перчаток. В гонконгском исследовании 2013 года проверили приборы для трансвагинального УЗИ после того, как обследовали 14 ВПЧ-положительных женщин; 3 из 14 приборов (21%) оказались положительными, несмотря на соблюдение всех процедур дезинфекции.
Также ВПЧ-инфекция может передаваться при переливании крови или трансплантации органов. Есть публикации, свидетельствующие о том, что из 385 образцов от здоровых доноров крови 55% и 61% образцов положительны по ВПЧ и вирусу Эпштейна–Барр; а среди 35 женщин, которым пересадили почку умершего донора, 63% стали ВПЧ-положительными, хотя 59% из них до пересадки не были заражены.
Оказываясь в организме, ВПЧ инфицирует базальный слой эпителия. После проникновения вируса в клетки его ДНК освобождается от капсида и попадает в ядро, где существует в виде эписомы. Персистенция же инфекции вызывается интеграцией ДНК ВПЧ в геном клеток плоского эпителия, что приводит к геномной нестабильности и предшествует малигнизации клеток. Таким образом, выделяется две стадии ВПЧ-инфекции — продуктивная и интегративная. Первая стадия считается обратимой: при ее лечении у многих ВПЧ-инфицированных наступает ремиссия в течение 1-2 лет.
Хотя инфицирование ВПЧ переходит в цервикальные неоплазии в течении полугода, сам по себе РШМ прогрессирует очень медленно. Переход из CIN в опухоль может занимать десятки лет. Соответственно, если диагностировать болезнь на ранних этапах, можно добиться полного выздоровления пациентки при минимальных травматических вмешательствах.
Далее Марина Константиновна представила результаты собственных исследований, проведенных в Сибирском федеральном округе (СФО). Уровень заболеваемости РШМ в СФО составляет 22,25 на 100 000 населения, что выше среднего по России. Так, в Томской области заболеваемость равна 29,10 на 100 000 населения. В исследовании приняло участие 735 женщины из Томской области, разделенных на три группы: контрольную (235 женщин), группу с диспластическими изменениями различной степени тяжести (234 женщины) и группу с РШМ. Все пациентки проходили гинекологический осмотр с кольпоскопией, цитологическим и гистологическим исследованием. У них брали образцы соскоба маточного эпителия, из которых впоследствии выделяли ДНК и с помощью тестов на основе real-time ПЦР детектировали ВПЧ, определяли вирусную нагрузку и проводили генотипирование. В работе использовали тесты «АмплиСенс». Для пациенток, зараженных ВПЧ 16 типа, также проводили работу по определению интеграции вируса. Общая инфицированность ВПЧ среди участник исследования составила 66,5%, при этом в группе условно здоровых женщин этот показатель превышал 50%. В Томской области превалировало заражение ВПЧ типа 16: на него приходилось 78% всех случаев. На втором и третьем месте по частоте выявления находились типы 33 и 31. Вирусная нагрузка росла вместе с увеличением степени CIN и РШМ.
Из когорты исследователи выделили 148 женщин, моноинфицированных ВПЧ 16 типа. Среди них было 30 условно здоровых женщин, 53 пациентки с диспластическими изменениями и 65 пациенток с РШМ. При усугублении диагноза возрастала доля интегрированной формы вируса, в то время как доля эписомальной формы падала вплоть до 0% в группе с РШМ. Высокая вирусная нагрузка увеличивала вероятность интеграции ВПЧ в геном клеток.
Исследователи также проанализировали риск возникновения рециивов при CIN. Частота рецидивирования зависела от степени тяжести неоплазии и от формы интеграции вируса.
Наконец, ученые оценили выживаемость пациенток с раком шейки матки. У пациенток с эписомальной формой ВПЧ типа 16 безрецидивная и общая выживаемость достигала 100%. Наиболее неблагоприятный исход был характерен для больных с интегрированной формой ВПЧ типа 16.
Марина Константиновна подчеркнула, что необходимы профилактических мер по борьбе с РШМ, в том числе внесение вакцинации против ВПЧ в Национальный календарь прививок. Вакцинация против хотя бы 16 и 18 типов ВПЧ эффективно защищает от инвазивного ВПЧ-ассоциированного рака. Хотя чаще всего вакцинация проходит среди подростков, заболеваемость РШМ, напротив, растет среди пациенток старше 20 лет. Литературные данные показывают, что вакцинация даже в пост-подростковом периоде может защитить от ВПЧ-ассоциированного рака.
В России собственную квадривалентную вакцину от ВПЧ типов 6, 11, 16 и 18 планируют зарегистрировать в 2025 году, и к 2025-2026 году она должна войти в Национальный календарь профилактических прививок.
О возможности использования ВПЧ как прогностического маркера у больных РШМ рассказала Ольга Чуруксаева (НИИ онкологии Томского НИМЦ). Известные прогностические факторы РШМ — это распространение и размер опухоли, глубина инвазии стромы, гистотип опухоли, сосудисто-лимфатическая инвазия. Однако в литературе обсуждаются и другие маркеры, в том числе рецепторы гормонов, биохимические маркеры, экспрессия онкогенов и антигенов, связанных с пролиферацией клеток (например, Ki-67). Так как ВПЧ является непосредственной причиной развития РШМ, наличие этой инфекции может влиять на течение болезни и на эффект лечения.
Согласно собственным данным исследователей, высокая вирусная нагрузка характерна для инвазивного и местно-распространенного РШМ. У больных с местно-распространенным РШМ повышается экспрессия онкопротеина p16ink4a, причем она повышается вместе с прогрессией болезни. Этот белок является маркером начала ВПЧ-ассоциированного канцерогенеза. Показатель трехлетней безрецидивной выживаемости равен 50% у p16ink4a-отрицательных пациентов, но снижается до 25% у пациентов с высокой экспрессией этого белка.
Существование ВПЧ-негативного РШМ все еще вызывает споры. Некоторые авторы считают, что это отдельная, более агрессивная форма рака, в то время как другие полагают, что речь идет о ложноотрицательных результатах ВПЧ-тестов и недостаточности диагностики. Это может быть связано с тем, что при интеграции вируса в геном клеток происходит разрушение его гена E2, в результате чего могут детектироваться пороговые, неопределяемые количества вируса. Отрицательный результат на ВПЧ при РШМ может также быть связан с неадекватным взятием биоматериала, с наличием мутаций или с гипердиагностикой патологий шейки матки. При этом у ВПЧ-негативного РШМ прогноз не хуже, чем у ВПЧ-ассоциированных форм рака. Что интересно, ни в одном случае ВПЧ-негативного рака в исследованиях не выявлялось экспрессии p16, а экспрессия p53 регистрировалась в 70% ВПЧ-положительных и в 36% ВПЧ-отрицательных формах рака. В то же время есть и другие литературные данные, согласно которым общая и безрецидивная выживаемость повышалась практически в два раза в ВПЧ-ассоциированных формах рака по сравнению с ВПЧ-негативным РШМ.
По данным отделения гинекологии НИИ онкологии Томского НИМЦ, выживаемость у ВПЧ-положительных больных местно-распространенным РШМ была выше по сравнению с выживаемостью пациентов с ВПЧ-негативным РШМ. Одногодичная выживаемость составила 89% и 79%, соответственно, а пятилетняя — 66% и 32%. Рецидивы встречались у 26% ВПЧ-положительных пациентов и у 59% ВПЧ-отрицательных. При ВПЧ-ассоциированном РШМ также наблюдались удаленные метастазы, тогда как ВПЧ-негативный рак чаще был местно-распространенным.
Отдельно Ольга Николаевна рассказала о связи между ВПЧ-ассоциированным РШМ и поражением тазовых лимфатических узлов. Литературные данные об этом противоречивы. РШМ прогрессировал у 15% пациентов, у которых после резекции не было поражения лимфатических узлов ВПЧ. Наличие поражения лимфоузлов, напротив, значительно снижало заболеваемость РШМ до 40-60%. В других исследованиях, однако, говорится, что при поражении тазовых лимфоузлов ВПЧ повышается риск рецидива и снижается выживаемость пациентов. Аналогичные результаты были получены при определении мРНК ВПЧ в сторожевых лимфоузлах.
Таким образом, ВПЧ можно рассматривать как суррогатный маркер, который оказывает влияние на течение рака шейки матки. В литературе была установлена связь ВПЧ с безрецидивной, опухоль-специфической и общей выживаемостью.
Заключительный доклад «Влияние микробиоты влагалища на течение ВПЧ-инфекции» представил Александр Ерышалов, специалист по новой продукции ООО «НекстБИО», врач аллерголог-иммунолог. На данный момент остаются неизвестными факторы прогрессии ВПЧ-инфекции, однако высказывается мнение о том, что с ней могут быть ассоциированы ИППП — гонорея, хламидиоз, трихомониаз, микоплазмоз.
На прогрессию ВПЧ-инфекции может влиять бактериальный вагиноз. В этом случае развивается провоспалительная среда, которая облегчает экспрессию генов E6 и E7 вируса, которые отвечают за интеграцию в геном клеток. Напротив, нормальная вагинальная микробиота снижает риск заражения ВПЧ. Так, преобладание лактобактерий способствует элиминации вируса. Усугублять бактериальный вагиноз могут условно-патогенные микоплазмы: Mycoplasma hominis, Ureaplasma urealyticum, U. parvum. Возможно, они повышают не только риск заражения ВПЧ, но и риск возникновения аномалий в клетках эпителия шейки матки.
На течение ВПЧ-инфекции влияет аэробный вагинит — воспаление влагалища, которое характеризуется ростом стрептококков, стафилококков и энтеробактерий и снижением нормальной лактофлоры. Хотя это заболевание не так распространено, изменения при аэробном вагините могут сильнее, чем при бактериальном вагинозе, влиять на прогрессию CIN.
Александр Михайлович считает, что скрининг на ВПЧ-инфекцию должен также включать в себя выявление сопутствующих инфекций. Такой скрининг можно проводить, например, с помощью теста АмплиПрайм ФЛОРОСКРИН + NCMT. Он определяет микоплазм, кандид, аэробов и возбудителей бактериального вагиноза и ИППП. Все тесты основаны на количественной ПЦР.
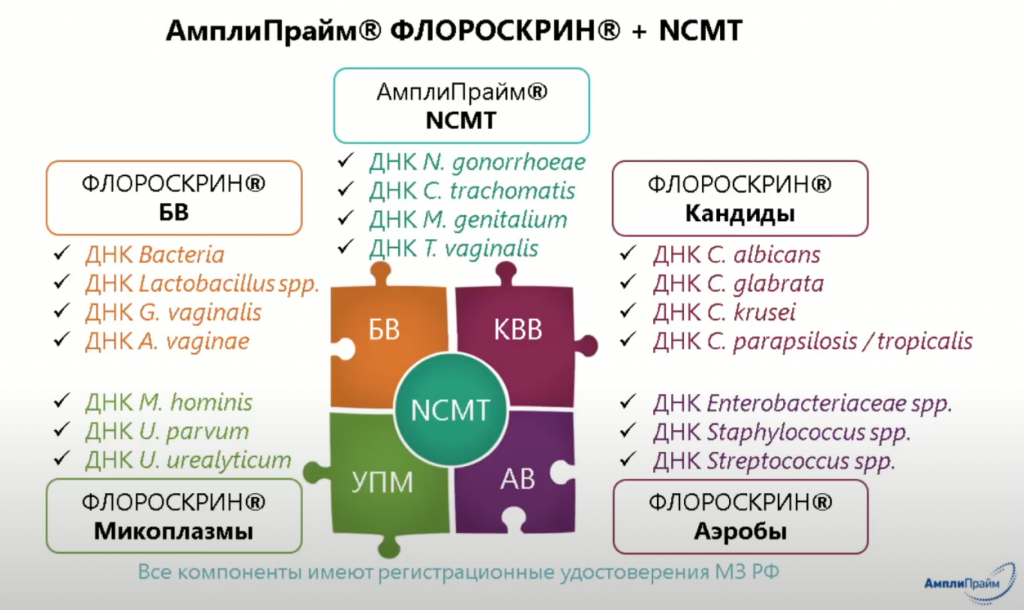
Александр Ерышалов предложил базовую диагностическую модель скрининга женщин до 25 лет, которая будет включать только тест на ВПЧ высокого канцерогенного риска. Расширенная диагностика среди пациенток, ведущих активную половую жизнь, также должна включать обнаружение возбудителей ИППП и бактериального вагиноза, которые иногда могут протекать бессимптомно. Пациенткам с патологическими влагалищными выделениями рекомендуется дополнительно проходить тесты на аэробов, кандид и микоплазм. Для всего этого может использоваться тест АмплиПрайм, по итогам которого можно присвоить код МКБ-10 и получить количественный результат, а затем подобрать наиболее подходящее лечение.
Информация о докладчиках
Ольга Юрьевна Шипулина, директор департамента Молекулярно-генетических исследований АО «ЛабКвест».
Платон Дмитриевич Лопухов, к. м. н., доцент кафедры эпидемиологии и доказательной медицины Института общественного здоровья им. Ф.Ф. Эрисмана Сеченовского университета
Любовь Ивановна Короленкова, д. м. н., ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Марина Константиновна Ибрагимова, к. б. н., старший научный сотрудник лаборатории онковирусологии НИИ онкологии Томского НИМЦ
Ольга Николаевна Чуруксаева, д. м. н., старший научный сотрудник отделения гинекологии, секретарь научно-экспертного совета НИИ онкологии Томского НИМЦ
Александр Михайлович Ерышалов, специалист по новой продукции ООО «НекстБИО», врач аллерголог-иммунолог


 Меню
Меню





 Все темы
Все темы




 0
0








