Разработка вакцин во время пандемии требует смены парадигм
Как создать вакцину против нового патогена достаточно быстро и при этом без ущерба для безопасности и эффективности? Журнал Science рассматривает уже начатые попытки, а специалисты CEPI на страницах The New England Journal of Medicine описывают организационные меры, способные ускорить процесс.

Что уже делается
16 марта 2020 года компании Moderna Therapeutics и CanSino Biologics начали клинические испытания вакцин против COVID-19 для проверки их безопасности и иммуногенности. Эти компании пока опережают остальных разработчиков. Сводная таблица по всем вакцинам, с указанием технологий, производителей и статусов продукта доступна на сайте ВОЗ.
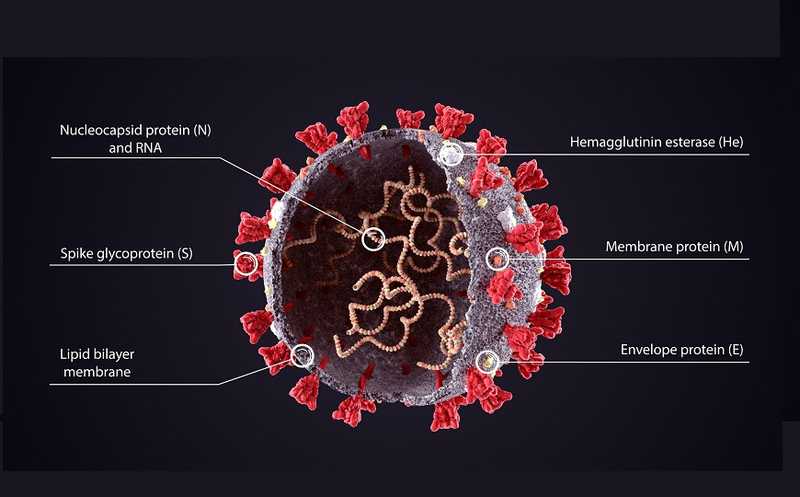
Компании используют как новые, так и проверенные временем платформы для создания вакцин. Так, препарат Sinovac Biotech представляет собой химически инактивированные вирусные частицы с добавлением квасцового бустера. Такую же стратегию компания использовала при разработке вакцины против SARS, которая хорошо показала себя в испытаниях на животных. CanSino использует другой подход: в роли носителя гена S-белка SARS-CoV-2 выступает нереплицирующийся аденовирусный вектор Ad5. Однако аденовирус-5 вызывает сезонные простуды, и у многих людей есть к нему иммунитет. Некоторые исследователи считают, что введение такой вакцины может вызвать иммунный ответ к вектору, что не позволит ему доставить ген S-белка в человеческие клетки. Вакцина, разработку которой спонсирует Johnson & Johnson, имеет в основе аденовирус Ad26.
Другие производители используют ослабленную версию вируса SARS-CoV-2; реплицирующийся, но безвредный вирус кори в качестве вектора для гена S-белка коронавируса; ДНК-плазмиду, несущую ген вируса и белки SARS-CoV-2, которые самособираются в вирусоподобные частицы, и т. д. Разработчики считают, что на ранней стадии необходимо пробовать разные подходы: никто не знает, какая вакцина сработает.
К новым платформам относятся вакцины против COVID-19 на основе мРНК. Над такими препаратами работают Moderna и CureVac. Компанию Moderna можно назвать рекордсменом скорости: 13 января 2020 года, через три дня после того, как в открытом доступе появилась первая полная последовательность РНК нового коронавируса, иммунолог Национального института аллергии и инфекционных заболеваний США (NIAID) Барни Грэм отправил компании Moderna оптимизированную последовательность гена S-белка нового коронавируса, которая легла в основу мРНК-вакцины. Первые дозы препарата были введены добровольцам в рамках небольшого клинического исследования всего 63 дня спустя.
Новый коронавирус не выглядит недоступной для вакцинации мишенью. Его геном изменяется медленно, вакцины против родственных вирусов, вызывающих MERS и SARS, работают на животных моделях. У людей, перенесших MERS и SARS, формируется долговременный иммунитет, чего можно ожидать и от COVID-19. Кроме того, SARS-CoV-2 атакует нижние отделы дыхательных путей, где иммунный ответ сильнее, чем в верхних дыхательных путях.
Тем не менее специалисты считают, что готовая к использованию вакцина против COVID-19 появится не ранее, чем через год-полтора. Этот срок увеличится, если в процессе внедрения препарата в практику возникнут дополнительные препятствия в виде побочных эффектов, неоптимальной дозировки или сбоев в производстве.
Вакцину Moderna и семи других компаний финансирует Коалиция за инновации для готовности к эпидемиям (CEPI). Эксперты CEPI тщательно отбирали наиболее перспективные разработки, не упуская при этом из внимания остальные, чтобы иметь подстраховку на случай непредвиденных обстоятельств. После обработки результатов доклинических и первой фазы клинических испытаний CEPI планирует продвинуть шесть из восьми продуктов на следующий уровень исследований безопасности. После этого будут выбраны три препарата для полномасштабных клинических испытаний с участием 5 000 человек. Сейчас в распоряжении CEPI $300 млн. Вся программа оценена в $2 млрд., и CEPI надеется получить недостающие средства от правительственных организаций, частных инвесторов, промышленников и Фонда ООН. На страницах NEJM специалисты CEPI рассказывают, как должна выглядеть разработка вакцин в условиях пандемии.
Подготовка к неизвестным пандемиям
В последнее десятилетие прорывы в базовых научных областях, включая геномику и структурную биологию, открыли новую эру разработки вакцин. Вместе с этим пришла потребность в новых платформах для их создания и производства, легко адаптируемых к новым патогенам.
CEPI поддерживает разработку вакцин против пяти патогенов из приоритетного списка ВОЗ. Цель CEPI — создание для каждого патогена резервов исследовательских вакцин, прошедших фазу IIа клинических испытаний, с расчетом на то, что клинические испытания продолжатся во время вспышки заболевания. CEPI также финансирует развитие технологий для ответа на эпидемии новых заболеваний, таких как COVID-19. Идеальная платформа должна обеспечивать разработку вакцин от получения последовательности генома вируса до клинических испытаний в сроки не более 16 недель и давать возможность производства препаратов в больших объемах.
ДНК- и РНК-платформы имеют наибольший потенциал. Вакцины на основе нуклеиновых кислот можно сделать быстро, так как они не требуют культивирования или ферментации. Для тестирования и внедрения в практику таких препаратов можно использовать опыт разработчиков и регулирующих органов в области персонализированных вакцин от рака.
Тем не менее разработка вакцины против SARS-CoV-2 на новой платформе связана с проблемами. Во-первых, самым перспективным иммуногеном считается S-белок, однако для выработки иммунного ответа критична оптимизация дизайна антигена. Сейчас ведутся споры о том, должен ли стать мишенью полноразмерный белок или только его рецепторсвязывающий домен.
Во-вторых, опыт доклинических исследований вакцин против SARS и MERS говорит о возможном ухудшении течения заболевания легких из-за прямого действия вакцины либо в результате воздействия антител. Следовательно, необходимо тестирование на подходящих животных моделях и тщательный мониторинг безопасности в клинических испытаниях. (Пока рано говорить об оптимальной животной модели для изучения COVID-19; многообещающе выглядят макаки-резусы, хомячки и хорьки.)
В-третьих, сейчас невозможно оценить защитный потенциал и оптимальную дозировку вакцины.
Время и деньги
Разработка вакцин — это дорогостоящий процесс. Из-за высокой стоимости и большого процента неудач разработчики, как правило, следуют линейной последовательности шагов с множеством пауз для промежуточного анализа данных или проверки процесса производства. Быстрая разработка вакцины в условиях пандемии требует новой парадигмы, с быстрым стартом и множеством параллельных процессов. Например, при использовании платформы, уже испытанной на людях, можно совмещать фазу I клинических испытаний с тестированием на животных моделях. Однако такой подход приводит к увеличению финансовых рисков.
Сейчас запущен выпуск дополнительного материала для проведения фазы II испытаний некоторых кандидатных вакцин. Быстрое продвижение продукта после фазы II требует масштабирования производства до коммерческого уровня раньше, чем будут доступны данные о безопасности и иммуногенности вакцины. Организация производства может обойтись в сотни миллионов долларов. Более того, для промышленного запуска новых технологий необходимо заранее подобрать оборудование и адаптировать известные методы. При этом не может быть уверенности в том, что новые платформы легко масштабируются или что доступные мощности позволят выпустить необходимое количество вакцины достаточно быстро.
Проведение клинических испытаний во время пандемии сопряжено с дополнительными трудностями. Сложно предсказать, где и когда случится вспышка, как и подготовить базу для испытаний одновременно с выпуском тестовой партии вакцины. Кроме того, если ко второй половине 2020 года будет готово множество вакцин, важно будет не перегрузить испытаниями и заявками исследовательские учреждения и регулирующие органы.
Отдельная проблема — при высокой смертности от заболевания нежелательно по этическим соображениям проводить рандомизированные контролируемые исследования с плацебо-группами. Решением в некоторых случаях может быть сравнение последствий ранней и отложенной вакцинации. Еще один возможный путь — тестирование нескольких вакцин в рамках одного исследования с одной контрольной группой. Этот подход сложен с точки зрения логистики и статистики, и разработчики стараются его избегать.
Специалисты CEPI также отмечают проблему финансирования. Пандемии рождают спрос на вакцины во всем мире. В странах с высоким доходом вакцину может оплатить население, однако не существует такой организации, которая занималась бы глобальным финансированием, производством и распределением вакцин. Некоторые страны Большой семерки уже заявили о необходимости соответствующей системы планирования, которая должна работать параллельно с разработкой вакцин.
Маловероятно, что пандемия COVID-19 закончится раньше, чем будут готовы вакцины. CEPI планирует продолжить разработку и произвести достаточное количество доз, готовых к клиническим испытаниям и экстренному одобрению регулирующих органов при новой волне заболевания. Критическим компонентом, обеспечивающим готовность к пандемии, должна стать глобальная система финансирования, которая поддержит разработку препаратов, их производство, внедрение в практику и справедливое распределение, а также защитит частный сектор от значительных денежных потерь.Источники
Nicole Lurie, M.D., et al. // Developing Covid-19 Vaccines at Pandemic Speed. // March 30, 2020; DOI: 10.1056/NEJMp2005630
Jon Cohen. // With record-setting speed, vaccinemakers take their first shots at the new coronavirus. // Science, Mar. 31, 2020; DOI: 10.1126/science.abb9996

 Меню
Меню





 Все темы
Все темы




 0
0