RCM — новая технология в конфокальной микроскопии: история успеха
Ресканирующая конфокальная микроскопия (RCM) — метод, который позволяет получать изображение с улучшенными разрешением и чувствительностью и при этом использовать низкие мощности лазеров, что делает микроскопирование безвредным для клеток. О ресканирующей конфокальной микроскопии рассказывают Питер Дрент, CEO нидерландской компании Confocal.nl, занимающейся распространением этой технологии, и Ерун Кол, специалист по поддержке продукции компании.

Клетки фибробластов кожи индийского оленя мунтжака. Окрашивание: синий — DAPI, зеленый — Phalloidin-Alexa488, красный: Mitotracker CMXRos. Верхний ряд — полное поле зрения, нижний — увеличенный фрагментю
Credit: Jeroen Kole | Confocal.nl
Александра Борисова: Я научный журналист, меня зовут Александра Борисова. Сегодня я буду рада поговорить с представителями Confocal.nl о технологии RСM ( Re-scan confocal microscopy, ресканирующая конфокальная микроскопия. — PCR.news). Мой первый вопрос — об истории метода: как появилась идея такой микроскопии, кто стоял у ее истоков, сколько лет прошло от первой идеи до первого шага к реализации?
Питер Дрент: Если оглянуться назад, этой идее целых десять лет. Она появилась в лаборатории Эрика Мандерса. Девушка по имени Джулия Де Лука работала над созданием конфокального микроскопа с очень чувствительным детектором. Изначальная идея была в том, чтобы разработать конфокальный микроскоп, который использовал бы в качестве детектора камеру; у обычного конфокального микроскопа роль детектора выполняет ФЭУ — фотоэлектронный умножитель. Камеры, которые используются в научных целях, например, в астрономии, в два-три раза чувствительнее ФЭУ. Джулия десять лет назад начала размышлять, как использовать такие камеры в качестве детектора, а пять лет назад она стала PhD, в это время мы с Эриком Мандерсом основали Confocal.nl. Мы скомбинировали два открытия: научное и техническое. Техническое было об использовании камеры в качестве детектора, а научное состояло в том, что если мы смогли использовать камеру, то получится улучшить разрешение. Мы используем лазер для возбуждения флуорофоров в образце, собираем излучаемый ими свет, и в обычном микроскопе он идет в специальную диафрагму (пинхол, или точечная диафрагма), и мы получаем одно измерение. Джулия же предложила поставить на место пинхола второй сканер, который проецировал изображение на камеру, и так происходит съемка по точкам, линиям и по фрагментам. Мы используем камеру с большим временем экспозиции и записываем на нее изображение в сверхвысоком разрешении.
В чем же научная составляющая открытия? Если область, которую снимает камера, больше самой камеры, то что происходит с изображением при его обратном масштабировании? Представим, что мы рисуем карандашом на двух листах — одном формата А3 и другом формата А4, а затем сканируем лист А3 и делаем его копию формата А4. Что произойдет с линией? Она станет более резкой. RSM-микроскопия работает так же, как и копировальная машина в этом случае: она оптически и механически увеличивает разрешение, позволяя получить более резкие изображения.
А.Б. Пять лет назад вы были на одной из руководящих должностей в Nikon Instruments Europe, верно? Как получилось, что вы решили перейти в этот стартап, почему вы поверили в него и присоединились к команде, которая выводит новую, ранее неизвестную технологию на рынок?
П.Д. Да, я действительно был генеральным управляющим в Nikon Instruments Europe, отвечал за европейский, африканский и российский рынок. Чтобы объяснить свое решение, я вернусь еще немного назад, на десять-одиннадцать лет. Возможно, вы знаете, что в Нидерландах есть газ, и голландское правительство всегда закладывает в бюджет цены на него. На мировом рынке цены на газ зависят от цен на нефть, и государственный бюджет всегда имеет с этого прибыль. Ее государство всегда вкладывало в развитие научного сообщества — так называемую экономику знаний. Когда голландское правительство инвестировало в научные группы, оно ожидало, чтобы компании были тоже вовлечены в это, чтобы оценивать применимость научных открытий на практике и пользу для общества. Эрик Мандерс как ученый в то время сформировал группу так называемой наноскопии, а меня пригласили как представителя Nikon. Эрик выиграл грант на 6,5 млн евро, на них он привлек 15 PhD студентов, одной из них была Джулия. Для голландского правительства также важно, чтобы представители компаний находились в так называемом комитете пользователей, и я как раз был одним из них. У меня правительство спрашивало, что необходимо для коммерциализации проекта Эрика, и изобретение Джулии действительно все оценили. Я дал простые рекомендации: нужно вывести это из университета, чтобы люди вне академической среды также были вовлечены в коммерциализацию. Но этого не случилось. Спустя несколько лет в Nikon произошла реорганизация, я был в поисках нового места, и в правительстве меня спрашивали: почему вы сами не организовали ту компанию? В итоге я поучаствовал в ее организации. Я хотел еще раз в жизни получить все, что хочу, и подумал, что эта компания даст мне такой шанс, ведь это была атмосфера творчества. Творчество было моей главной мотивацией, побудившей присоединиться к этой компании.
А.Б. Вы уже начали говорить об этом «треугольнике» между государственным финансированием, университетскими инновациями и деятельностью стартапов. Я знаю, что вы в прошлом биолог, так что, полагаю, хорошо понимаете, как устроена работа в академической науке. Расскажите, пожалуйста, подробнее, как в вашем случае осуществлялось взаимодействие с Амстердамским университетом, как в Нидерландах мотивируют людей из академии участвовать в стартапах и спин-оффах? Какова роль университета, помогает ли он с патентованием, логистикой, офисными помещениями?
П.Д. В Нидерландах в университетах есть центры переноса знаний — люди, там работающие, общаются с учеными и помогают им оформлять патенты. Также они ищут компании, готовые использовать эти патенты. В случае с Confocal.nl центр переноса знаний Амстердамского университета очень поспособствовал созданию компании. Он сопровождал весь процесс организации, давал советы, помогал разобраться в «университетской политике», а также найти начальный бюджет. Компания базировалась на венчурном фонде Амстердамского университета. Роль этого венчурного фонда – стимулировать создание компаний. Были некоторые сложности в связи с тем, что мы с Эриком уже не молоды, но они оценили наш опыт, а также сильно помогли нашим студентам. Венчурный фонд был нашим стартовым капиталом, но спустя несколько лет нам стали нужны еще деньги для масштабирования. У университета была только задача вывести технологию на рынок, а для масштабирования нам нужны были новые коммерческие инвесторы. Я потратил около года на поиски, в итоге мы нашли голландскую инвестиционную компанию под названием Value Creation Capital, и они помогли нам и деньгами, и советом. Сейчас мы уже зрелая компания, и это результат комбинации академической и коммерческой помощи. Благодаря этому теперь мы в фазе дальнейшего расширения.
А.Б. Звучит неплохо! А патент был до того, как ваша компания организовалась?
П.Д. Да, это хороший вопрос. Первый патент был сделан университетом и принадлежал ему. Но для коммерческой компании патентное портфолио — важная часть ее ценности, поэтому коммерческий инвестор настоял, чтобы патент перешел компании. Компания купила его у университета.
А.Б. Очень интересно, с юридической точки зрения. У университета есть право не только патентовать, но и продавать патенты, чтобы стимулировать развитие бизнеса, верно?
П.Д. Да, конечно. В университете все сотрудники заключают трудовой договор, по которому все результаты и открытия принадлежат университету. Поэтому университет может коммерциализовать, то есть продать, патент, но сам изобретатель, автор идеи получает обратную связь — университет получает деньги от продажи, а изобретатель от университета. Это спираль, которая стимулирует всех работать в университете.
А.Б. То есть ты всегда получаешь что-то взамен, и это мотивирует людей в академии, что само по себе довольно сложная вещь. Давайте вернемся к созданию компании. Как вы объединили команду, которая уже собралась из университета, и новых людей из области бизнеса? Кто образовал ядро новой команды?
П.Д. Изначально у нас не было офиса. Я нелегально проходил в университет в комнаты для встреч без возможности забронировать их официально, делал там копии документов… Но потом мне в университете сказали: Питер, вы слишком часто тут появляетесь, вы должны начать за это платить. Рядом с университетом сдается в аренду здание, вы можете арендовать там комнату. Для нас, конечно, это было удобнее: на ресепшене здания сидела девушка, которая могла принимать и посылать посылки. Эрик первые три года оставался сотрудником университета, потом перебрался в компанию. В начале у нас были студенты, но нам нужно было нанять сотрудников. Сперва к нам присоединилась женщина из университета, которая давно наблюдала за нашим стартапом. Потом мы стали присматриваться к другим людям, работающим в нашей области. Например, нас привлек организатор курсов по микроскопии из Бангалора, мы предложили ему позицию, и он переехал в Амстердам. Еще один человек — это Ерун Кол, который сегодня будет рассказывать о работе микроскопа, он пришел к нам в компанию из университета, и мы поняли, что он нам подходит, пригласили его. В компании нам приходится все время быть в активном поиске новых людей. У меня на уме всегда есть один-два человека еще до того, как позиции становятся открытыми.
А.Б. А какова судьба автора идеи, Джулии Де Лука, она тоже переместилась в компанию или осталась работать в академии?
П.Д. Мне всегда хотелось, чтобы она стала частью нашей компании. Но она выбрала другое направление своей личной жизни: я думаю, она хотела выйти замуж, вести размеренную жизнь, а молодая компания — это очень беспокойное место. Сегодня ты счастлив, завтра плачешь. Нужно иметь выносливость, чтобы справляться. Если ваше видение жизни с этим не совпадает, то не стоит пытаться так работать.
А.Б. Да, конечно, это очень специфический вид деятельности.
П.Д. Но она активно следит за нами, она за нас очень рада.
А.Б. Расскажите еще о получении финансирования. Вы говорили о передаче патента, но что имело при этом основополагающее значение, важны ли были награды, которые вы получали? Любая ли компания может получить такое финансирование, или играли роль ваши связи и энтузиазм?
П.Д. Я бы сказал, что получить изначальное финансирование от университета было очень просто. Это была задача университета — финансировать такие спин-офф компании, поэтому они не могли критиковать их очень строго. Чтобы мы могли получить коммерческое финансирование, меня рассматривали 23 компании, потому что это были те люди, с которыми предстояло работать долго, и должна была существовать взаимосвязь. Инвесторам всегда важно выбрать подходящий патент. Что еще важно — участвовать в любой возможности привлечь к себе внимание. Мы искали разные медицинские мероприятия. Любая публичность хороша, даже если для этого вам приходится снизить цену. Потому что так люди вас запомнят.
А.Б. Как вы убеждаете исследователей воспользоваться вашим новым методом микроскопии? Было ли сложно делать первые шаги, как ученые реагировали на вас поначалу?
П.Д. Это очень, очень важная задача. Вначале ты думаешь: я знаю, что я всем нужен. Но все думают иначе, они говорят: вначале докажи это, а потом я встречусь с тобой. Было исследование, что в среднем в области микроскопии новая технология принимается спустя два года после первого появления, и это в Европе, а в других странах срок еще больше. Мы постоянно должны доказывать, что по праву занимаем место на рынке. Наш первый клиент был очень известен в своей области исследований в Германии. Он стал нашим первым клиентом, потому что знал академическое исследование Эрика, был знаком со мной и знал о моем желании коммерциализировать технологию. В области микроскопии все существующие компании довольно закрытые, и исследователи мало могут на них влиять. А когда появляется молодая компания, она открыта для предложений. Еще мы предлагали не покупать всю новую систему, а модернизировать уже имеющийся микроскоп. Благодаря нашим детектирующим камерам мы можем сделать любой существующий микроскоп лучше, чем новые микроскопы, которые предлагают другие компании. Это экономит деньги потребителя. Но потребителю требуется время, чтобы оценить эти преимущества. Наши камеры очень чувствительны, а у ученых, которые работают с единичными молекулами, обычно очень низкая интенсивность света, но они привыкли. Нам приходилось показывать изображения, доказывать им чувствительность нашего детектора, низкую фототоксичность. Обычные технологии высокого разрешения, такие, как STED или SIM микроскопия, используют очень мощные лазеры (сотни и тысячи милливатт), которые повреждают клетки. Наша технология работает с нановаттами, которые безопасны для клеток, а разрешение у нас высокое. Сейчас люди стали это понимать и использовать, но потребовалось пять лет.
А.Б. Да, я понимаю проблему, связанную с интенсивностью излучения. Но вам нужно было объяснить не только эту проблему, но и ваш метод ее решения.
П.Д. Помимо компании, я еще работаю ментором. Я обучаю четверых студентов организовывать их собственный стартап. Про эти пять лет я говорю им так: не сдавайтесь, не сдавайтесь, продолжайте делать свое дело!
А.Б. Как вы думаете, заменит ли RCM в будущем классическую конфокальную микроскопию? На чем сфокусируется компания — на модернизации имеющихся микроскопов, или вы будете производить собственное оборудование?
П.Д. Я лично сомневаюсь, что какая-то единственная технология станет доминирующей на рынке. Это как если бы все ездили на «феррари», но ведь на нем не поедешь в обычный магазин. Различные области применения требуют разных систем. Но наши системы основаны на камерах, они чувствительнее и дешевле, их проще внедрять и использовать. Наши камеры 16-битные, их глубина изображения 16 битов, что позволяет собирать свет от лазера даже с пересветом или недосветом. ФЭУ не позволяют получить такой глубины.
Я бы еще хотел поговорить о том, какое влияние оказало наше изобретение на всю область. Нашей целью изначально было повысить разрешение и чувствительность, что привело и к низкой фототоксичности. В течение последних пяти лет мы поняли, что камеры, которые мы используем, также очень чувствительны в инфракрасном диапазоне, а ФЭУ в нем совсем не чувствителен. Флуорофоры в ИК-диапазоне не так распространены, поскольку микроскоп не может их детектировать. Но есть тип микроскопов, который использует ИК-диапазон, — двухфотонные микроскопы. ИК-лазер проникает глубоко внутрь образца, затем два фотона складываются и получается свет в видимом диапазоне. Поэтому в этом типе микроскопии можно применять традиционные флуорофоры видимого диапазона. Те, кто использует эту технику, например, для визуализации целой мыши, привыкли к ИК-диапазону. И они используют 800-нанометровые зонды, близкие к ИК-диапазону. На таком рынке использование ИК-красителей не считается чем-то необычным.
Мы можем создать из нашего микроскопа подобную систему, но с поглощением и эмиссией в ИК-спектре. Но у нас будет возбуждающим не множество фотонов, а единственный. У нас был грант по визуализации миндалин, их толщина около миллиметра, и в итоге у нас это получилось. Мы создали световую систему на основе инфракрасных красителей, которая могла проникать в ткань более чем на 1 мм. Эту технологию мы предлагаем использовать и в медицине, например, в флуоресцентно-направляемой хирургии, когда ткани пациента во время операции будут окрашены флуорохромом инфракрасной области. Иногда, например, опухоли имеют очень малый размер, в частности в области шеи, и в девяноста процентах случаев хирург не может гарантировать безопасный результат, пока не будет подтверждения от патогистолога, что вся опухолевая ткань удалена. Так что патогистологам тоже может пригодиться инфракрасная микроскопия.
А.Б. То есть, патогистолог должен проверить, что хирург удалил всю опухоль и захватил небольшой участок здоровой ткани, чем меньше, тем лучше?
П.Д. Да, представьте масштаб: в год проводят 600 тысяч операций на опухолях в области шеи, и в девяноста процентах случаев хирург не может быть уверен, что удалил опухоль полностью. Если бы мы могли сократить эту долю хотя бы до 50 процентов, мы бы спасли множество жизней.
А.Б. Да, конечно. Это повысит точность хирургии.
П.Д. Так получилось, что когда мы стали исследовать различные рынки, то и нашли такие совсем новые возможности для применения. Поэтому для маленькой компании так важно быть открытой для новой технологии и новых рынков.
А.Б. Подводя итоги: что сейчас представляет собой Confocal.nl и каким вы видите ее будущее, скажем, в ближайшие 10 лет? Каким вы видите ваш рынок географически, какие еще видите практические применения, как сильно вы вырастете?
П.Д. У нас большие амбиции. Мы начинали с одного человека, а теперь нас десять, несколько человек еще связано с компанией косвенно. В ближайшие пять десять лет наша компания должна стать больше. Мы начали как компания одного продукта, однако мы собираемся стать компанией множества продуктов. Это наш план роста, и это нужно для стабильности компании. Бывают хорошие и плохие времена, но чем больше компания растет, тем она стабильнее и предсказуемее, становится проще планировать на будущее. После расширения мы сможем планировать новые продукты, области применения, продажи. Вначале продажи были сложны, хотя у меня была своя сеть клиентов еще из Nikon, сперва я использовал ее очень много. Сейчас я ее расширяю. Также мы открываем внешний рынок — наша продукция уже продавалась в США, Китай, Индию. Пока мы не работаем в Южной Америке, но к нам уже присоединилась женщина оттуда, которая хочет развивать там рынок. Лично я бы хотел иметь успех и в России. Когда я работал в Nikon, я ездил в Россию и немного представляю российский рынок, думаю, нам он достаточно интересен как в исследовательской, так и в медицинской сфере.
А.Б. Большое спасибо. Думаю, мы закончили с вопросами и можем перейти к демонстрации.
Ерун Кол (00.39.48). Я начну с презентации метода RCM, в основном суммирую то, что уже сказал Питер. Меня зовут Ерун Кол (Jeroen Kole), я специалист по поддержке продукции в Confocal.nl, работаю в компании уже два года, к моему большому удовольствию. В этой презентации я покажу, как работает технология RCM по сравнению с другими методами получения изображений, как с помощью нее можно снимать живые клетки, расскажу о структуре системы для RCM и как мы можем собрать ее под ваши запросы, а затем я покажу живую демонстрацию на платформе NIS Elements (программное обеспечение Nikon).
На этом слайде вы видите фотографию оборудования. RCM добавляет к микроскопу возможность снимать 3D срезы, улучшает разрешение, и все это очень выгодно с точки зрения стоимости. Это сэкономит ваш бюджет и позволит получить лучшие результаты.

Вот принцип стандартного конфокального микроскопа с ФЭУ в качестве детектора. Давайте взглянем на него, чтобы понять, в чем новизна RCM.
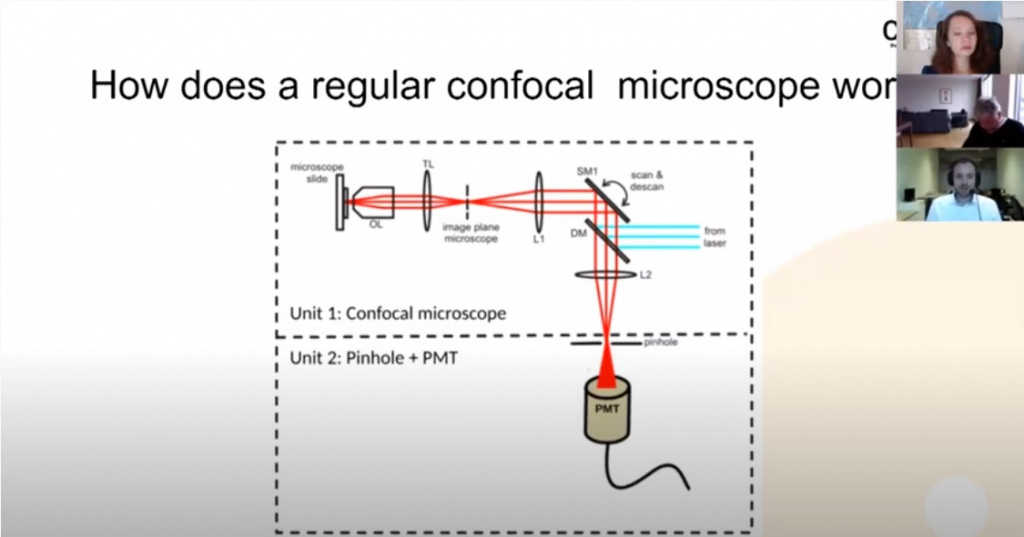
Луч лазера отражается от дихроического сканирующего зеркала, затем проецируется на объект с помощью линзы объектива. Излученный свет (флуоресценция) попадает назад, проходит через дихроическое зеркало и фокусируется на пинхол. Свет из пинхола детектируется на ФЭУ. Важная черта ФЭУ — их относительно низкая чувствительность. На графиках показана чувствительность (квантовая эффективность) различных ФЭУ, то есть как эффективно детектор конвертирует фотоны в электроны.
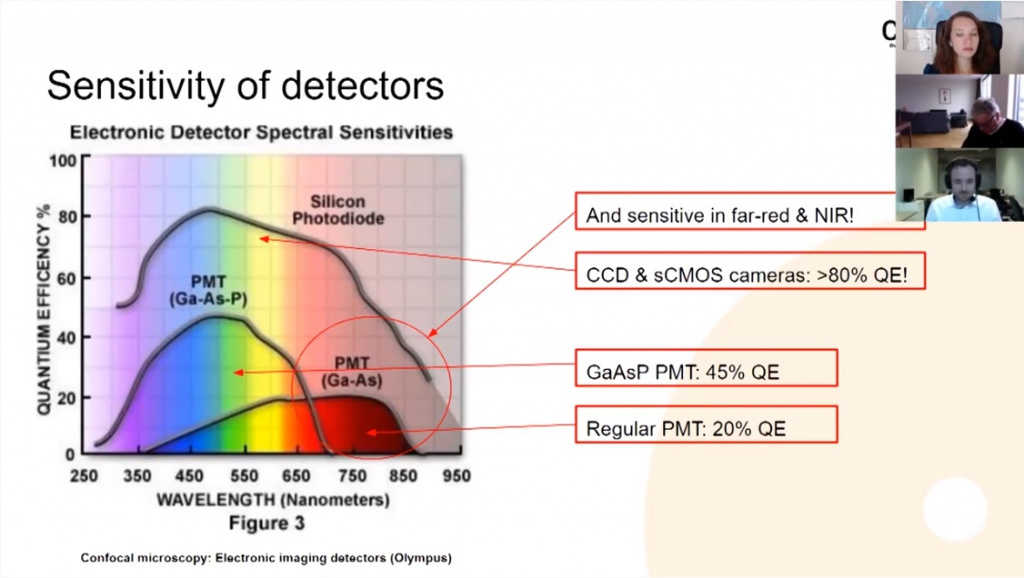
Стандартный ФЭУ имеет квантовую эффективность около 20%. Есть более чувствительные варианты ФЭУ: на основе арсенида галлия (Ga-As) имеет эффективность около 45%. Но ничто не сравнится с CCD- (ПЗС, прибор с зарядовой связью) или sCMOS (scientific Complementary metal-oxide-semiconductor) –камерами. Их квантовая эффективность превосходит 80%. Камера, кроме того, гораздо чувствительнее в области дальнего красного и инфракрасного света.
Почему бы в конфокальных микроскопах не применить для детекции камеры? Это было научное изобретение, о котором рассказывал Питер. Джулия Де Лука заменила ФЭУ камерой, на слайде ссылка на ее публикацию. Перед камерой находится ресканирующее зеркало, которое проецирует на камеру излученный свет из пинхола.
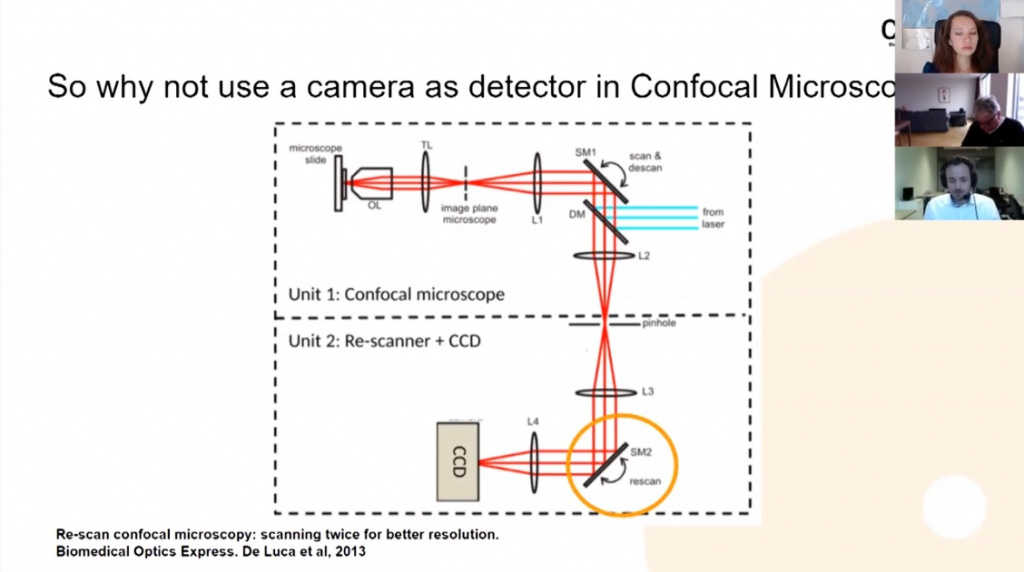
Таким образом, мы можем использовать более чувствительный механизм детекции, но, как я уже сказал, мы также можем увеличить разрешение. Тут вы видите сравнение сканирующего и ресканирующего механизмов. (00:43:25) Они оба синхронно перемещаются. Тут схематично изображены пятна света, слева — сканирующий луч лазера, справа — ресканирующий луч, излученный образцом. Пятно от сканирующего луча перемещается по образцу, а от ресканирующего — попадает на микрочип камеры. В данном случае ширина обоих лучей (пятен) одинакова, разрешение ограничено дифракцией и составляет 240 нм. Но мы можем увеличить размер светового пятна ресканера и сделать так, чтобы он перемещался по поверхности камеры быстрее. Затем, когда мы обратно уменьшим изображение оптическими методами, то разрешение повысится на 40%, до 170 нм. Вы можете посмотреть видеообъяснение по ссылке https://www.confocal.nl/explanation/.
На этом слайде указаны основные технические характеристики RCM.

Ее латеральное разрешение (в плоскости изображения) 170 нм, но может быть улучшено до 120 нм после процедуры деконволюции (обратной свертки). Аксиальное разрешение (по Z-оси) 500 нм, или 350 нм после деконволюции. Квантовая эффективность детекции, в зависимости от типа камеры — 80–95%. Скорость сканирования один кадр в секунду для изображения 512х512 пикселей. В качестве возбуждающего света можно использовать до четырех лазеров (405, 488, 561, 640 нм). Ширина пинхола оптимизирована для объективов 60-100x.
Что же можно делать с этим инструментом? Каково его значение для биологических исследований?
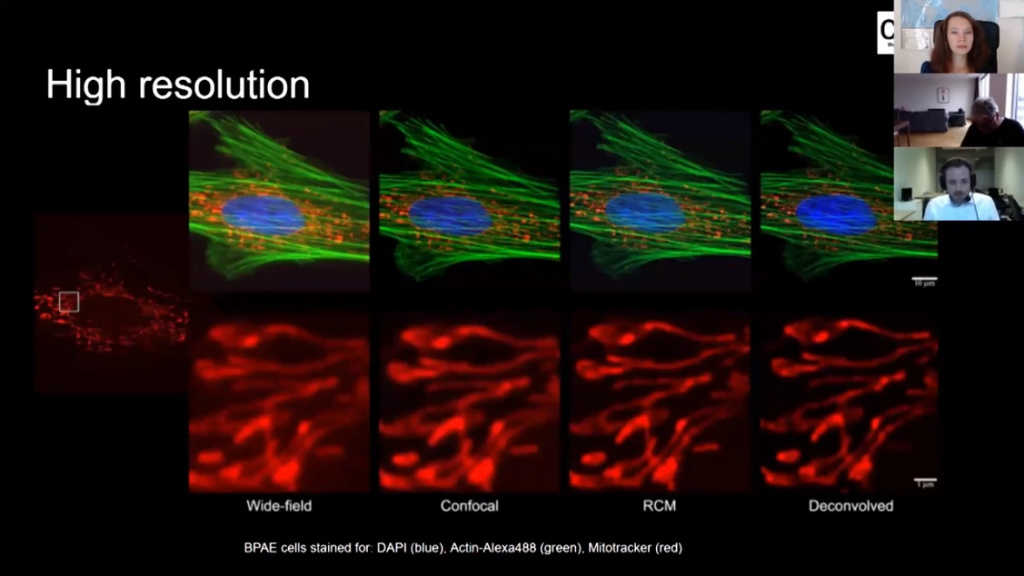
Тут вы видите изображения клеток, которые я получил на различных микроскопах. Я увеличил небольшой участок клетки. Вот изображение с широкопольного микроскопа, а вот конфокального с ФЭУ-детектором – видите, изображение четче. А вот то же, снятое на RCM. Мы можем увидеть тут больше деталей, а справа изображение еще улучшено после деконволюции.
Как я уже говорил, чувствительность очень важна. На этом изображении мы видим хромосомы, снятые на обычном конфокальном микроскопе с шириной пинхола 1 единица Эйри (Airy unit). На следующем рисунке я увеличил разрешение, уменьшив ширину пинхола до 0.3 единиц Эйри, но это стоило мне потери 95% излученного света. То есть уменьшение ширины пинхола улучшает разрешение, но вы отбрасываете большую долю излученного света. RCM не требует изменения ширины пинхола для улучшения разрешения, и как мы видим на следующем изображении, на нем гораздо выше контраст.
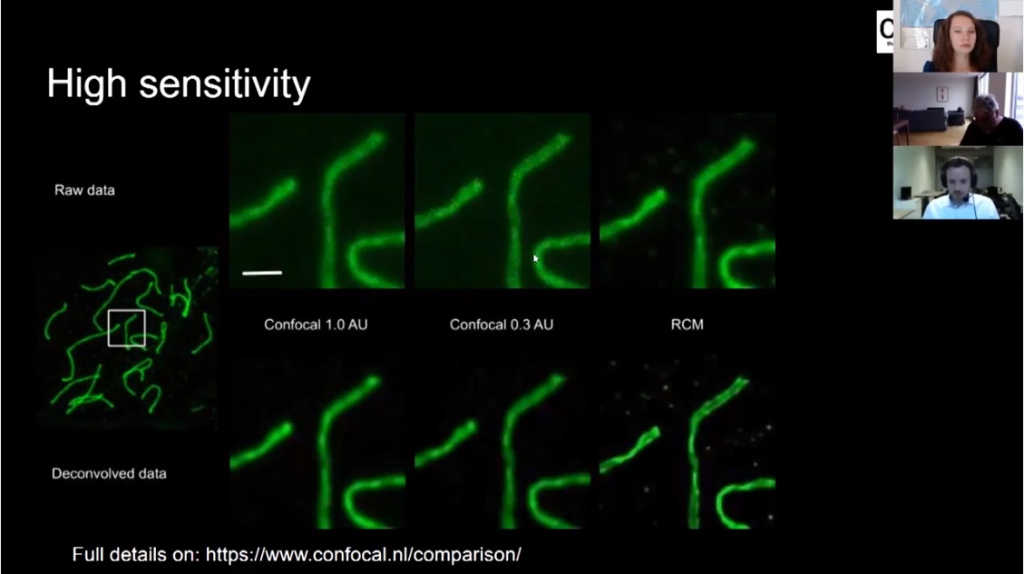
После деконволюции всех трех изображений мы видим, что различия уже значительные: даже деконволюция изображения с пинхола 0.3 не дает такой четкости, как RCM, так как изображение с RCM микроскопа имеет гораздо более высокое соотношение сигнал/шум.
А вот отличный пример с живыми клетками (00:47:57). Их снимали в течение 61 часа по одному кадру каждые 10 с, тут около 22 000 кадров. Справа также график интенсивности свечения, видно, что она не падает, а значит, нет обесцвечивания и клетки в хорошем состоянии. Иногда интенсивность на графике слегка падает, это связано с митозом, что еще раз подтверждает, что клеткам хорошо.
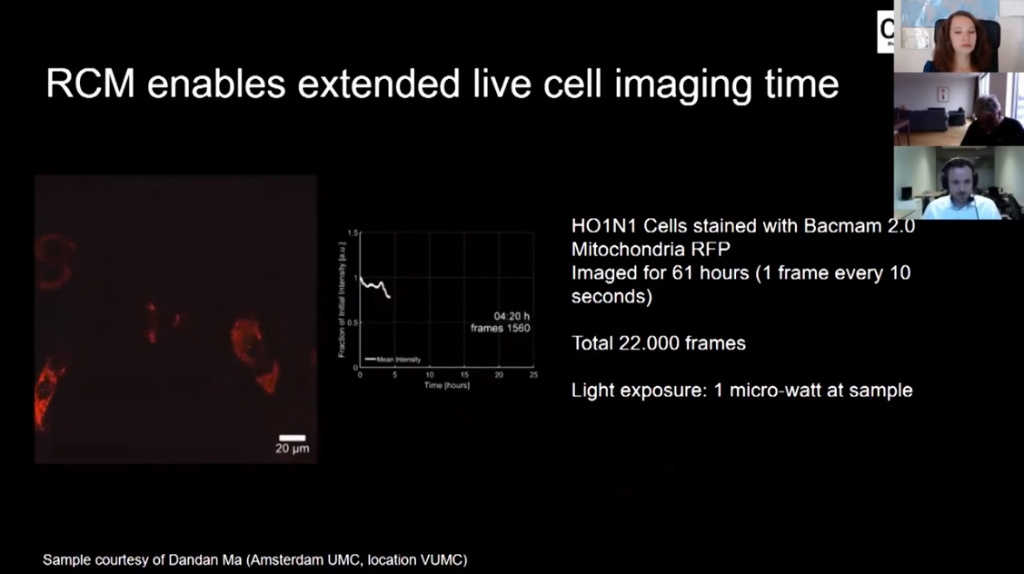
Мы измерили мощность лазера в плоскости образца в данном эксперименте, она составила 1 микроватт, а это в 20 раз ниже, чем на обычном конфокальном микроскопе. Это более щадящий режим для клеток.
Мы можем сделать деконволюцию этих изображений. Слева – необработанные данные RCM, а справа – после деконволюции, с повышением разрешения до 120 нм. (00:49:18)
Также мы можем снимать многоцветные изображения (00:49:29). Это клетки HUVEC, зеленым светится актин, красным — митохондрии, пурпурным — ядро.
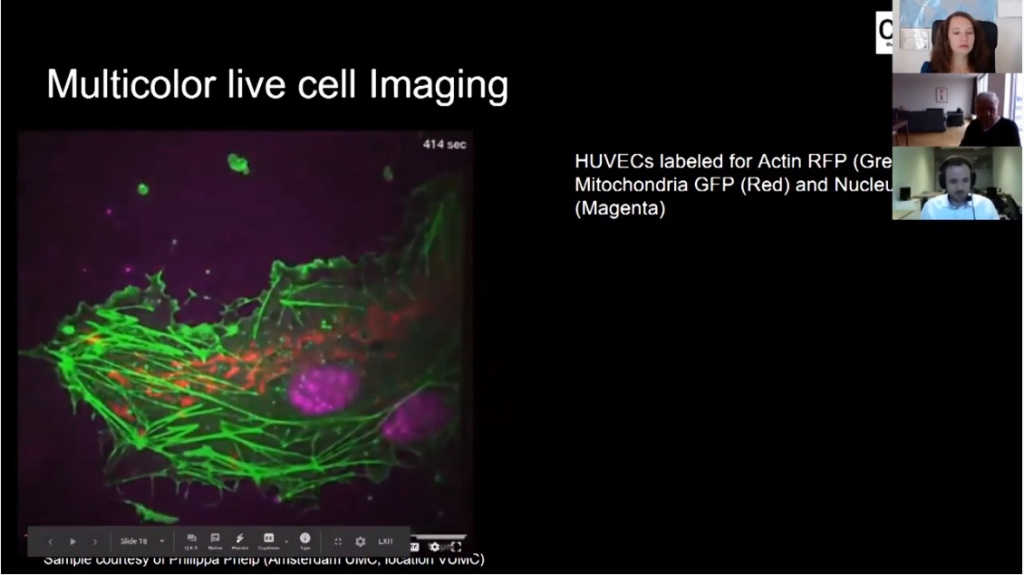
Хочу подчеркнуть, что мы видим актин в движущейся клетке, что не так легко увидеть на других типах микроскопов, потому что это очень чувствительные структуры.
Вот еще отличный пример нейронов, с окрашенными зеленым митохондриями, красным – границы клеток, розовым — ядро (00:50:09).
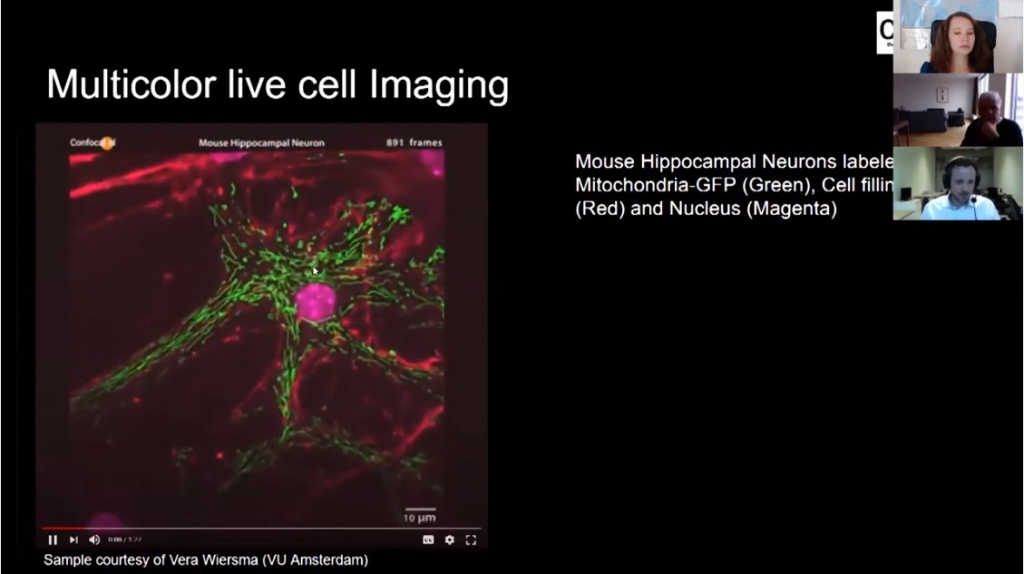
Вы можете посмотреть эти видео в высоком разрешении на https://www.confocal.nl/timelapse/.
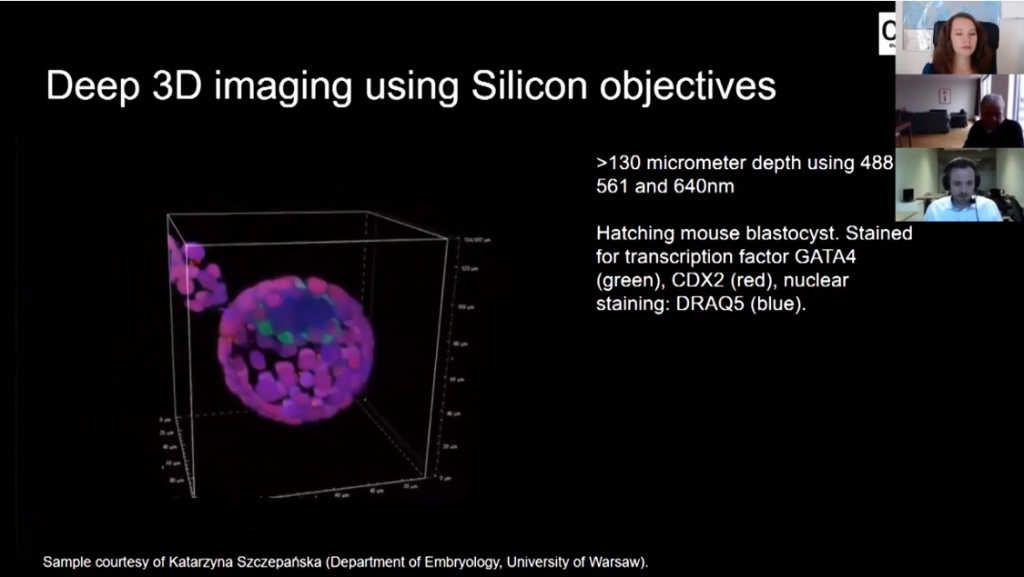
С помощью RCM можно получать очень глубокие изображения, тут мы видим бластоцисту мыши перед имплантацией (00:50:35). Она снята на кремниевый объектив 25х. Глубина этого изображения 130 микрон, мы легко можем просмотреть это 3D изображение целиком, насквозь. Мы можем снимать и более глубокие изображения.
Так как технология работает на основе камеры, мы легко можем переключаться между различными режимами. Так что можно использовать широкопольный микроскоп одновременно с RCM: находить изображение и фокусироваться на широкопольном в режиме Bypass, а затем переключаться на более высокое разрешение.
Что касается «железа» (аппаратуры), то наши системы очень гибкие, могут использоваться на разных микроскопах, с различными камерами и лазерами, то есть работать с уже существующими компонентами. Мы также предлагаем несколько вариантов программного обеспечения. Это NIS Elements, которое я вам покажу позже (ПО от Nikon). Кроме того, мы предлагаем μManager – это бесплатное ПО, которое может управлять любыми микроскопами (Leica, Zeiss, Nikon, Olympus). Volosoty тоже может использоваться с разными микроскопами. Также у нас есть несколько инструментов для обработки изображений, в том числе деконволюции — svi Huygens, Microvolution.
Вот примеры сборки RCM инструментов (01:05:57). Это на микроскопе Leica, это на Zeiss в университете Джона Хопкинса в Балтиморе. Это Nikon Ti2 наших клиентов из Швейцарии, слева у него подключена RCM система, а справа 3D STORM адаптер, они комбинируют их, поскольку RCM позволяет получать изображения быстрее. Это Olympus, и тут мы видим то, что сейчас активно продвигаем, а именно полную комплектацию: систему RCM, микроскоп, линзы объектива, инкубатор для клеток, камеру, источник лазерного излучения TOPTICA. Это мы сейчас продаем полным комплектом, что более подробно описано на нашем вебсайте.
Мы также можем модернизировать и прямые (не инвертированные) микроскопы, поднимая RCM систему на уровень резьбы объектива C-Mount.
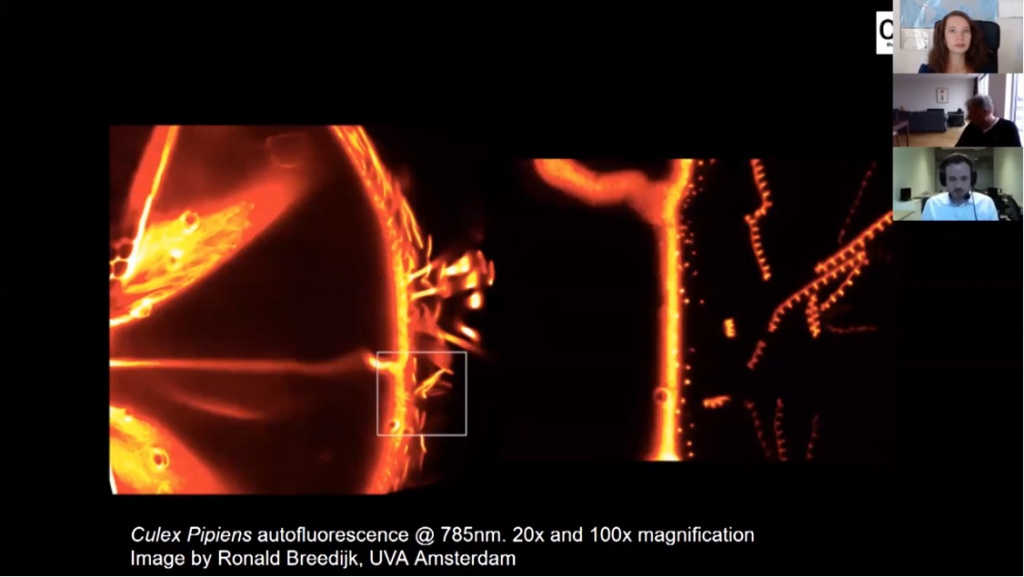
Как мы говорили раньше, у нас много продуктов в ближнем ИК свете (RCM NIR — Near Infrared). Они используют два лазера: 640 и 785 нм. С использованием этих лазеров мы можем проникать глубже в ткани, как уже говорили, на глубину более 1 мм, мы пока не знаем, каково ограничение проникающей способности, может быть, 5 мм, а может, даже глубже. Тут пример изображения высокого разрешения на увеличениях 20х и 100х.
Подводя итог: RCM очень чувствительная технология, позволяет получать сверхразрешение оптически. В отличие от других систем с сверхвысоким разрешением, она легка в использовании и доступна по цене. Больше информации можно найти на www.confocal.nl или написав мне по электронной почте jeroen@confocal.nl.
А теперь давайте перейдем к живой демонстрации. (00:55:22). Я буду показывать на экране ПО NIS Elements, здесь вы видите два режима: режим Bypass позволяет сфокусироваться на объекте, я это сперва и сделаю, а затем мы переключимся в режим высокого разрешения RCM. Мы будем смотреть препарат хромосом, который я уже показывал в презентации. Вот эти хромосомы в широкопольном режиме. Я сохранил это изображение, давайте на него посмотрим. Когда я увеличиваю изображение, вы видите общую структуру хромосом, но не видите двух отдельных хроматид. Структура хромосомы — это две параллельные линии, соединенные друг с другом. Очевидно, нужно большее разрешение, чтобы оценить реальную структуру этих хромосом.
Я переключаюсь в режим RCM. В программе открывается панель, где можно выбрать размер поля зрения в пикселях. Мы можем сканировать 512 пикселей за 1 секунду, 1024 пикселя за 2 секунды, 2048 пикселей за 4 секунды. Можете подстроить площадь поля зрения в зависимости от того, какая вам нужна скорость сканирования. После выбора поля зрения я выбираю мощность лазеров, я заранее ее подобрал, затем я нажимаю кнопку Snap и делаю снимок в высоком разрешении. Если я теперь увеличу изображение, то тут видно больше структур, и особенно если я сделаю это изображение в виде 3D стопки снимков и сделаю деконволюцию, мы сможем лучше увидеть структуры, и это то, что я сейчас сделаю. Я сниму небольшой Z стэк глубиной 2 мкм, сейчас вы видите, как RCM его снимает послойно. Теперь видно, что хромосомы состоят из двух хроматид. Помните, что это еще сырое изображение, с разрешением 170 нм. Следующим шагом сделаем деконволюцию. Делаем 3D деконволюцию, этот модуль встроен в программу NIS Elements. Я должен только вписать длины волн возбуждающего и испускаемого света. Через несколько секунд получаем деконволированное изображение. Теперь видим четкое изображение. Мы ясно видим структуры, можем померить профиль светимости по ширине хромосомы и убедиться, что расстояние между двумя светящимися точками менее 170 нм. Если вернуться к первому изображению с широкопольного режима съемки, то тут мы не расшифровали структуры, а при использовании RCM и деконволюции мы видим гораздо более контрастное изображение с более высоким разрешением.
Это была демонстрация возможностей разрешения RCM. У меня еще есть более простой образец, но трехцветный (01:01:44). Это эндотелиальные клетки, покрашенные синим DAPI, актин зеленым и митохондрии красным. Вначале фокусируюсь на образце в широкопольном режиме Bypass, ставлю интересующую клетку в центр поля зрения, затем снова переключаюсь в конфокальный режим, выбираю размер поля для съемки и мощность лазера, делаю снимок. Вот моя клетка, она зеленая, но это псевдоцвет (на самом деле это красные митохондрии). Сейчас я могу сделать многоцветный снимок, выбрав соответствующий режим и нужные лазеры. Выбираю псевдоцвета, теперь снимаем актин, митохондрии, ядро. Выглядит пересвеченным, но это нестрашно, можно поиграть кривыми цветокоррекции. Это еще одно преимущество камеры — нет риска пересветить изображение.
Вот то, что я хотел показать, спасибо.
А.Б. Благодарю вас! Конечно, разница в изображениях очевидна.
Ерун Кол. Да, это именно то, что я предполагал до вас донести.
Перевод: Евгения Пуховая


 Меню
Меню





 Все темы
Все темы




 0
0