Циркулирующие онкомаркеры в молекулярной онкодиагностике
Детекция циркулирующей опухолевой ДНК с помощью жидкостной биопсии — перспективный малоинвазивный метод диагностики онкологических заболеваний. Он может применяться для подбора терапии, мониторинга рецидивов и остаточной болезни. Какие новые решения в области анализа циркулирующих онкомаркеров скоро войдут в клиническую практику и как этот метод может улучшить раннюю диагностику опухолей, обсуждалось на вебинаре PCR.NEWS.
Двадцать шестого марта на платформе PCR.NEWS прошел вебинар «Циркулирующие онкомаркеры: молекулярная диагностика в онкологии». Специалисты обсудили преимущества применения жидкостной биопсии и анализа циркулирующей опухолевой ДНК (цоДНК), а также новые технологии, которые в будущем могут войти в клиническую практику. Они также поделились своим опытом использования циркулирующих онкомаркеров для диагностики различных типов опухолей.
Вступительное слово о жидкостной биопсии в онкологии сказал Максим Филипенко, д.б.н., заведующий лабораторией фармакогеномики ИХБФМ СО РАН (Новосибирск). Это важный неинвазивный диагностический метод, который позволяет быстро получить необходимую информацию при анализе биологических жидкостей. При этом в последнее время жидкостная биопсия все больше ассоциируется с определением циркулирующих нуклеиновых кислот, хотя и может применяться также для анализа других молекул и клеток.
«Тремя богатырями» клинического материала для жидкостной биопсии остаются плазма крови, моча и слюна, отметил докладчик. Сейчас внимание исследователей привлекает использование в качестве аналита мочи и слюны, так как их анализ совершенно неинвазивный.
Изначально при детекции внеклеточных нуклеиновых кислот с помощью жидкостной биопсии пытались определять количество общей и специфичной вкДНК, ее размер и структуру. Однако более интересный класс маркеров заболеваний — это соматические мутации (SNP, хромосомные перестройки и т. д.), эпигенетические модификации (метилирование). В качестве маркеров могут выступать и специфические РНК: мРНК, малые и некодирующие РНК, а также мутации в них. Эти маркеры уже вошли в клиническую практику.
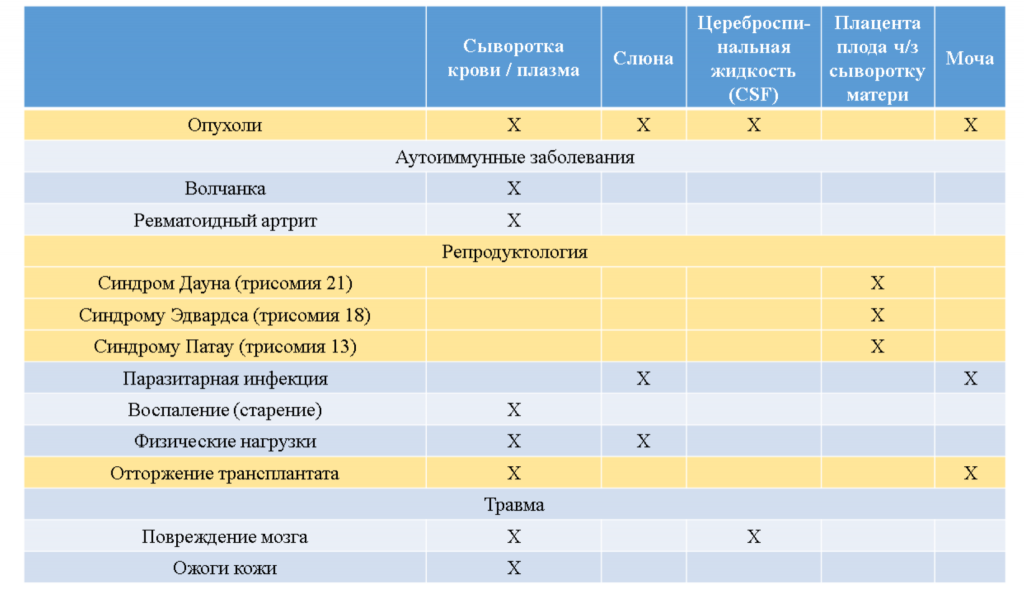
Жидкостная биопсия применяется для диагностики и других заболеваний, помимо онкологических, в том числе аутоиммунных, инфекционных и наследственных. Желтым цветом в таблице ниже выделены те области, где применение жидкостной биопсии уже одобрено регулирующими агентствами и введено в клиническую практику. Так, например, компания Illumina уже выпускает неинвазивный пренатальный тест VeriSeq NIPT Solution, при котором проводится полногеномное секвенирование вкДНК из плазмы крови матери, чтобы выявить аномалии числа хромосом у плода на ранних стадиях беременности. Компания CareDx также разработала метод AlloSure, где доля донорской вкДНК служит маркером для прогноза отторжения трансплантанта.
Большой интерес представляет анализ внеклеточной опухолевой ДНК (вкоДНК). Ее содержание обычно не превышает 0,01% от общего количества вкДНК, хотя в зависимости от размера опухоли и стадии ее развития количество вкоДНК может сильно варьировать и в некоторых случаях достигать 90%. Обычно вкоДНК представляет собой продукты апоптоза или некроза клеток. Она также может входить в состав активно или пассивно секретируемых опухолевыми клетками микровезикул. Кроме того, нейтрофилы выбрасывают ДНК-«ловушки» в ходе нетоза.
вкоДНК имеет достаточно короткий период полужизни, поэтому за счет ее анализа можно отслеживать изменения гомеостаза опухоли в динамике. Однако наиболее важный аспект анализа вкоДНК состоит в том, что в ней содержатся соматические мутации первичной опухоли и метастазов. Это как раз и позволяет отличить вкоДНК от остальной вкДНК, вместе с тем являясь и целью диагностики. Мутации, детектируемые в вкоДНК, могут иметь клиническую значимость и определять терапевтические решения. В клинике вкоДНК уже используют для поиска таргетной терапии и оценки медикаментозной резистентности опухоли. Многие исследования также посвящены анализу вкоДНК для оценки ответа на лечение, прогноза рецидивов или мониторинга «остаточной болезни». Они показывают хорошие результаты, поэтому такие подходы могут быть в скором времени введены в практику.
В области ранней детекции опухолей по вкоДНК, с которой было связано больше всего надежд, до сих пор нет значимого прогресса. Максим Леонидович тем не менее предположил, что эта область начнет развиваться по мере совершенствования эффективности «омиксных» технологий для определения и нуклеиновых кислот, и белков, а также по мере удешевления таких анализов.
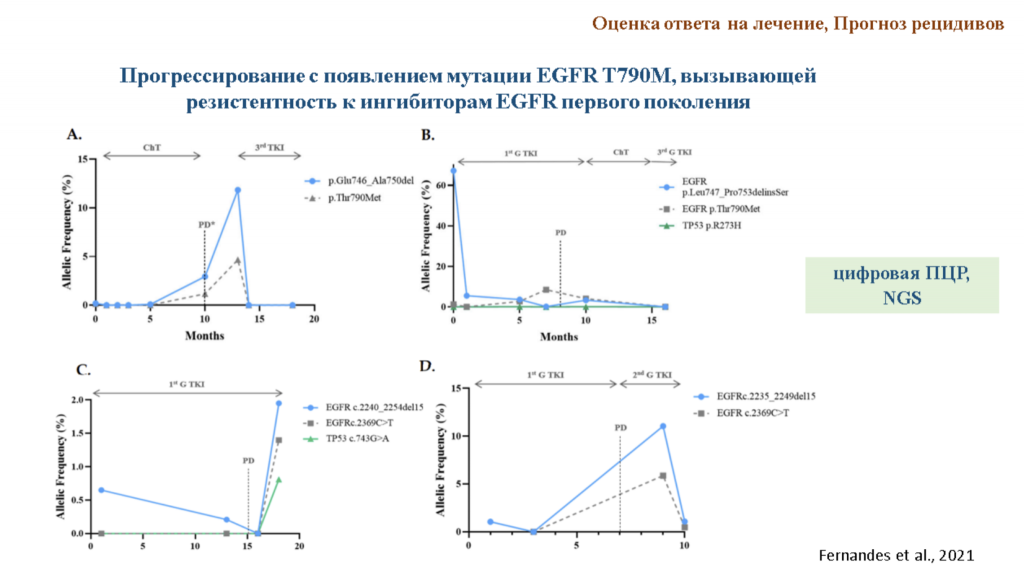
Далее Максим Леонидович рассказал о конкретных примерах применения жидкостной биопсии с анализом вкоДНК. Так, в клинике уже есть тест от Roche Molecular Diagnostics, детектирующий мутацию T790M в гене EGFR при немелкоклеточном раке легких, которая возникает в ответ на терапию. Этот тест был зарегистрирован в России в 2017 году. Также есть тесты от Qiagen и Roche Molecular Diagnostics, которые позволяют выявлять активирующие соматические мутации в гене PIK3CA при раке молочной железы. В обоих случаях тесты основаны на использовании аллель-специфичной ПЦР. Тем не менее применяется и секвенирование: недавно американская FDA одобрила новые тесты на основе NGS, которые позволяют детектировать мутации EGFR.
Максим Леонидович подробнее рассказал о том, как вцоДНК могут применяться для мониторинга резидуальной (остаточной) болезни. В этом случае нужно количественно анализировать как можно большее число опухолевых мутаций, при этом метод должен быть крайне чувствительным, чтобы была возможность детектировать даже малые количества вцоДНК на фоне вцДНК «дикого типа». В качестве примера Максим Леонидович привел исследование, в котором показали, что наличие остаточного колоректального рака можно определить, измеряя вкоДНК до операции и через некоторое время после. Позднее появились похожие исследования и для других типов рака. Подобные подходы для мониторинга остаточной болезни могут попасть в клинику при удешевлении анализов и введения автоматизации.
Для прогноза рецидивов и оценки ответа на лечение важна количественность методов. В этой области используют цифровую ПЦР и NGS. Пока что такие подходы применяются вне клинических рекомендаций, для отдельных пациентов. Их введение в клинику возможно или за счет снижения себестоимости теста, или за счет увеличения его финансирования. Отдельная трудность — в том, что за пациентом нужно вести постоянное, длительное наблюдение.
Максим Леонидович отдельно упомянул РНК-маркеры, которым до последнего времени уделялось сравнительно мало внимания. Так, по вкРНК можно детектировать химерные транскрипты гена ALK при раке легкого.
Внедрение жидкостной биопсии в клинику сопряжено с трудностями и ограничениями. Они возникают уже на преаналитической фазе исследования, когда определяется тип клинического образца, способ его получения и т. д. Эта часть важна и в клинике, и в исследованиях, когда образцы включают в различные биобанки. Если преаналитическая фаза выполнена некорректно, то и последующий анализ не позволит сделать правильные выводы. На уровень вкДНК влияют индивидуальные различия между пациентами: возраст, пол, вес, уровень физической активности, питание, инфекции и многие другие факторы. Однако не так много исследований, которые позволяют достоверно определить влияние подобных факторов на вкДНК и тем более — на вкоДНК.
Тем не менее такие работы все же есть. Например, показано, что уровень вкоДНК может повышаться в ответ на лучевую или химиотерапию. Что интересно, пик высвобождения вкоДНК достигается только через несколько суток после применения терапии.
При отборе проб важно иметь в виду, что вкДНК может генерироваться при апоптозе или физическом разрушении нормальных клеток крови. Клетки также могут вырабатывать нуклеазы и протеазы, которые деградируют вкДНК и ее комплексы с нуклеосомами. Для решения этих проблем разрабатываются специальные пробирки, которые позволяют хранить образцы без их деградации даже при комнатной температуре. Такие разработки есть в том числе у российских производителей: например, у GradBioMed.
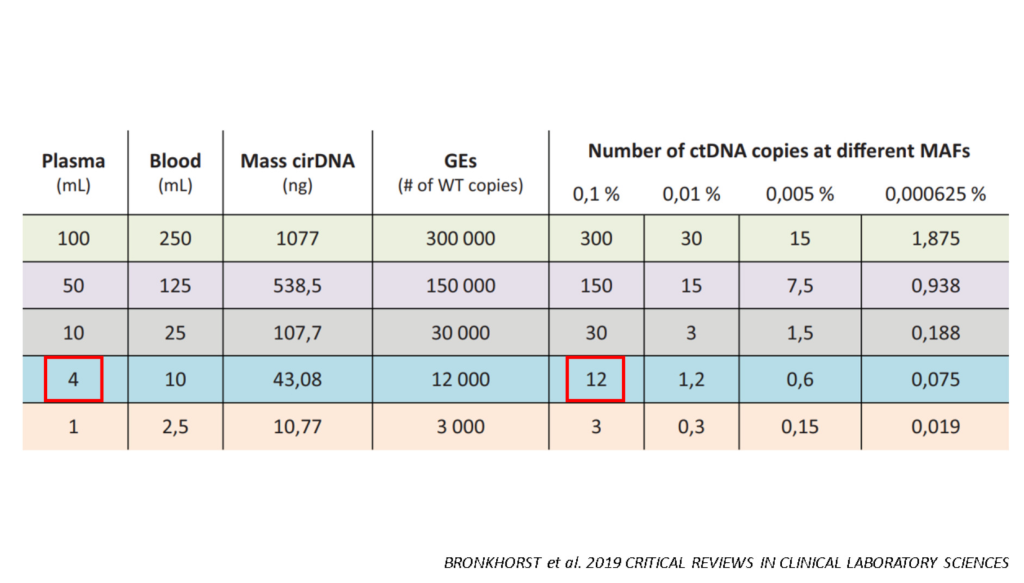
Анализ вкоДНК в крови затруднен еще и из-за того, что ее мало в отбираемых образцах. Особенно это проблематично на ранних стадиях заболевания, когда фракция вкоДНК может составлять меньше 0,1%. Максим Леонидович поделился расчетами, которые показали, что даже при отборе 10 мл крови у пациента в образце будет содержаться максимум 12 копий вкоДНК. Для анализа такого количества может быть недостаточно: оно близко к пределу аналитической чувствительности многих методов.
Докладчик подчеркнул необходимость разработки методических рекомендаций для анализа вкоДНК и вкоРНК с помощью жидкостной биопсии. Стандартизацией уже занимается консорциум BloodPAC, который выявил 11 преаналитических параметров, которые необходимо указывать при публикации исследований. Это важно как для исследователей и разработчиков методов жидкостной биопсии, так и для тех, кто работает в клинике. Летом команда Максима Филипенко планирует также выпустить консенсусное мнение по жидкостной биопсии в онкологических молекулярно-генетических исследованиях.
Далее с докладом «Диагностика диффузных глиом ствола головного мозга на основании исследования свободно циркулирующей опухолевой ДНК» выступил Александр Друй, заведующий лабораторией молекулярной онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
В начале доклада был представлен клинический случай: у девочки 14 лет случайно выявили диффузную опухоль правого таламуса, которая была на ранней стадии развития, имела невысокий темп роста и не доставляла пациентке никаких неудобств. Опухоль нельзя было четко охарактеризовать как глиому низкой или высокой степени злокачественности. Тем не менее диагноз нужно было верифицировать, но биопсия опухоли такой локализации — очень инвазивная процедура. Жидкостная биопсия спинномозговой жидкости (СМЖ) помогла выявить мутацию K27M в гене гистона H3, H3F3A, что позволило поставить диагноз — диффузная срединная глиома правого таламуса. Хотя прогноз для таких опухолей неблагоприятный, с помощью жидкостной биопсии врачи смогли поставить диагноз минимально инвазивно, после чего предоставили лечение — лучевую терапию.
Диагностика методом жидкостной биопсии может быть показана при анатомически сложной локализации опухоли, когда стандартная биопсия невозможна либо травматична. Также этот метод может применяться при наличии рекуррентного молекулярного маркера, при высокой частоте внутриопухолевой гетерогенности или при высокой агрессивности опухоли, которая вырабатывает значительные количества цоДНК. По мнению докладчика, диффузная глиома, в частности срединная, — идеальный пример опухоли, которая должна диагностироваться методом жидкостной биопсии. У нее есть рекуррентный молекулярный маркер — мутация K28M (K27M) в гистоне H3, ее локализация затруднена для хирургического вмешательства, и опухоль отличается высокой агрессивностью. Литература показывает, что для диффузной срединной глиомы предиктивным маркером может быть та же мутация K27M. Его использование позволило продвинуться в терапии этой опухоли, так как до сих пор она оставалась практически летальной.
Детские опухоли вырабатывают меньше цоДНК по сравнению с опухолями взрослых. Кроме того, до определенной стадии развития глиомы гематоэнцефалический барьер остается интактным, что затрудняет проникновение циркулирующих нуклеиновых кислот в кровь. Из-за этого для жидкостной биопсии лучше использовать вентрикулярный ликвор, который получают из вентрикулоперитонеального шунта. Такой шунт устанавливают многим пациентам с интракраниальными опухолями, поэтому СМЖ оказывается очень доступным материалом для жидкостной биопсии. К тому же доля цоДНК, содержащей мутантный аллель, в СМЖ на несколько порядков выше, чем в крови.
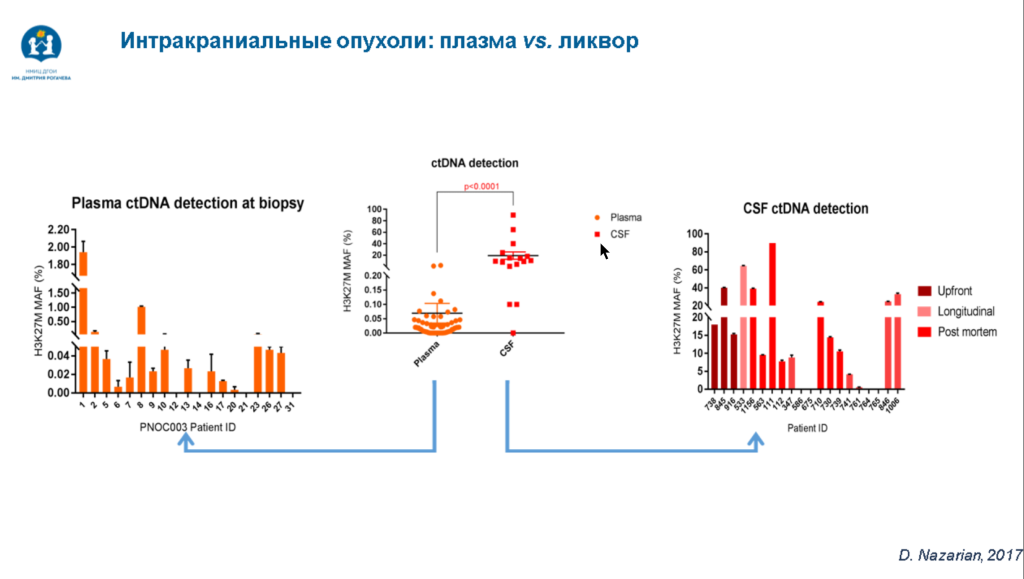
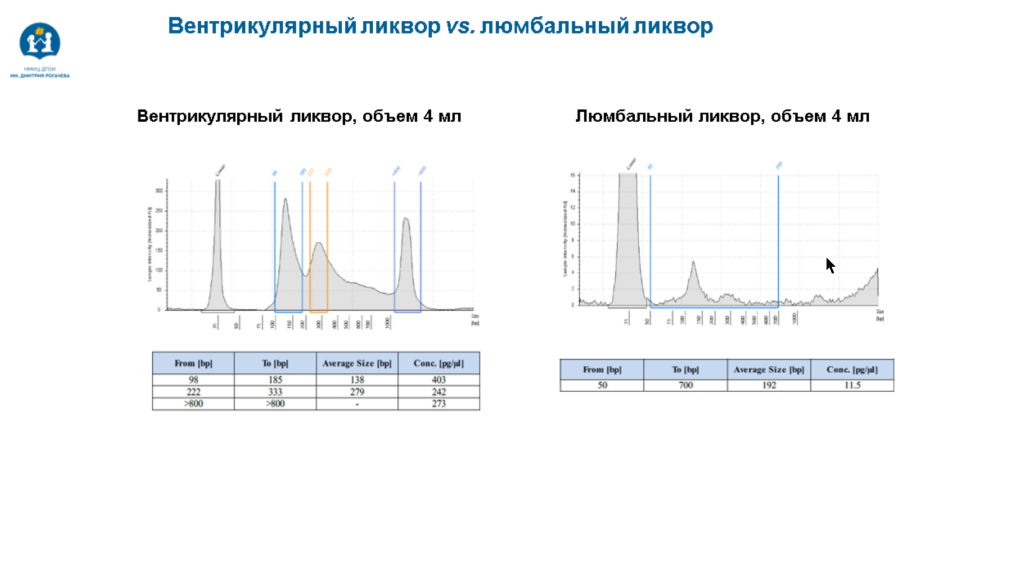
Различия есть и между СМЖ, полученной из разных участков. В вентрикулярной СМЖ, полученной из шунта, установленного в желудочки мозга, содержится гораздо больше цоДНК, чем в люмбальной, которую получают с помощью люмбальной пункции. Это связано с продукцией и резорбцией СМЖ сосудистым сплетением головного мозга.
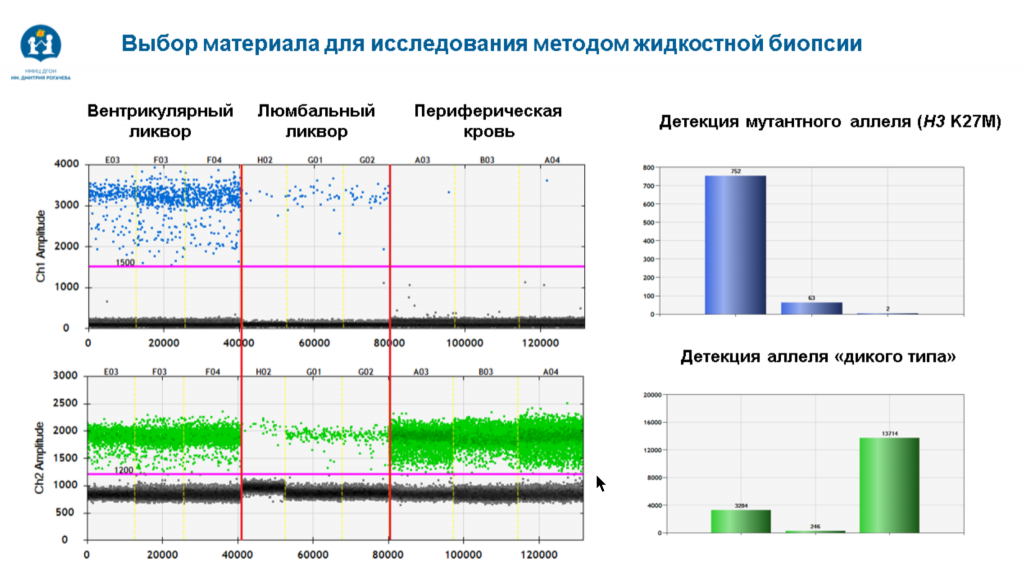
Выбор материала для исследования методом жидкостной биопсии связан не только с общим количеством вцоДНК в нем, но и с эффективностью детекции мутантного аллеля. В вентрикулярной СМЖ удается детектировать как мутантный аллель, так и аллель «дикого типа», в то время как в крови хорошо детектируется аллель «дикого типа», но не мутантный.
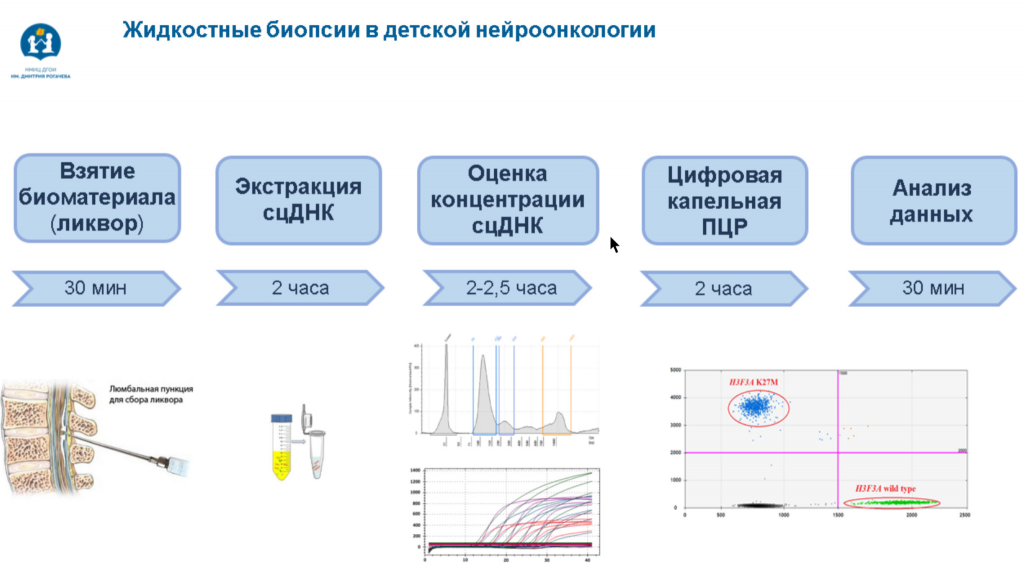
Основное требование, которое предъявляется к методам детекции мутаций в цоДНК, — это высокая аналитическая чувствительность. Используются главным образом цифровая ПЦР либо таргетное NGS с довольно большим покрытием. Команда Александра Друя в своем исследовании применяет цифровую ПЦР, так как их задача — детекция конкретной мутации. Этот метод обладает высокой точностью, чувствительностью и воспроизводимостью, причем воспроизводимость выше, чем у NGS.
На первом этапе исследования специалисты анализировали ткань опухоли у ретроспективной когорты, для которых молекулярный тип опухоли уже был известен. Далее отработка метода детекции цоДНК производилась на материале от таких пациентов. На выявление нормального и мутантного аллелей H3 влияло количество вносимой ДНК, а оптимизация протокола цифровой ПЦР помогла получать однозначные результаты. Предел аналитической чувствительности метода составил 9 пг.
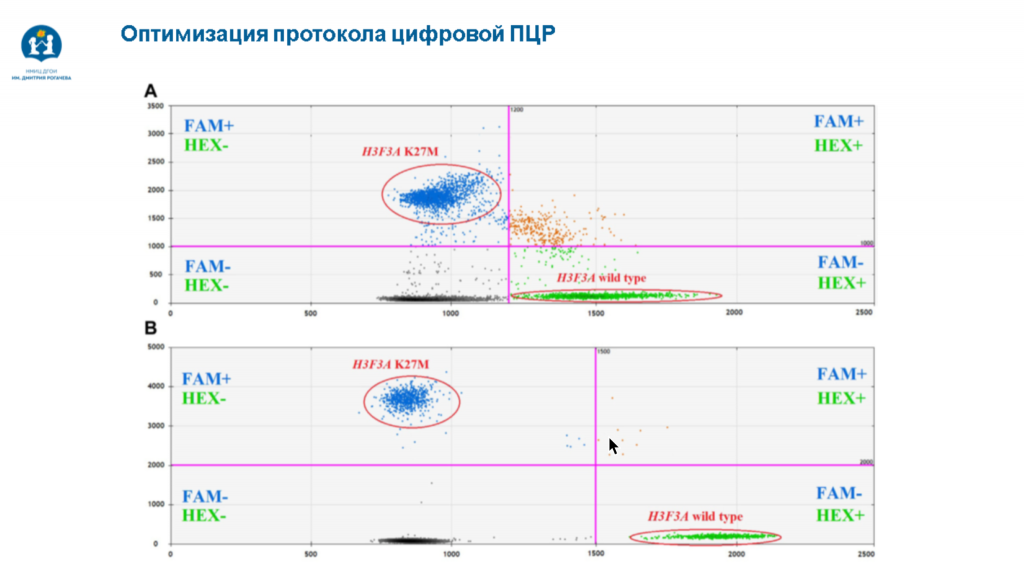
В проспективную когорту вошли пациенты с охарактеризованными опухолями, у которых анализировали не только ткань опухоли, но и СМЖ. Исследователи смогли получить сопоставимые данные на двух платформах для проведения цифровой ПЦР — Bio-Rad QX200 и Qiagen QIAcuity. Это позволило заключить, что оптимизированный в ходе исследования протокол детекции цоДНК методом цифровой ПЦР универсален. Кроме того, этот метод позволяет поставить гистомолекулярный диагноз диффузной срединной глиомы всего за половину рабочего дня.
Метод жидкостной биопсии полезен также при работе с глиомами низкой степени злокачественности, где молекулярным маркером является мутация V600E в гене BRAF. Хотя такие глиомы не считаются агрессивными, они могут иметь большой объем, благодаря чему генерируют большие количества цоДНК. Если локализация опухоли потенциально опасна (например, в хиазмально-селлярной области, которая может затрагивать зрительные пути), детекция мутаций в цоДНК может использоваться не только для верификации диагноза, но и для назначения таргетной терапии, которая может вводиться в неоадъювантном режиме до хирургического вмешательства.
Специалисты НМИЦ ДГОИ им. Д. Рогачева продолжают исследование по молекулярной диагностике опухолей ЦНС по цоДНК совместно с другими клиниками, в том числе с НМИЦ нейрохирургии им. Н.Н. Бурденко. Анализ цоДНК в СМЖ методом цифровой ПЦР позволяет поставить диагноз даже без гистологической верификации, если локализация опухоли затруднена.

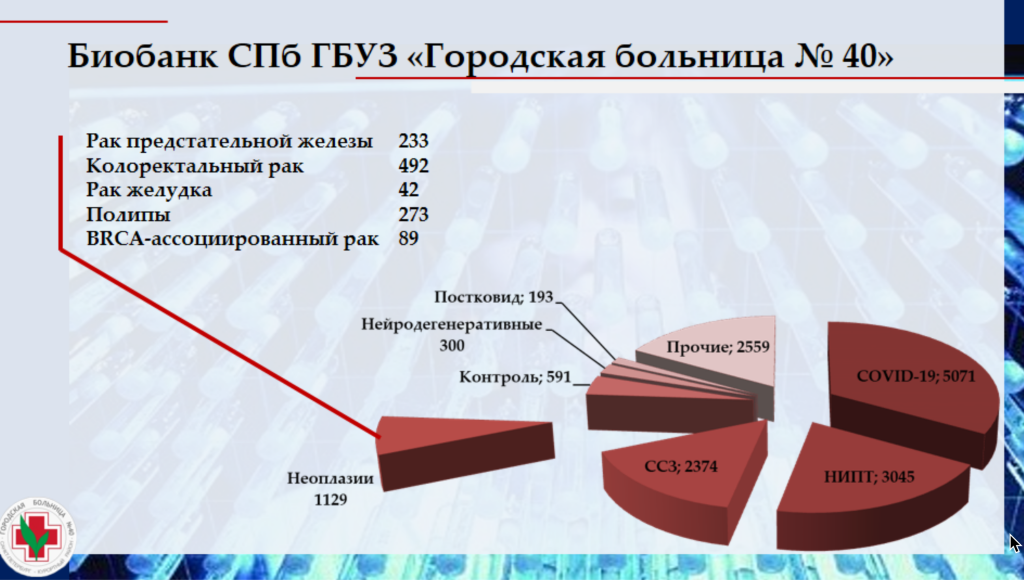
Следующий доклад — «Новые циркулирующие онкомаркеры для диагностики неоплазий ЖКТ» Светланы Апалько, начальника научно-исследовательского отдела СПб ГБУЗ «Городская больница № 40» отдела здравоохранения администрации Курортного района Санкт-Петербурга (Сестрорецк). По мнению Светланы Вячеславовны, ключевая структура для проведения трансляционных исследований — это биобанки. В СПб ГБУЗ «Городская больница № 40» хранение биоматериала организовано в криохранилище, а процессирование и аликвотирование биоматериала автоматизировано. В информационной системе хранятся все данные, касающиеся образца, в том числе количество циклов разморозки-заморозки, результаты рутинных и научных исследований, клинические данные пациента и т. д.
Несмотря на то что СПб ГБУЗ «Городская больница № 40» не имеет онкологического профиля, в ней организован полный цикл помощи для пациентов с опухолями. На разных стадиях наблюдения такие пациенты могут стать участниками проекта биобанка. Для проведения различных «омиксных» исследований у них отбираются как кровь, так и ткань опухоли. Внутренними приказами регламентирована маршрутизация биоматериала: когда, сколько и как нужно его отбирать. Так, биоматериал отбирают до резекции, а также после нее, через 5 дней и 1 месяц.
Специалисты провели исследование по использованию транскриптома крови в качестве дополнительного малоинвазивного метода для выявления и мониторинга неоплазий нижних отделов ЖКТ — колоректального рака и неоплазий. При анализе литературы были найдены 30 генов, экспрессия которых может различаться при неоплазиях ЖКТ. В основном это гены клеточного цикла, иммунного ответа, а некоторые из них также связаны с метаболизмом.
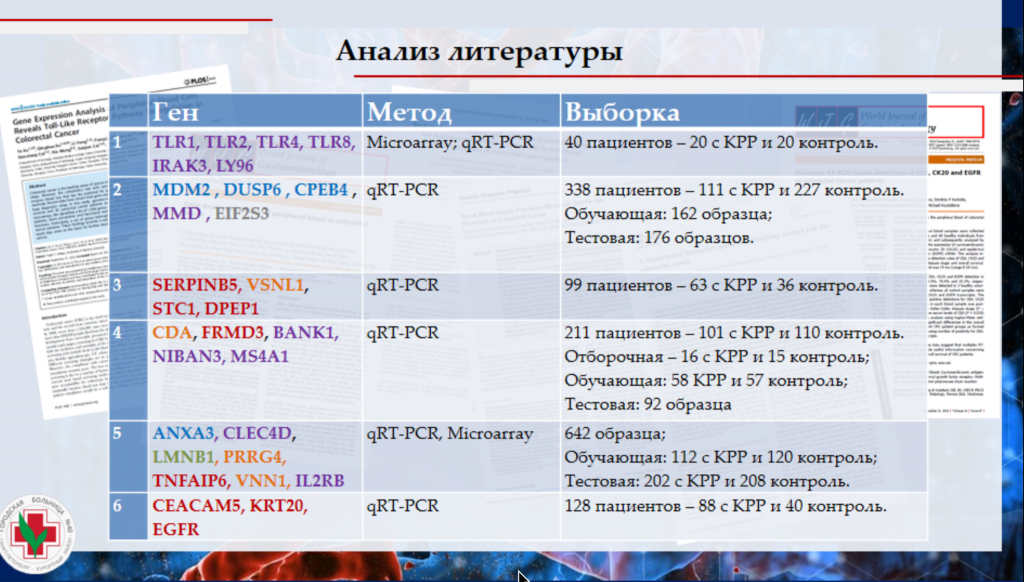
В исследовании участвовали пациенты с полипами (22 человека) и с колоректальным раком (33 человека), также имелась контрольная группа (30 человек). У пациентов отбирали кровь, выделяли из нее РНК и анализировали ее с помощью таргетной панели на все выявленные в литературе релевантные гены. Анализируемые образцы секвенировали на секвенаторе MiSeq от Illumina.
В результате исследователи получили модели на основе машинного обучения. Первая модель позволяет дифференцировать пациентов с колоректальным раком от здоровых (точность — 93,7%) по повышенной экспрессии генов FRMD3, ANXA3, DPEP1 и пониженной экспрессии генов CPEB4, MMD, TLR1. Вторая модель отличала пациентов с полипами от здоровых (точность — 84,6%) по повышенной экспрессии генов SERPINB5, CEACAM5, DPEP1 и пониженной экспрессии гена STC1. Третья модель позволяла различить пациентов с колоректальным раком и пациентов с полипами (точность — 78,3%) по повышенной экспрессии гена MMD и пониженной экспрессии гена MDM2.
Далее исследователи сделали панель для цифровой ПЦР. Ее тестировали для анализа биоматериала от группы пациентов с колоректальным раком (44 человека). Биоматериал получали до резекции, через 5 дней и через месяц после нее. Сейчас в больнице также ведется исследование с более широкой выборкой, включающей пациентов с колоректальным раком, полипами и раком желудка. В дальнейшем исследователи планируют анализировать здоровые ткани в сравнении с опухолевыми. Они заметили, что уровень экспрессии генов в опухолевых клетках связан с экспрессией тех же генов в лейкоцитах. Теперь исследователи собираются выяснить причины этого явления, а также определить, можно ли в таком случае диагностировать неоплазии нижних отделов ЖКТ только по анализу экспрессии генов в клетках лейкоцитарной фракции крови.
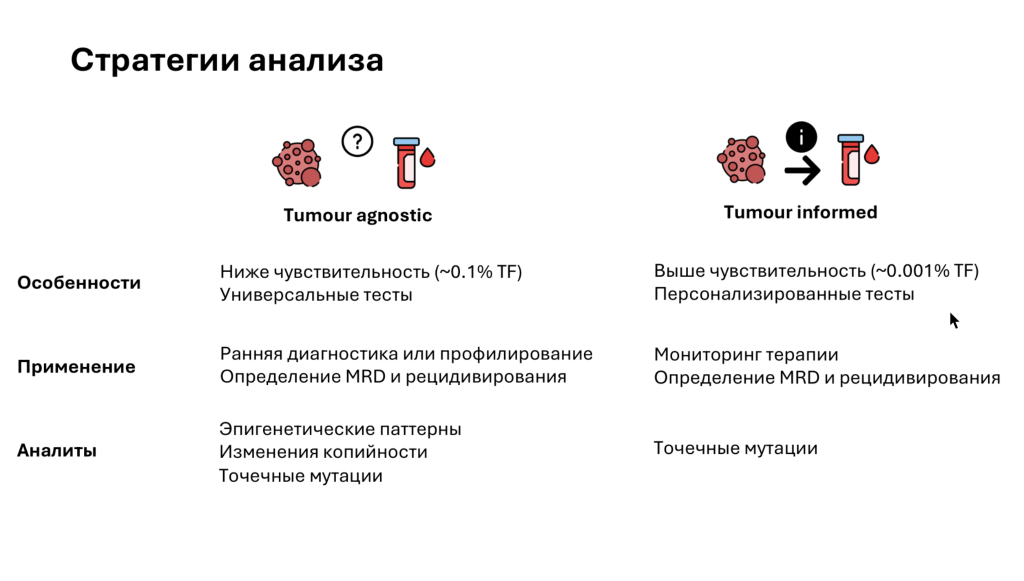
Следующим выступил Дмитрий Щербо (Кембриджский университет, РНИМУ им. Н.И.Пирогова) с докладом «Современные методы анализа циркулирующей опухолевой ДНК крови». Он разделил стратегии анализа цоДНК на две группы: агностический (tumor agnostic) и информированный (tumor informed) анализ. Первый позволяет получить информацию об опухоли по косвенным данным, а второй помогает отслеживать изменения в уже известной опухоли.
При анализе эпигенетических паттернов в цДНК основное внимание уделяется метилированию цитозинов, неравномерности фрагментирования ДНК, которая связана с особенностью упаковки хроматина, а также посттрансляционным модификациям гистонов. Проблема анализа метилированной ДНК состоит в том, что классические методы секвенирования или ПЦР не позволяют отличить модифицированные нуклеотиды от обычных. Из-за этого детекция метилированных нуклеотидов не может осуществляться напрямую. Для решения этой проблемы широко применяется бисульфитная конверсия, при которой цитозин трансформируется в тимин, благодаря чему можно установить, на каких цитозинах были модификации. Есть и другие технологии, позволяющие конвертировать именно метилированные цитозины в другие нуклеотиды, что может быть более оправданным из-за того, что модифицированных цитозинов в геноме меньше. Одна из таких технологий — окисление метилированных цитозинов ферментом TET. Кроме того, метилированные участки ДНК можно выявлять с помощью антител.
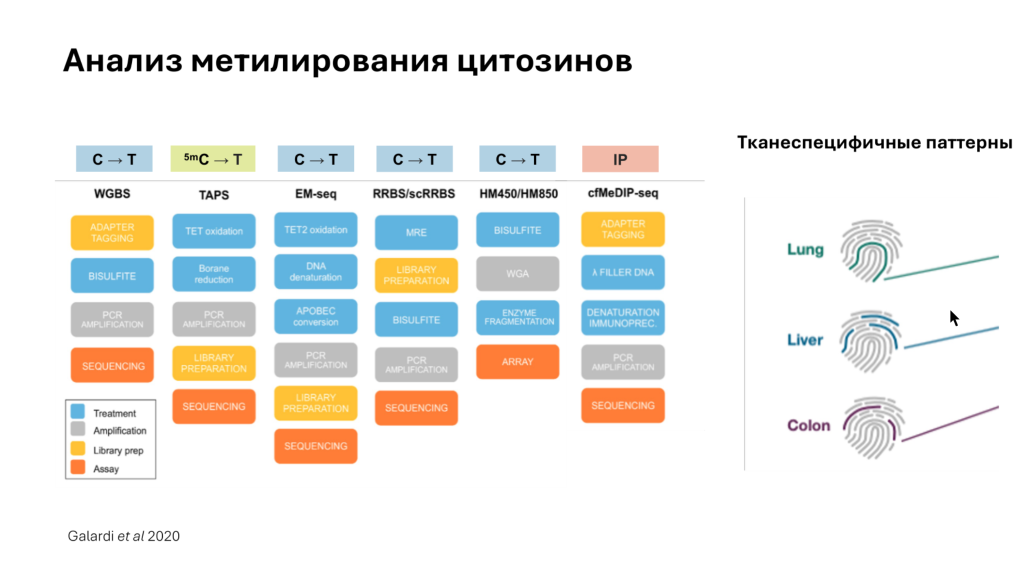
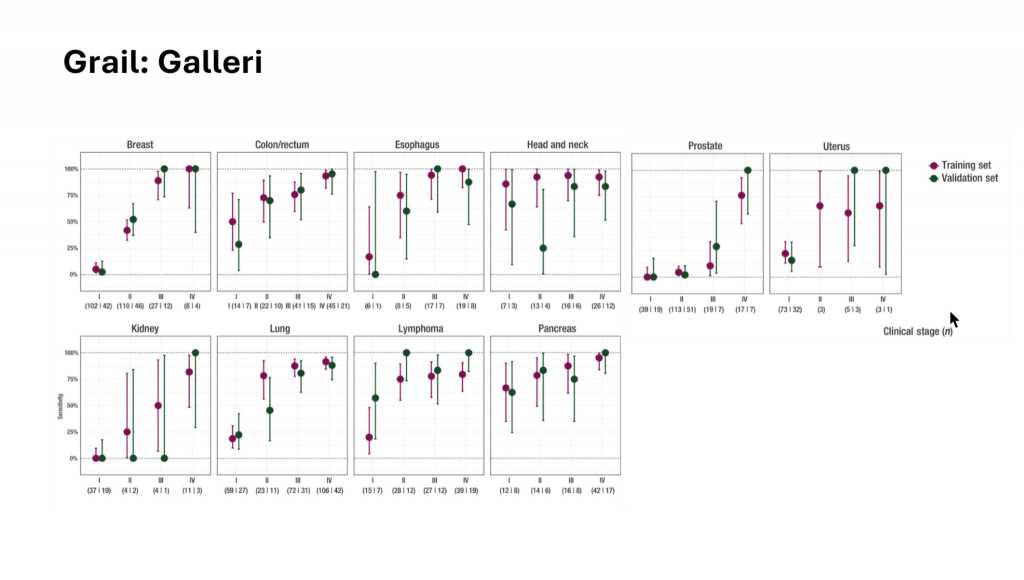
Для анализа паттернов метилирования с целью ранней диагностики большого числа опухолей используется тест Galleri. Специфичность этого теста достигает 99%, однако чувствительность при выявлении опухолей на ранних стадиях может быть низкой. Например, для рака молочной железы, простаты, почек и легкого чувствительность субоптимальна. В то же время тест успешно выявляет другие типы опухолей на ранних стадиях.
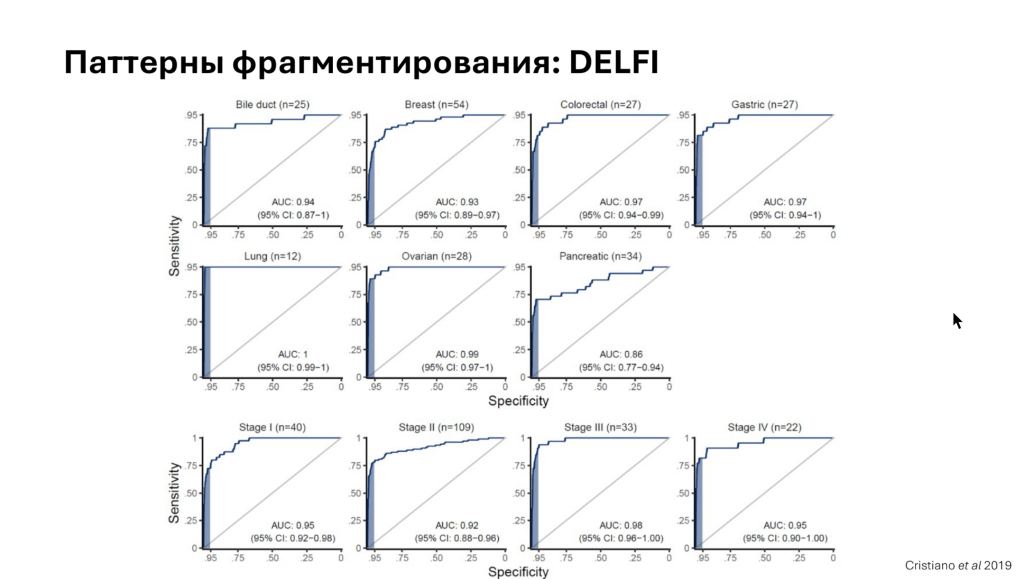
Паттерны фрагментирования ДНК анализируются с помощью алгоритма DELFI. Он основан на определении соотношения размеров фрагментов ДНК в разных регионах генома, а также на изменении копийности. Этот алгоритм позволяет отличать пациентов с раковыми опухолями от здоровых пациентов, а также от пациентов с доброкачественными новообразованиями.
Выявление точечных мутаций важно как для агностического, так и для информированного подхода к анализу данных. Детекция точечных мутаций проще по сравнению с выявлением эпигенетических паттернов, особенно при использовании глубокого секвенирования и таргетного обогащения. Предел стабильной детекции точечных мутаций — 0,5%.
Улучшить детекцию можно за счет двух подходов. Во-первых, при глубоком секвенировании можно применять уникальные молекулярные баркоды, чтобы помечать ими каждую уникальную молекулу. За счет этого можно будет скорректировать накопленные ошибки: истинные мутации будут сохраняться во всех молекулах с одним баркодом, а случайные ошибки — нет. Во-вторых, можно прибегнуть к широкому секвенированию, при котором ищется гораздо больше мутаций. Такой подход особенно удобен при tumor informed стратегии.
На широком секвенировании основан ряд персонализированных панелей, которые позволяют проводить мониторинг ответа на терапию. Так, панель Signatera использует данные экзомного секвенирования разных участков опухоли. Еще один подход — INVAR — тоже основан на широкой панели мутаций, характерных для пациента, но также использует и когортный анализ, благодаря которому можно избежать ошибок секвенирования и амплификации. При этом в когорте анализируются определенные участки генома, в которых сосредоточены мутации, а потом данные от пациента сравниваются с данными когорты. Если у пациента детектируется мутация, которая также встречалась в когорте, то она считается за истинную мутацию. Однако если у пациента обнаружена мутация, которой нет в когорте, то она принимается за ошибку секвенирования.
Дальнейший вектор развития анализа сцДНК — это мультимодальные тесты, в которых интегрируются разные данные. Это позволит увеличить точность анализа. Так, в 2018 году был предложен метод CancerSEEK, который анализирует 61 регион в 16 генах, а также восемь белковых маркеров. Интеграция геномной и протеомной информации позволяет достигнуть значимой чувствительности (выше 90% для рака яичников и печени, выше 60% — для рака желудка, поджелудочной железы, пищевода и кишечника), в том числе на ранних стадиях (выше 40%).
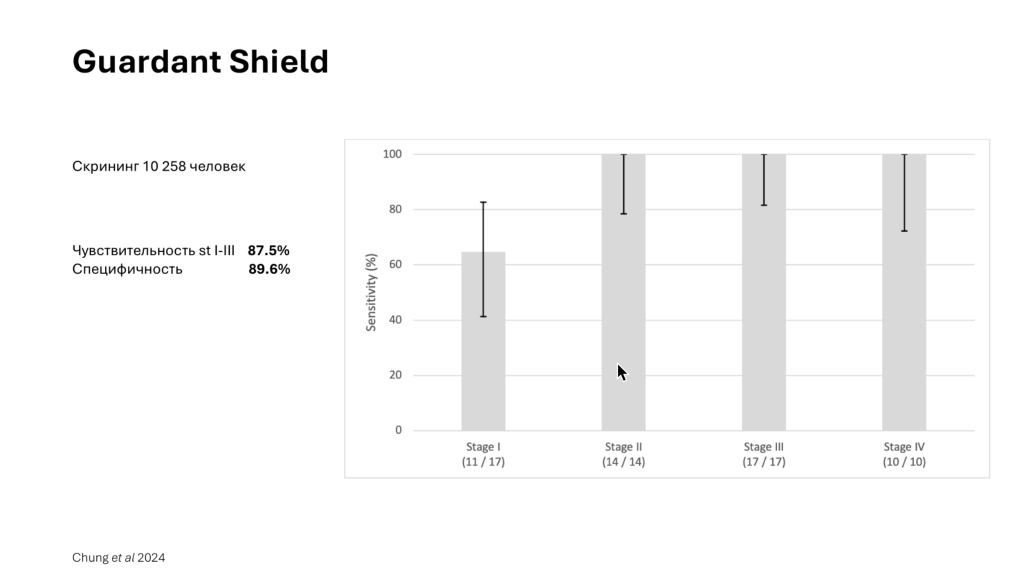
Компания Guardant выпустила тест Shield для скрининга колоректального рака в широкой популяции. В этом тесте анализируются точечные мутации, паттерны метилирования и фрагментации, а также протеомные данные об экспрессии генов. При скрининге 10 тысяч человек чувствительность этого теста на 1–3 стадиях рака составила 87,5%, а специфичность — 89,6%.
Заключительный доклад «Жидкостная биопсия с выявлением внеклеточной опухолевой ДНК в диагностике рака мочевого пузыря» представил Марк Джайн, с.н.с. отдела лабораторной диагностики Медицинского научно-образовательного центра МГУ имени М.В. Ломоносова.
Опухоли мочевого пузыря довольно гетерогенны. Наиболее распространенная среди них — уротелиальная карцинома, которая происходит из переходных клеток уротелия и встречается в 90% случаев. Более редкие опухоли — плоскоклеточная карцинома, мелкоклеточная карцинома и аденокарцинома. Именно уротелиальной карциноме был посвящен доклад.
При жидкостной биопсии рака мочевого пузыря в основном анализируется моча, а мишени могут быть разнообразными. К ним относятся вкДНК, нкРНК, экзосомы, циркулирующие опухолевые клетки, а также обученные опухолью тромбоциты. Предпочтение отводится именно опухолевым нуклеиновым кислотам, которые хорошо представлены в моче из-за непосредственного контакта опухоли с ней. В моче практически нет нуклеаз, из-за чего опухолевые нуклеиновые кислоты хорошо сохраняются в биоматериале. Это также упрощает пробоподготовку образцов.
Уротелиальная карцинома характеризуется довольно консервативным генотипом: множество распространенных мутаций, которые встречаются у большой доли пациентов, что облегчает разработку тест-систем.
Наиболее часто при анализе нуклеиновых кислот в моче выявляют точечные мутации ДНК. Для этого подхода чувствительность и специфичность близки к 100%. Также исследуются паттерны метилирования ДНК и содержание микроРНК.
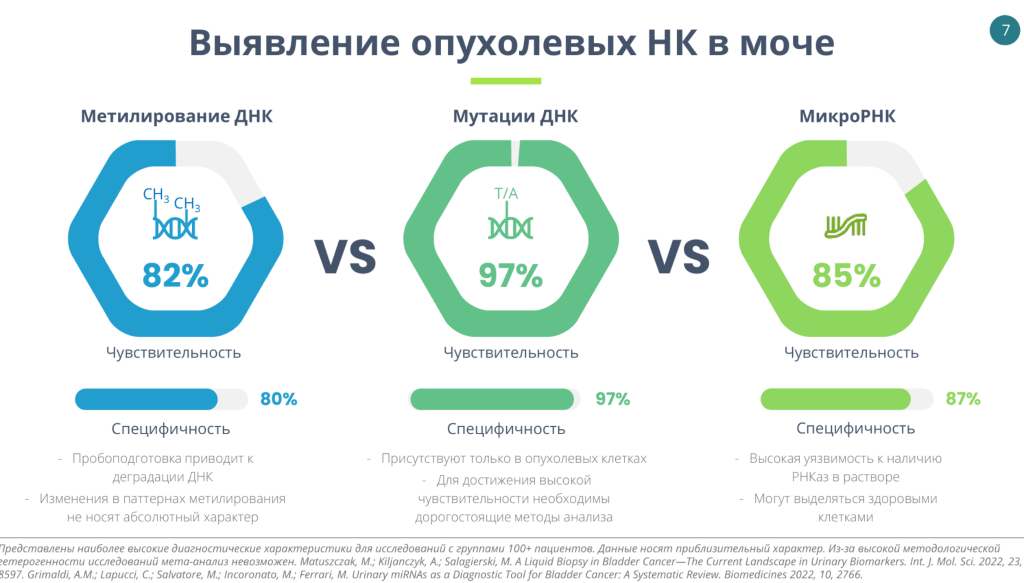
Докладчик отметил важность правильной пробоподготовки мочи. Вместе с коллегами он анализировал мочу от 19 пациентов, используя разные методы пробоподготовки. В цельной моче выход сцДНК был в десятки раз выше по сравнению с супернатантом. Кроме того, при использовании супернатанта в 4 из 19 случаев были ложноотрицательные результаты, то есть опухолевая ДНК не детектировалась. Сейчас отдел лабораторной диагностики Медицинского научно-образовательного центра МГУ проводит более крупное исследование, посвященное оценке различных подходов транспортировки, хранения и характеризации образцов мочи.
Концентрация опухолевой ДНК в моче довольно высокая — 20% от всей ДНК, 45–50 копий цоДНК на 1 мл мочи. У некоторых пациентов на последних стадиях болезни концентрация цоДНК еще выше: фракция цоДНК может достигать 60%.
Кодирующие мутации, которые встречаются в цоДНК при раке мочевого пузыря, хорошо известны, но они распространены далеко не у всех пациентов. Тяжело разработать хорошую тест-систему на основе детекции только таких мутаций. Куда более интересны некодирующие мутации, которые встречаются у большего количества пациентов. Если в тест-системах будут детектироваться такие мутации, то это позволит увеличить их чувствительность при уменьшении детектируемых мишеней.
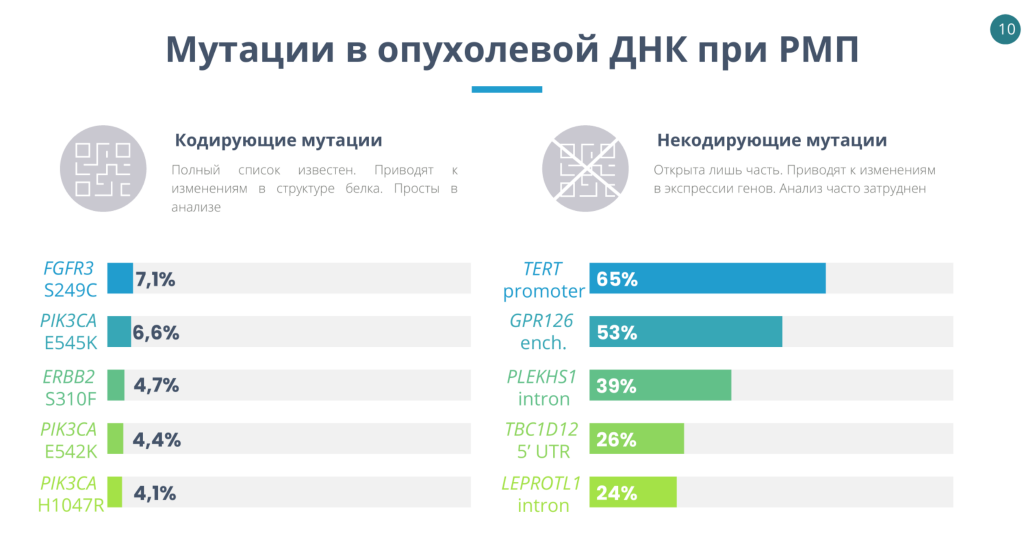
Однако детекция некодирующих мутаций может быть затруднена технически. Так, в некодирующих участках генов часто повышен GC-состав, из-за чего праймеры для ПЦР оказываются самокомплементарными. Несмотря на это, команде Марка Джайна удалось разработать систему определения мутаций в энхансере гена GPR126 в цоДНК в моче с помощью цифровой капельной ПЦР. В этом энхансере есть две мутации, которые расположены близко и могут встречаться как одновременно, так и по отдельности. При этом появление этих мутаций — раннее событие в онкогенезе: они одинаково часто встречались на разных стадиях опухоли и при разных степенях злокачественности.
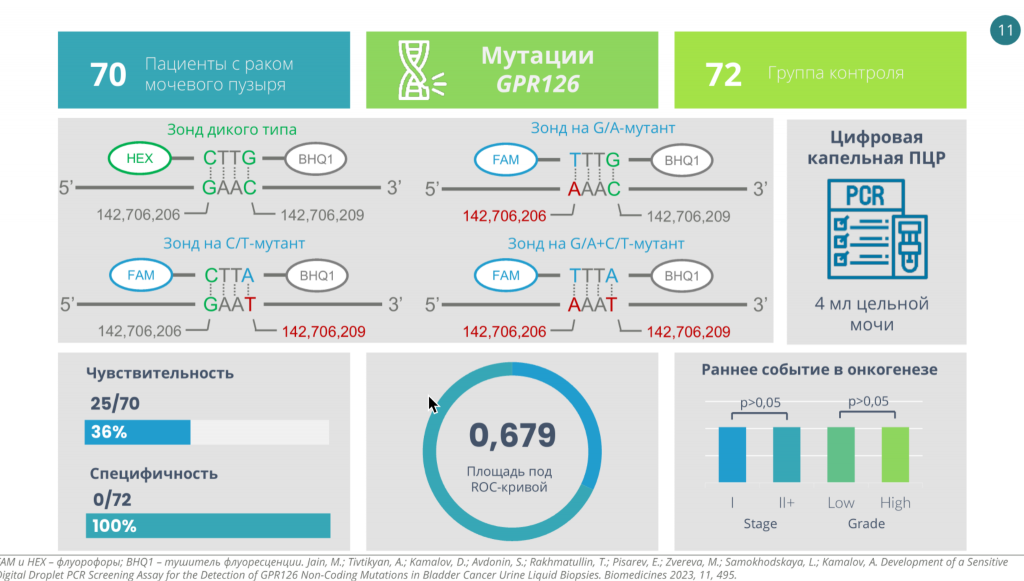
Исследователи также расширили диагностическую панель, в которой помимо двух мутаций в энхансере GPR126 детектировались две мутации в промоторе TERT, 1 мутация в FGFR3 и три мутации в PIK3CA. Чувствительность такой тест-системы достигала 80% при определении мутаций во всех четырех генах. Частота ложноположительных результатов при этом составляла 0%.
Докладчик также поделился результатами коллег из Ирана, Франции и США. В работе использовался биобанк Голестана — региона на севере Ирана, в котором содержатся данные 50 тысяч человек. Сбор мочи для биобанка осуществлялся с 2004 по 2008 гг. У 38 пациентов, данные которых были в биобанке и за которыми велось наблюдение вплоть до 2018 года, впоследствии развился рак мочевого пузыря. Ученые проанализировали мутации в промоторе TERT с помощью цифровой ПЦР и NGS, используя в качестве биоматериала мочу из биобанка. В результате цоДНК была обнаружена в моче 14 из 38 пациентов. Если бы этот анализ провели сразу после сбора мочи, то диагностировать рак мочевого пузыря можно было бы задолго до клинической манифестации заболевания, в некоторых случаях —за 10 лет.
Еще одной важной темой является гетерогенность опухоли. Гетерогенными могут быть опухоли не только у разных пациентов, но и у одного и того же человека. Марк Джайн выделил интеропухолевую, циркуляционную, эволюционную и химиотерапия-опосредованную гетерогенность. Так, при раке мочевого пузыря метастазы могут совпадать с первичной опухолью всего на 30%, то есть метастазы развиваются по-своему. Поэтому важно находить ранние события в онкогенезе, которые с большей вероятностью будут выявляться и у метастазов. Учитывать такую интрапациентную гетерогенность можно с помощью жидкостной биопсии.
Анализ цоДНК в моче также может быть использован для мониторинга рецидивов рака мочевого пузыря. Для этого после резекции опухоли нужно установить ее генотип посредством секвенирования, а после выбрать мишень для мониторинга. Этот этап должен быть персонализированным, но приоритетнее выбирать мутации, которые являются ранними событиями в онкогенезе. Уже появились исследования, показавшие, что цоДНК выявляется в моче более чем за три месяца до обнаружения рецидива традиционными методами.
Жидкостная биопсия при раке мочевого пузыря может помогать и в подборе терапии. В рандомизированном исследовании IMvigor010 оценивалась эффективность адъювантной терапии атезолимумабом — анти-PD-L1 антителом. Препарат получало 406 пациентов, а в контрольную группу входило 403 человека. Ученым не удалось выявить значимого эффекта от применения атезолимумаба. Однако дополнительное исследование цоДНК в плазме крови помогло получить более детальные данные. Пациентов разделили на две группы: на тех, у кого в плазме не было цоДНК (367 человек), и у кого она выявлялась (214 человек). Исследователи детектировали в цоДНК 16 мутаций, которые выявили в тканях, с помощью секвенирования. Как оказалось, для той группы пациентов, у которой не выявлялась цоДНК в плазме, атезолимумаб действительно был бесполезен. Однако препарат помогал тем пациентам, в плазме которых она присутствовала. Что примечательно, у этой группы пациентов был хуже прогноз.
Наконец, Марк Джайн подчеркнул, что основная трудность в использовании жидкостной биопсии — это методологическая гетерогенность исследований. Методики необходимо унифицировать, чтобы получить от подхода максимальную пользу.
В заключение Максим Леонидович Филипенко заметил, что необходимо провести клинические испытания жидкостной биопсии в молекулярно-генетических исследованиях в онкологии. Это позволит сделать вывод о том, насколько этот метод полезен и может ли он существенно улучшить лечение пациентов.
Информация о докладчиках
Максим Леонидович Филипенко, д.б.н., заведующий лабораторией фармакогеномики Института химической биологии и фундаментальной медицины СО РАН (Новосибирск)
Александр Евгеньевич Друй, к.м.н., заведующий лабораторией молекулярной онкологии ФГБУ «НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Светлана Вячеславовна Апалько, к.б.н., начальник научно-исследовательского отдела ГБУЗ «Городская больница № 40» отдела здравоохранения администрации Курортного района Санкт-Петербурга, Сестрорецк; с. н. с. ФГБОУ ВО СПбГУ Правительства РФ
Дмитрий Сергеевич Щербо, к.б.н., доцент, старший биоинформатик, Кембриджский университет; старший научный сотрудник РНИМУ им. Н.И.Пирогова
Марк Джайн, к.б.н., с.н.с. отдела лабораторной диагностики Медицинского научно-образовательного центра МГУ имени М.В. Ломоносова


 Меню
Меню





 Все темы
Все темы




 0
0








