Амфифильная вакцина для ингаляций защитила мышей от меланомы
Амфифильные альбумин-связывающие вакцины, разработанные учеными из Массачусетского технологического института, при введении в легкие индуцируют мощный местный T-клеточный ответ у мышей. Вакцины предотвратили развитие вирусной инфекции, а также защитили мышей от меланомы, вызванной внутривенной инъекцией опухолевых клеток. Эффективность вакцины обеспечивает индукция резидентных T-клеток памяти.
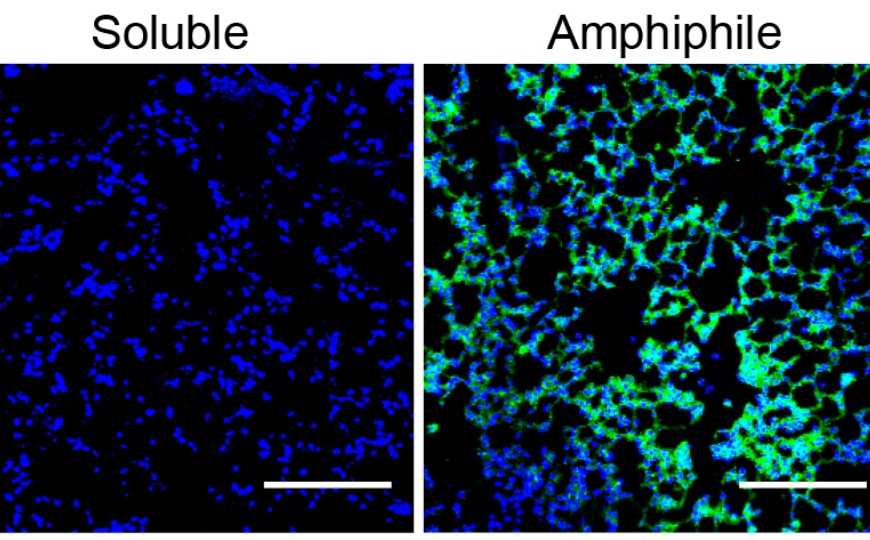
Credit: Rakhra et al., Sci. Immunol. 6, eabd8003 (2021)
Ученые из Массачусетского технологического института разработали амфифильную вакцину, усиливающую иммунный ответ в легких за счет индукции образования резидентных T-клеток памяти (TRM). Механизм действия и эффективность различных вариантов препарата изучили на мышах.
Технологию создания таких вакцин эта же команда описала ранее. Пептидные антигены или адъюванты конъюгируются с альбумин-связывающей амфифильной фосфолипидной молекулой. При инъекции вакцины липидный хвост связывается с эндогенным альбумином, содержащимся в тканевой жидкости. Альбумин работает как сопровождающий, обеспечивая эффективную доставку антигена или адъюванта в лимфоузлы. В лимфоузлах липидный хвост отсоединяется от альбумина и встраивается в клеточные мембраны, в результате чего формируется мощный антиген-специфический ответ эффекторных CD8+ T-клеток.
Известно, что TRM-клетки играют важную роль в защите организма от патогенов и опухолей. Ученые предположили, что при доставке в легкие амфифильные вакцины могут с помощью альбумина транспортироваться из дыхательных путей в легочную паренхиму, а затем в лимфатические узлы средостения, дренирующие легкие, где произойдет примирование резидентных T-клеток. В экспериментах использовались две амфифильные вакцины. Первая (amph-gp100) содержала пептидный антиген меланомы gp100, связанный с 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламиновым липидным хвостом через полиэтилегликолевый спейсер, и адъювант — агонист толл-подобного рецептора TLR9 CpG, связанный с похожим липидным хвостом. Вторая вакцина (amph-AL11), сконструированная аналогичным образом, в качестве антигена несла вирусный gag-пептид AL11.
Ингаляция — оптимальный способ доставки препарата в легкие для людей. В экспериментах на мышах ингаляцию имитировали с помощью интратрахеальной инстилляции. Контрольные мыши получали свободный антиген или свободный адъювант.
Амфифильные вакцины интенсивнее поступали в легкие мышей и лучше накапливались в лимфоузлах по сравнению со свободным антигеном/адъювантом. Двукратная интратрахеальная иммунизация с интервалом в две недели давала значительно более обширную популяцию антиген-специфичных T-клеток в легких, чем двукратное введением чистого антигена/адъюванта. Анализ индуцированных T-клеток показал, что амфифильные вакцины значительно усиливают мукозный иммунный ответ и способствуют формированию популяции TRM-клеток в легочной паренхиме. Такой эффект дает длительная презентации антигена в составе вакцины. При этом первая доза амфифильного конъюгата примирует T-клетки в лимфоузлах, а вторая — непосредственно в легочной ткани.
Авторы подтвердили и защитные свойства вакцин. Мыши, иммунизированные по двухдозовой схеме вакциной amph-AL11, выживали после заражения вирусом осповакцины, экспрессирующим эпитоп gag. Мыши, получившие чистый антиген/адъювант, после заражения теряли в весе и погибали в течение недели. Эксперимент с иммуносупрессором финголимодом, блокирующим выход T-клеток из лимфоузлов, подтвердил, что защиту обеспечивают именно TRM-клетки, образовавшиеся в легких после вакцинации.
Амфифильные вакцины против меланомы защищали мышей от развития опухоли при внутривенном введении клеток меланомы B16F10. Терапевтическое применение вакцины в комбинации с анти-PD1-терапией дало регрессию опухоли у 60% мышей с меланомой.
«В экспериментах с вирусом и опухолью мы использовали предположение о том, что T-клетки памяти обосновываются в легких и ожидают прямо там, на границе. Как только показывается клетка опухоли, или же вирус инфицирует клетку-мишень, T-клетки немедленно их уничтожают», — говорит Даррелл Ирвайн, главный автор работы и заместитель директора Института интегративных исследований рака им. Коха в МТИ. По словам Ирвайна, такая стратегия может использоваться для создания вакцин от ВИЧ, гриппа и других вирусов.
Источник
Kavya Rakhra, et al. // Exploiting albumin as a mucosal vaccine chaperone for robust generation of lung-resident memory T cells. // Science Immunology 19 Mar 2021: Vol. 6, Issue 57, eabd8003; DOI: 10.1126/sciimmunol.abd8003


 Меню
Меню





 Все темы
Все темы




 0
0








