Антибиотики двойного действия эффективны против резистентных инфекций
Новый класс антибиотиков двойного действия блокирует биосинтез изопреноидов у бактерий и активирует Vγ9Vδ2 Т-клетки хозяина, что было подтверждено in vitro и на мышах. Такой механизм должен препятствовать развитию резистентности у бактерий.
Credit: The Wistar Institute | Пресс-релиз
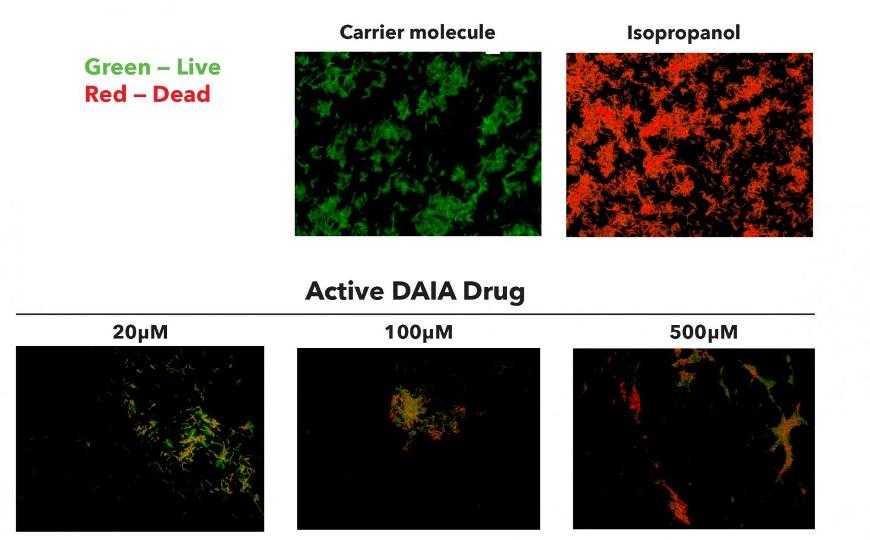
Ученые из Вистаровского института синтезировали новые антибиотики для борьбы с мультирезистентными бактериальными патогенами. Вещества отнесли к классу иммуно-антибиотиков двойного действия (dual-acting immuno-antibiotics, DAIA). Они инактивируют бактериальный фермент IspH, который участвует в биосинтезе изопреноидов. Кроме того, DAIA стимулируют иммунную систему хозяина. Их эффективность проверили in vitro и in vivo.
Первичный скрининг библиотеки химических соединений против очищенного фермента IspH из Escherichia coli выявил пять веществ: C23.07, C23.20, C23.21, C23.28 и C23.47. Однако ни одно из них не могло проникнуть внутрь бактериальной клетки. Тогда авторы синтезировали отрицательно заряженные эфиры этих соединений — C23.20-TPP, C23.21-TPP, C23.28-TPP, C23.07-TPP и C23.47-TPP, способные проходить через клеточную оболочку E. coli. Внутри бактерии эфирный хвост молекулы отрезается и высвобождается действующее вещество.
Антимикробное действие DAIA проверили in vitro на штамме E. coli CGSC 8074 и мультирезистентных клинических изолятах Vibrio cholerae, Enterobacter aerogenes, Acinetobacter baumannii, Pseudomonas aeruginosa и Klebsiella pneumoniae. Эффективность новых веществ была выше, чем у известных антибиотиков. Безопасность DAIA показали на клеточных линиях млекопитающих HepG2, RAW264.7, Vero и C2C12.
Следующим шагом ученые подтвердили, что новые антибиотики активируют иммунную систему. При ингибировании бактериального IspH происходит повышение концентрации его субстрата HMBPP. Молекула HMBPP распознается организмом как сигнал от патогенной бактерии. В ответ на нее происходит активация цитотоксических Vγ9Vδ2 T-клеток.
При воздействии C23.07-TPP на человеческие мононуклеарные клетки периферической крови, зараженные E. coli, Vγ9Vδ2 T-клетки активировались и выделяли цитотоксические перфорин, гранулизин и гранзимы в течение 24–48 часов. Такой же результат был получен при заражении клеток Mycobacterium smegmatis или V. cholerae.
Для изучения новых веществ in vivo ученые вводили модельным мышам человеческие мононуклеарные клетки периферической крови, нормальные или с уменьшенным количеством γδ T-клеток. После этого мышей заражали E. coli, а затем вводили C23.28-TPP в субоптимальной дозе. У мышей, получивших клетки с нормальным содержанием γδ T-лимфоцитов, бактериальная нагрузка была в 2–10 раз ниже, чем у мышей второй группы.
В другом эксперименте in vivo мышей заразили V. cholerae. После лечения C23.28-TPP снизились смертность мышей и бактериальная нагрузка в органах. С помощью DAIA ученые также вылечили гуманизированных мышей, инфицировнных E. coli, и мышей BALBc, зараженных устойчивым к антибиотикам штаммом E. aerogenes. У гуманизированных мышей были зарегистрированы оба механизма действия молекулы: прямое на IspH и через активацию иммунной системы.
Двойное действие новых антибиотиков должно препятствовать развитию резистентности у бактерий. В будущем авторы планируют изучить возможные механизмы выработки резистентности к ингибиторам IspH.
Источник
Singh K., et al. // IspH inhibitors kill Gram-negative bacteria and mobilize immune clearance. // Nature (2020), published 23 December 2020; DOI: 10.1038/s41586-020-03074-x


 Меню
Меню





 Все темы
Все темы




 0
0








