FDA одобрило новый тип клеточной терапии солидных опухолей
Препарат Тецелра компании Adaptimmune для лечения метастатической или неоперабельной синовиальной саркомы получил ускоренное одобрение FDA. Это не только первая новая терапия по данному показанию более чем за десять лет, но и первая терапия солидной опухоли с помощью генноинженерных клеток и первая терапия, использующая модифицированные Т-клеточные рецепторы (TCR), которая выходит на рынок.
Синовиальная саркома — редкая форма рака, при которой злокачественные клетки развиваются и образуют опухоль в мягких тканях тела; встречается преимущественно до 50 лет. Лечение обычно включает хирургическое удаление опухоли, радиотерапию и химиотерапию при рецидивах и (или) метастазировании. Препарат Тецелра (Tecelra, afami-cel) компания Adaptimmune для лечения метастатической или неоперабельной синовиальной саркомы Агентство по контролю продуктов и лекарств США (FDA) одобрило 2 августа 2024 года. Препарат показан пациентам, которые ранее получали химиотерапию, положительны по антигенам HLA A*02:01P, A*02:02P, A*02:03P или A*02:06P, и опухоль которых экспрессирует антиген MAGE-A4.
Тецелра может стать первой терапией, использующая модифицированные Т-клеточные рецепторы (TCR), и первой терапией солидной опухоли с помощью генноинженерных клеток. Клеточные препараты для терапии заболеваний крови давно существуют, однако подходы к клеточной терапии опухолей, развившихся не из клеток кроветворной системы, еще разрабатываются.
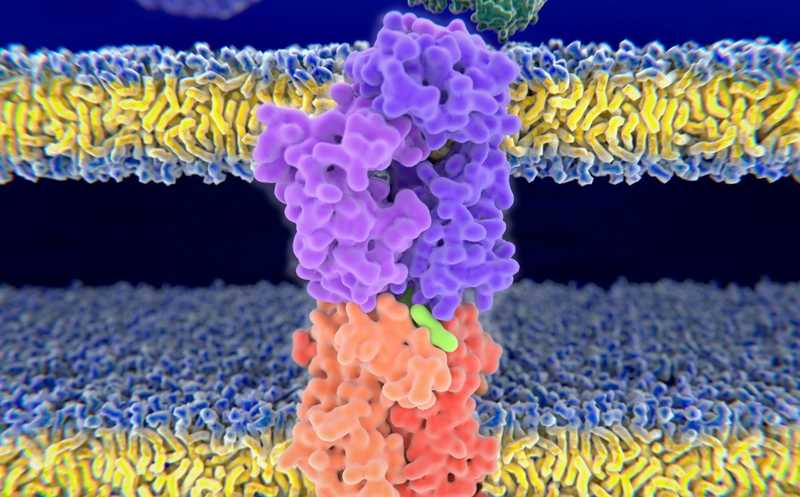
Препараты компании Adaptimmune содержат собственные Т-клетки пациента, в которые с помощью лентивирусного вектора доставляется ген модифицированного TCR. В результате экспрессируется TCR, который связывается с антигеном, характерным для опухоли — фрагментом онкобелка, презентируемым на HLA. Это приводит к разрушению клетки-мишени. Продукт вводится однократно, путем внутривенной инфузии.
Т-клеточные рецепторы состоят из двух связанных белковых цепей, альфа (α) и бета (β). Цепи имеют два региона, вариабельный и константный; с целевыми пептидами связываются вариабельные регионы. Каждый из них, в свою очередь, содержит три гипервариабельных региона, определяющих комплементарность (CDR). Технология компании Adaptimmune подразумевает модификацию этих CDR, повышающую сродство к комплексу «раковый антиген — HLA» и минимизирующую нецелевое связывание. (Популярное изложение на сайте компании.) В случае Тецелры модифицированный TCR нацелен на MAGE-A4 — антиген, экспрессируемый клетками синовиальной саркомы.
Одобрение получено по ускоренной процедуре. Она используется, когда препарат для лечения серьезного или опасного для жизни заболевания оказывает влияние на суррогатную конечную точку, по которой можно с уверенностью предсказать клиническую пользу для пациентов. В этом случае препарат может быть предварительно одобрен до того, как будут завершены дополнительные испытания, подтверждающие прогнозируемую клиническую пользу.
По результатам клинического испытания, опубликованным в марте, препарат вызвал стойкие ответы у пациентов с синовиальной саркомой, экспрессирующей HLA-A*02 и MAGE-A4. Среди 44 пациентов общая частота ответа составила 43,2%, а его медианная продолжительность — шесть месяцев. Теперь компания должна представить результаты подтверждающего КИ.
Рекомендованная цена терапии — $727 000. В США она может понадобиться 400 пациентам ежегодно, заявил Джон Лангер, главный специалист Adaptimmune по снабжению пациентов.
Немодифицированные иммунные клетки для терапии солидных опухолей уже используются. В феврале 2024 года был одобрен препарат Амтагви компании Iovance Biotherapeutics, который содержит инфильтрирующие опухоль лимфоциты (TIL). Их получают из ткани опухоли пациента, а не из крови. Препарат одобрен для терапии прогрессирующей меланомы. (Подробнее на PCR.NEWS.) Проводятся испытания TIL и против других солидных опухолей, например, метастатического колоректального рака.
CAR T-терапия может быть эффективной на поздних стадиях рака печени
Источники
FDA Approves First Gene Therapy to Treat Adults with Metastatic Synovial Sarcoma // FDA Press Announcement. Aug 2, 2024
Kevin Dunleavy. FDA signs off on Adaptimmune's Tecelra as the first engineered cell therapy for a solid tumor // FiercePharma. Aug 2, 2024


 Меню
Меню





 Все темы
Все темы




 0
0







