Инна Должикова: как делаются вакцины
Новый блок научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье» посвящен вирусам и вирусологии. В первой лекции Инна Вадимовна Должикова (ФГБУ «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России) рассказала о всех этапах разработки и исследования вакцин на примере «Гам-КОВИД-Вак» («Спутник V»).

Немного истории
Иммунопрофилактика значится первой в списке 10 величайших достижений здравоохранения XX века и является фактором экономического роста в мировом масштабе. За последние 50 лет глобальные усилия по иммунизации спасли не менее 154 миллионов жизней — это 6 человек каждый день!
Со времен Эдварда Дженнера вакцинопрофилактика шагнула далеко вперед. До середины XX века в большинстве вакцин использовались инактивированные (холера, чума, брюшной тиф) или аттенуированные (туберкулез) патогены. Но такие вакцины подходят не для всех заболеваний и пациентов. Прорыв в вакцинопрофилактике произошел во второй половине XX века. Ему предшествовали три Нобелевских открытия — расшифровка генетического кода, разработка метода секвенирования ДНК и открытие эндонуклеаз рестрикции. Благодаря им появилась возможность манипулировать генетической информацией патогенов и создавать генноинженерные вакцины.
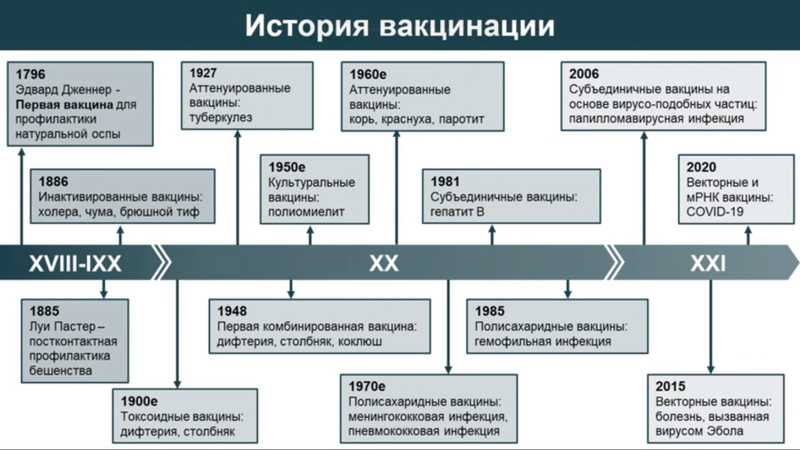
Первой такой вакциной стала субъединичная вакцина для профилактики гепатита B. Антиген гликопротеина гепатита B накапливали в культуре дрожжей, затем чистили, паковали на носитель и в таком виде представляли иммунной системе.
Сегодня генноинженерные вакцины представлены несколькими классами. Это рекомбинантные субъединичные вакцины, в состав которых входят наночастицы, покрытые очищенными вирусными антигенами; вакцины на основе вирусоподобных частиц, которые содержат комплекс белков без нуклеиновых кислот, имитирующих живой вирус; ДНК- и РНК-вакцины; вирусные векторные вакцины, несущие рекомбинантные вирусные векторы с генами вирусных белков.
Особенности вакцинации в РФ
В России вакцинопрофилактика осуществляется в соответствии с Национальным календарем профилактических прививок, в который входит вакцинация от 12 наиболее опасных и распространенных инфекционных заболеваний. Также есть календарь прививок по эпидемическим показаниям: вакцинация проводится, если планируется поездка в эндемичные регионы, при контакте с больным, при опасности распространения инфекции, при высоком риске заражения людям определенных профессий.
Как работает наша иммунная система?
Естественный иммунитет делится на:
-
врожденный — барьеры, слизь, работа натуральных киллеров, макрофагов и других клеток, система комплемента и цитокины;
-
приобретенный — активный, если мы переболели, и пассивный, который передался от мамы.
Искусственный иммунитет бывает:
-
активным — при вакцинации от патогена;
-
пассивным — при введении иммуноглобулинов, моноклональных антител.
После первичной инфекции или вакцинации идет всплеск иммуноглобулинов класса M, который затем затухает. На смену им приходят специфичные иммуноглобулины класса G. Со временем уровень антител будет снижаться, но при столкновении с уже известным патогеном высокоспецифичные IgG сразу же будут готовы к ответу.
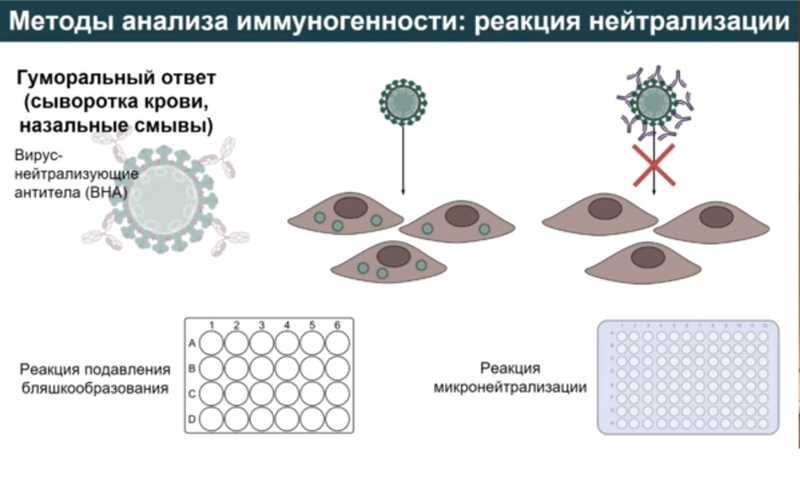
По каким параметрам оценивается иммунный ответ на вакцинацию? При анализе иммуногенности препарата исследуют гуморальный иммунный ответ в сыворотке крови и назальных смывах и клеточный иммунный ответ (специфические Т-клетки, цитотоксические Т-лимфоциты и цитокины).
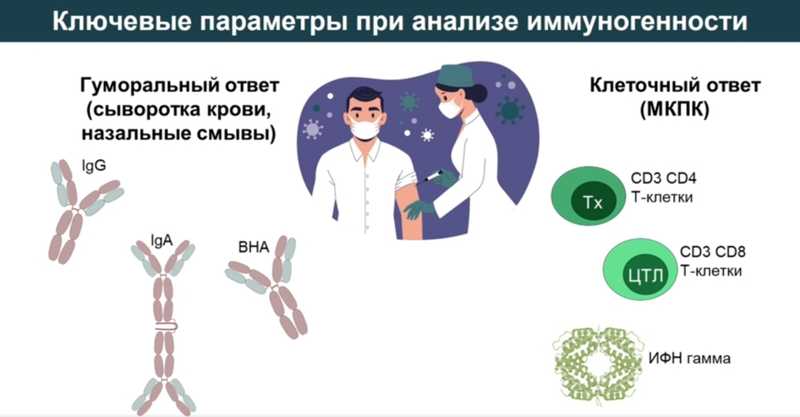
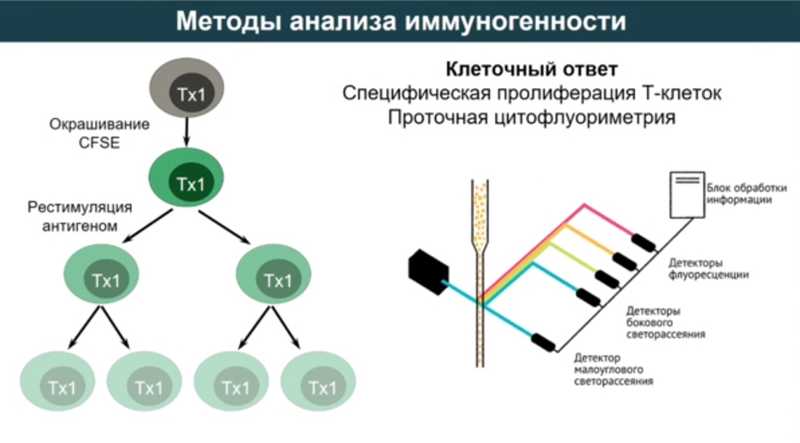
Оценка гуморального иммунного ответа по количеству IgG, IgA и вируснейтрализующих антител (ВНА) чаще всего проводится с помощью ИФА, ИХЛА, РТГА, реакции нейтрализации. Для анализа клеточного иммунного ответа сначала выделяют мононуклеарные клетки периферической крови, затем их красят витальным красителем, проводят рестимуляцию антигеном и через несколько дней проводят оценку пролиферации на проточном цитофлуориметре, а также анализируют прирост цитокинов после рестимуляции антигеном.
Разработка вакцин
Она начинается с базовых исследований:
-
лабораторные исследования возбудителя, если он новый;
-
выбор первоначальной конструкции препарата: что выступит в качестве антигена и как будет осуществляться доставка;
-
разработка и характеристика модели заболевания.
Затем можно переходить к доклиническим исследованиям препарата:
-
оценка безопасности и специфической активности (иммуногенность и протективность);
-
выявление побочных эффектов;
-
определение максимально переносимой дозы.
Если ДКИ прошли успешно, то готовится пакет документов для получения разрешения на клинические испытания, которые проводятся в несколько этапов:
-
фаза 1 — до 100 человек, оценка безопасности и переносимости, выявление нежелательных явлений, изучение иммунного ответа;
-
фаза 2 — 100-1000 человек, оценка эффективности, анализ нежелательных явлений, определение оптимальной дозы и способа введения;
-
фаза 3 — 1000+ человек, оценка эффективности, сравнение с плацебо.
Фазы могут быть объединены в экстренных ситуациях, таких как пандемия COVID-19.
После завершения клинических исследований проводится госконтроль с независимыми госиспытаниями и регистрация препарата. Дальнейшие исследования включают в себя пострегистрационные исследования безопасности и эффективности препарата, выявление редких нежелательных явлений.
Как создавали «Спутник V»
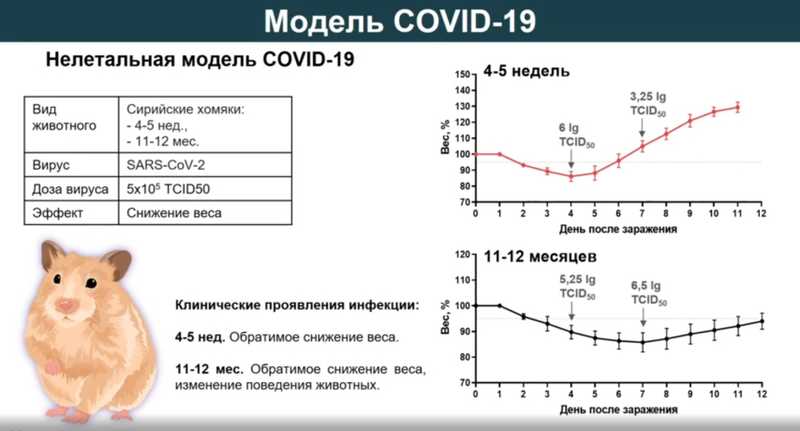
Когда пришел COVID-19, стало понятно, что нужно срочно разрабатывать вакцину. Вирус, вызывающий заболевание, — это SARS-CoV-2. В начале 2000-х его родственник вызвал эпидемию тяжелого острого респираторного синдрома. Самой лучшей животной моделью для него были золотистые сирийские хомяки.
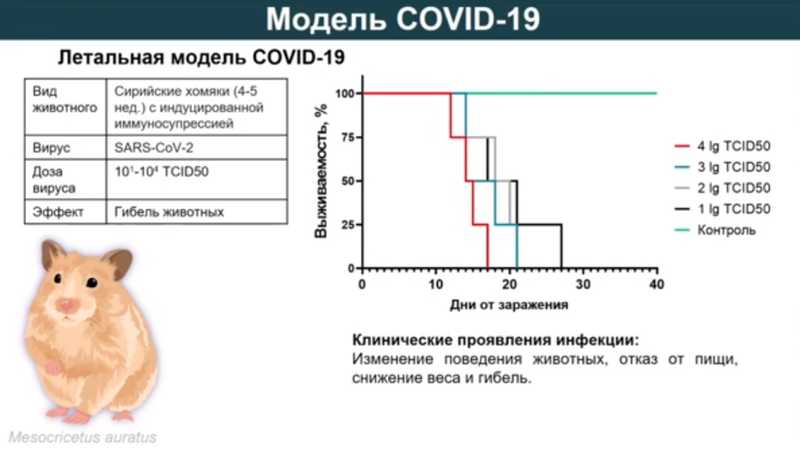
Как только выделили SARS-CoV-2, сразу приступили к разработке модели. Купили сирийских хомяков, заразили, а они остались живы. В доклинических исследованиях важно показать действие вакцины в самых жестких условиях на летальной модели, поскольку чем в более жестких условиях у животных препарат работает, тем выше вероятность, что он будет работать у людей. Тогда решили полностью подавить иммунную систему хомяков и посмотреть, что будет. На фоне иммунносупрессии получилось добиться гибели животных на 15-25-е сутки после заражения. Легкие были полностью поражены на 7-е сутки. Важно отметить, что позже для оценки эффективности вакцины хомяков сначала вакцинировали, а потом давали иммуносупрессанты. Такая модель очень жесткая, но позволяет оценить, будут ли наработанные в ответ на вакцинацию антитела защищать животных от заболевания и гибели.
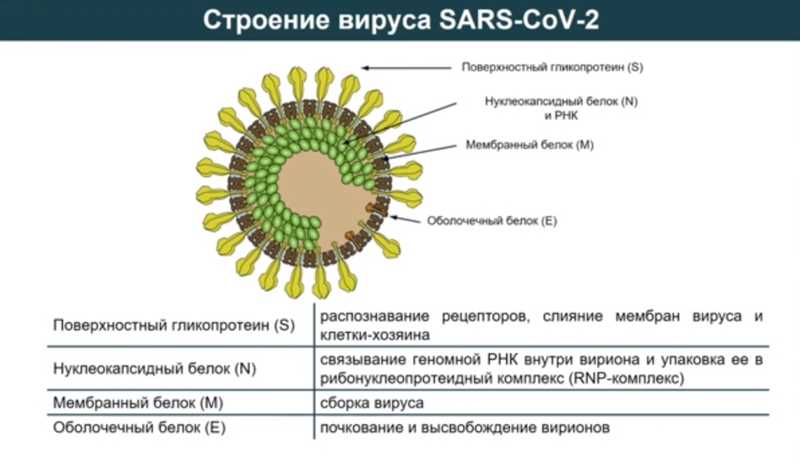
Коронавирус SARS-CoV-2 — это достаточно простой вирус, на его поверхности представлен преимущественно гликопротеин S, за счет которого он проникает в наши клетки. В вирионе есть и другие белки: нуклеокапсидный белок (N), мембранный белок (M) и оболочечный белок (E). Чтобы вирус проник в клетку, необходимо связывание гликопротеина S с рецептором на поверхности клетки. Если сформировать иммунный ответ именно к S-белку, то проникновение вируса будет заблокировано прямо на входе.
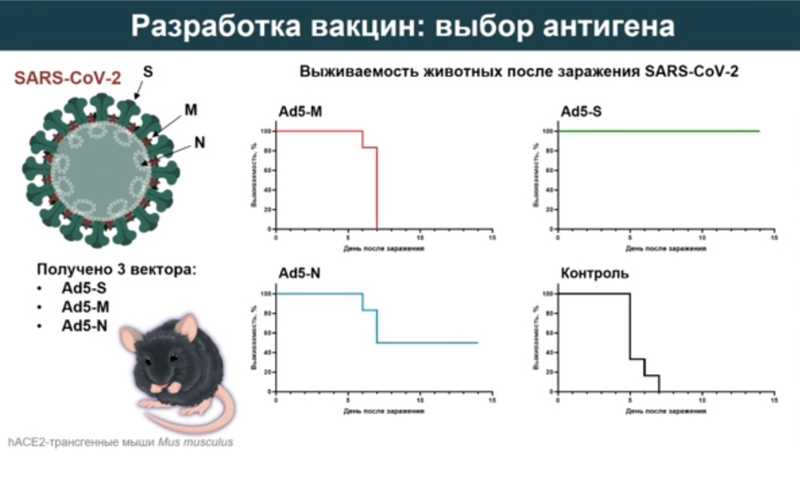
Предположения подтвердились в ходе опытов. Коллектив исследователей разработал три рекомбинантных аденовируса, которые кодируют S, N и M-белки, и провакцинировал трансгенных мышей, несущих ген рецептора АСЕ2 человека. Только использование S-белка в качестве антигена позволило защитить животных от летальной инфекции со 100%-ной эффективностью, N-белок защитил лишь около 50% мышей, а М-белок не защитил совсем.
С антигеном определились, теперь нужно выбрать технологическую платформу. Самыми перспективными показались аденовирусные векторы: аденовирусы «живут» с нами уже очень давно, за это время они научились эффективно проникать в наши клетки, и их удобно использовать для доставки генетического материала. Рекомбинантный аденовирусный вектор, несущий ген гликопротеина S, попадает в клетку, там он «раздевается», его ДНК попадает в ядро, где начинается считывание информации, что в результате приводит к синтезу целевого антигена (гликопротеина S вируса SARS-CoV-2). Получается, клетка, в которую попал аденовирусный вектор, сама начинает синтезировать антиген, к которому в дальнейшем вырабатывается иммунный ответ.
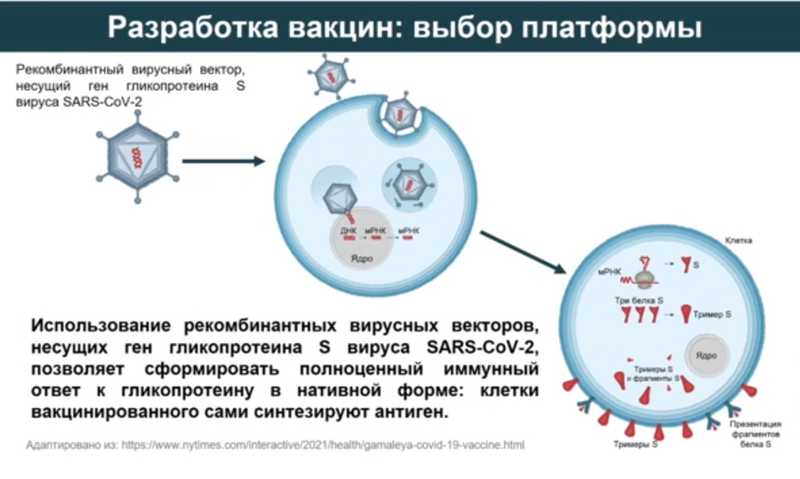
Платформа выбрана, дизайн вакцины готов. «Гам-КОВИД-Вак» состоит из двух компонентов: компонент 1 содержит рекомбинантный вектор на основе аденовируса человека 26 серотипа (Ad26), компонент 2 — рекомбинантный вектор на основе аденовируса человека 5 серотипа (Ad5). Оба вектора несут ген полноразмерного гликопротеина S вируса SARS-CoV-2.
Как формируется иммунный ответ на вакцинацию? При введении первой дозы вакцины вектор попадает в наши клетки, клетки начинают синтезировать антиген, который представляется иммунной системе. На него реагируют B-клетки и синтезируют антитела, формируя гуморальный иммунный ответ. Помимо этого, антиген расщепляется внутри клетки и представляется на комплексах гистосовместимости I и II класса для формирования клеточного иммунного ответа: активации Т-хелперов и цитотоксических Т-лимфоцитов. Праймирование иммунного ответа произошло, начала формироваться иммунная память. В этот момент вводится второй компонент вакцины. Происходит стимуляция иммунной памяти, и количество специфических антител и Т-клеток многократно растет.
В рамках доклинических исследований (ДКИ) препарата «Гам-КОВИД-Вак» провели анализ:
-
безопасности — оценивались острая токсичность, токсичность при повторном введении, аллергизирующие свойства, иммунотоксичность, репродуктивная токсичность;
-
иммуногенности — гуморальный ответ (антиген-специфические IgG, IgA, вируснейтрализующие антитела) и клеточный ответ (антигенспецифические пролиферация CD4+ и CD8+ клеток, продукция ИФН гамма, ФНО альфа, ИЛ-2);
-
протективности — снижение вирусной нагрузки в органах и тканях, снижение тяжести клинических признаков инфекции, снижение летальности.
Протективность исследовали на сирийских хомяках и hACE2-трансгенных мышах (то есть имеющих «человеческий» вариант клеточного рецептора, с которым взаимодействует вирус). Вакцина защищала 100% хомяков с индуцированным иммунодефицитом и 100% трансгенных мышей от летальной инфекции, вызванной вирусом SARS-CoV-2. При этом контрольные животные погибали к 12-13-м суткам после заражения.
После окончания ДКИ Центр получил разрешение на проведение КИ 1-2 фазы. Сначала оценили безопасность и иммуногенность отдельных компонентов вакцины, затем перешли к исследованию двух последовательных доз.
Было установлено, что вакцина имеет хороший профиль безопасности, не вызывает серьезных нежелательных явлений (подробнее на PCR.NEWS). Чаще всего добровольцы сообщали о повышении температуры, головной боли, астении и боли в месте введения. Все эти явления считаются нормальной реакцией на вакцинацию. В то же время вакцина индуцировала формирование гуморального и клеточного иммунитета, количество специфических антител росло с 14-го дня после введения первого компонента.

После завершения фазы 1/2, в августе 2020 года, вакцина «Гам-КОВИД-Вак» была зарегистрирована для медицинского применения в чрезвычайных ситуациях.
В клинических испытаниях фазы 3 эффективность вакцины превысила 90% во всех возрастных группах. Уровень иммунного ответа не зависел от пола и возраста добровольцев. RBD-специфические IgG были детектированы у 98,25% добровольцев, нейтрализующие антитела — у 95,83% добровольцев, гликопротеин-специфическая секреция интерферона гамма — у 100% добровольцев.
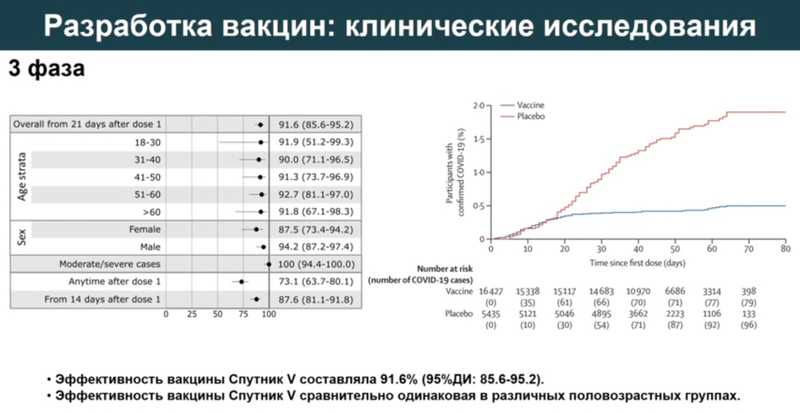
Департамент здравоохранения Москвы во второй половине 2023 года провел дополнительный анализ эффективности вакцины. Защита от заболевания колеблется от 31,9% в группе старше 80 лет до 63,5% в группе 18–59 лет, однако если выделить группу людей, которые систематически ревакцинировались, то эффективность защиты составит от 82,8% в группе 80+лет до 93,6% в группе 18-59 лет. Если говорить о защите от госпитализации и COVID-19-ассоциированной смерти, то эффективен даже один курс вакцинации.
С учетом повсеместного распространения вируса и высокого уровня заболеваемости стало очевидно, что необходимо вакцинировать не только взрослое население, но и младшие возрастные группы (подростки и дети), а также использовать разные способы введения вакцин. Например, интраназальный — для формирования локального мукозального иммунитета в воротах инфекции. Сегодня вакцина«Гам-КОВИД-Вак» представлена линейкой препаратов для вакцинации разных возрастных групп и разных способов иммунизации: «Гам-КОВИД-Вак» для взрослых, «Гам-КОВИД-Вак М» для подростков 12-17 лет, «Гам-КОВИД-Вак Д» для детей 6-11 лет, «Гам-КОВИД-Вак назальная» и «Спутник Лайт» для взрослых.
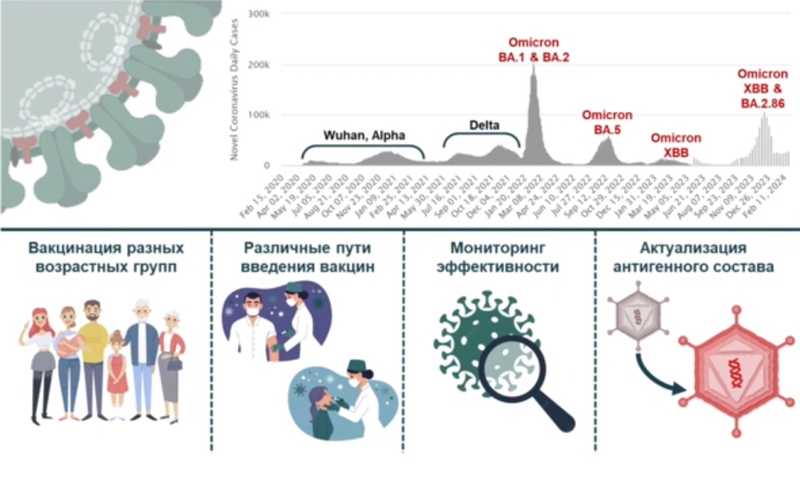
Увеличение иммунной прослойки, хронизация инфекции у иммунокомпрометированных лиц могут способствовать антигенному дрейфу и появлению новых вариантов коронавируса. Это может сопровождаться закреплением мутаций преимущественно в поверхностном гликопротеине S вируса SARS-CoV-2, играющем ключевую роль в жизненном цикле – интернализации. И пока ученые разрабатывали и исследовали новые формы вакцины, вирус продолжал распространяться, эволюционировать и вызывать новые подъемы заболеваемости. Таких подъемов на территории России за все время зафиксировано более восьми. Самый крупный произошел в начале 2022 года и был связан с появлением варианта омикрон.
По мере того как вирус находился в популяции, он стал ускользать от постинфекционного и поствакцинального иммунитета из-за аминокислотных замен в S-белке и изменениях свойств вируса. У исходного «уханьского» варианта коэффициент репродукции (сколько человек может заразить один заболевший) составлял около 2,5, с приходом варианта дельта коэффициент вырос до 6,5, с приходом омикрона — до 13-14. Более того, исследования in vitro показали, что заражение клеток новыми вариантами вируса приводит к формированию синцитиев (когда соседние клетки сливаются), следовательно, вирус способен передаваться без выхода в межклеточное пространство. В этом случае он становится недоступен для иммунной системы. Также значительно сократился инкубационный период — с 14 дней до 2–3 дней.
Когда появляются новые вирусы? Новые исследования показывают, что вирус не меняется, когда идет подъем заболеваемости. Вирус изменяется, когда он долго находится в людях с проблемами с иммунитетом — в иммунокомпрометированных пациентах. Так, было описано, как менялся вирус у пациентов с лимфомами в течение около 200 дней. За период наблюдений авторы зафиксировали около 10 замен в гене S-белка. В другой статье описали пациента с неходжкинской лимфомой, заразившегося COVID-19 весной 2020 года. Уже тогда, осенью 2020 года, в гликопротеине вируса детектировали замены, которые появились в варианте омикрон в конце 2021 года. По всей видимости, вирус SARS-CoV-2 какое-то время находится в организме, который не способен его полностью элиминировать, меняется, а затем выходит в популяцию.
Поскольку вирус меняется, необходимо проводить постоянный мониторинг эффективности вакцины. Если ученые замечают распространение нового варианта, они изолируют его и используют для исследования нейтрализующих антител в сыворотке крови вакцинированных людей и оценки протективности вакцины у животных. В случае, если будет выявлено снижение эффективности в рамках лабораторного мониторинга, необходимо менять антигенный состав вакцин.
В период распространения первых вариантов вируса (Ухань, альфа, бета, гамма и дельта) «Гам-КОВИД-Вак» эффективно снижала вирусную нагрузку в легких вакцинированных животных (до недетектируемого уровня) и обеспечивала защиту населения от заболевания и госпитализации. Картина начала меняться с приходом варианта омикрон. Эффективность снизилась в отношении варианта омикрон ВА.5; с приходом вариантов омикрон XBB и JN.1 у вакцинированных было значительное снижение нейтрализующих антител, у животных вирусная нагрузка не снижалась на 2 lg (в сто раз) и более. Значит, антигенный состав вакцины нужно менять.
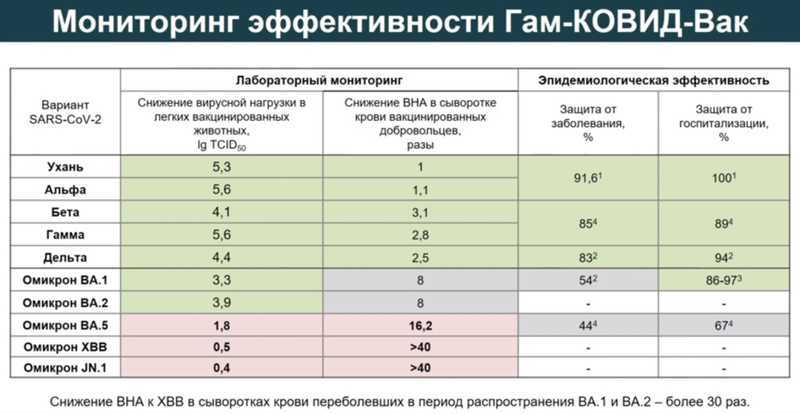
Ген S-белка от уханьского варианта вируса заменили на ген S-белка из варианта ХВВ. Анализ эффективности вакцины с обновленным антигенным составом у животных показал, что в легких вакцинированных животных жизнеспособный вирус не обнаружен, снижение вирусной нагрузки составило более 5 lg (в 100 000 раз). Новый антигенный состав был также эффективен против варианта JN.1, появившегося в начале 2024 года.
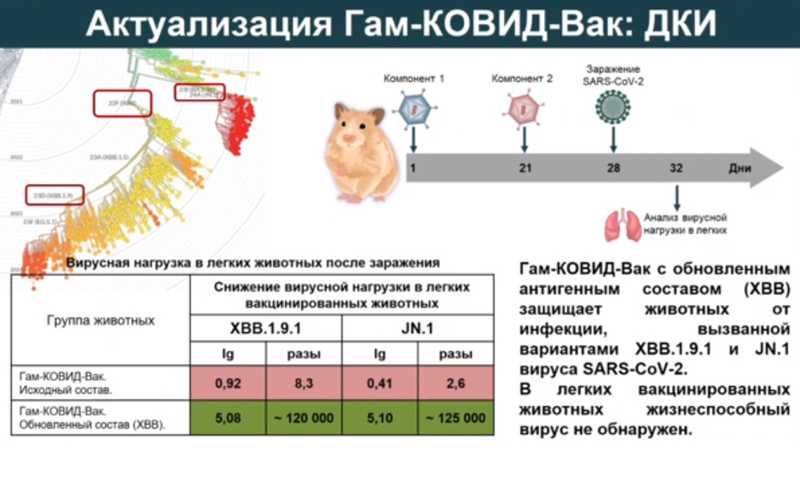
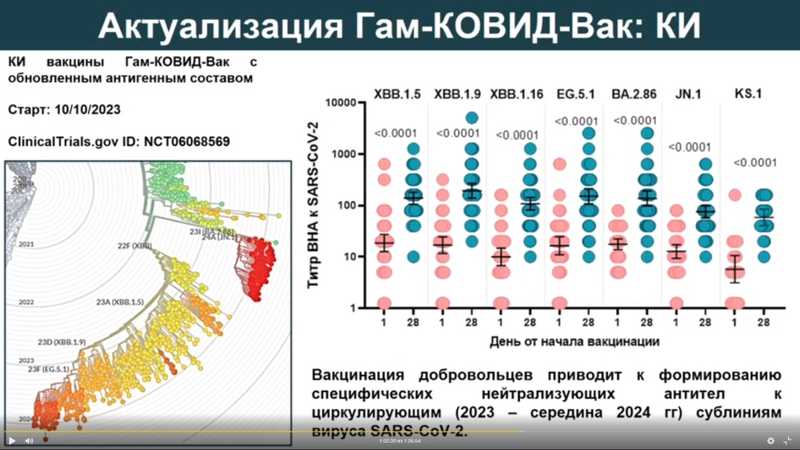
В рамках клинических исследований вакцины с обновленным антигенным составом было показано, что у добровольцев формируются специфические нейтрализующие антител к сублиниям вируса SARS-CoV-2, циркулирующим с 2023 года до середины 2024-го. После проведения клинических исследований вакцины «Гам-КОВИД-Вак» с обновленным антигенным составом (вариант ХВВ) были внесены изменения в регистрационное досье, после чего препарат был внедрен в гражданский оборот для защиты населения.
Мифы о вакцинации
По мнению ВОЗ, антипрививочники — одна из главных проблем здравоохранения и угроз человечеству. Противники вакцинации ставят под угрозу как собственное здоровье, так и здоровье окружающих. Инна Должикова перечислила наиболее часто встречающиеся возражения.
-
Вакцинация — мое личное дело. Да, конечно, но если мы хотим избавиться от заболеваний, очень важно сформировать коллективный иммунитет, а чем больше людей отказывается от прививок, тем сложнее это сделать.
-
Вакцина заражает мой организм. В составе «Гам-КОВИД-Вак» нет жизнеспособных вирусов, способных размножаться.
-
Вакцина вызывает аутизм. В конце 90-х годов в журнале The Lancet вышла статья — как оказалось позже, заказная — о связи вакцинации и аутизма у детей. Статья была отозвана, но об этом мало кто помнит.
-
Вакцина вызывает аллергию. Во время ДКИ и КИ проводится исследование аллергизирующих свойств, и если в рамках исследований выявляются аллергизирующие свойства, то такой препарат не будет допущен до КИ и регистрации.
-
Лучше переболеть. Не всегда можно предсказать, какие последствия принесет болезнь. Кто-то думал, что это просто респираторная инфекция, но потом появились проблемы с памятью, иммунной системой, а также с другими органами и системами организма. Риск тяжелых побочных явлений от вакцинации 1 на 10 миллионов, риск умереть от COVID-19 был около 5%.
-
Вакцина ослабляет иммунитет. Вакцины создаются, чтобы стимулировать иммунитет.
-
Вакцины вызывают рак. Конечно, есть онкогенные аденовирусы, но для создания вакцин такие штаммы не используются. Все белки, которые могут быть потенциально онкогенными, из векторов удаляются.
-
Многие не прививаются и не болеют. Если коллективный иммунитет высокий, то единичные не вакцинированные люди не заболеют.
-
Вакцина встроится в мою ДНК. Если речь идет о генотерапевтических препаратах, то да. Но ни один из профилактических препаратов — к которым относятся вакцины — не способен встроиться в ДНК. На просторах интернета даже в свое время появилась фраза: «Те, кто считает, что вакцина изменит их ДНК, должны рассматривать это как шанс».



 Меню
Меню





 Все темы
Все темы



 0
0







