Когда геномному тексту нужен редактор
Самый популярный метод геномного редактирования на сегодня — CRISPR-Cas9. Как он работает, какие у него есть недостатки, почему генотерапевтические методы на основе CRISPR-Cas9 успешно проходят клинические испытания и некоторые уже разрешены, а редактирование эмбрионов не только не разрешено, но и противозаконно, объясняет Светлана Смирнихина.

Новый блок лекций, посвященный геному, в рамках научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье» открыла лекция «Искусство редактирования: как мы меняем генетическую информацию». Лекция к.м.н. Светланы Смирнихиной, заведующей лабораторией редактирования генома ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» была посвящена главным образом самому популярному и перспективному методу геномного редактирования — CRISPR-Cas9.
Разрезать и склеить
Светлана Смирнихина начала с определения того, что такое геномное редактирование — группа методов для манипуляций с ДНК, в том числе для терапевтических целей, в основе которых лежит использование программируемых нуклеаз. Суть большинства методов редактирования заключается в создании двуцепочечного разрыва в ДНК (в этом и состоит роль нуклеаз) с последующей его репарацией.
Существует четыре метода геномного редактирования, но наибольшее распространение получил метод CRISPR-Cas9, появившийся в 2012 году. (Остальные три — мегануклеазы, нуклеазы цинковых пальцев и нуклеазы TALE.)
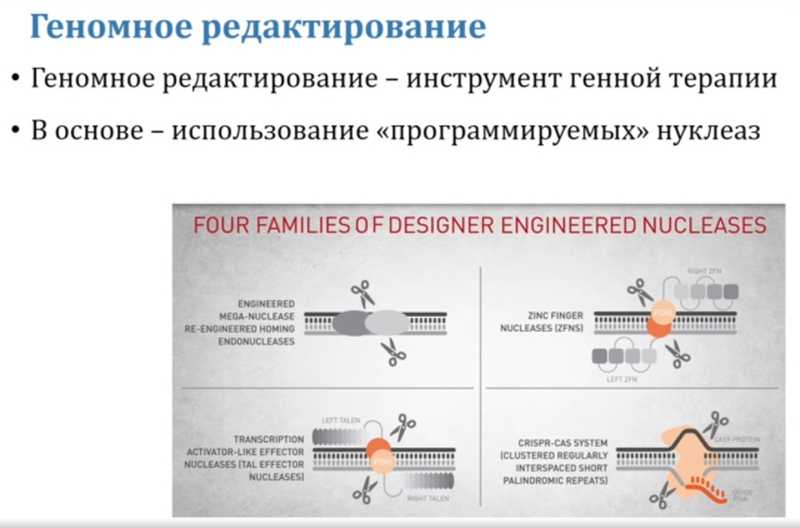
Система состоит из двух компонентов: CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, группа разделенных регулярными промежутками коротких палиндромных повторов»), и Cas9 — это CRISPR-ассоциированный белок 9, собственно, нуклеаза. Эта система существует у бактерий, обеспечивая противовирусную защиту, но использовать ее для геномного редактирования эукариотических клеток предложили Дженнифер Дудна и Эммануэль Шарпантье, за что им была присуждена Нобелевская премия. Другие исследователи, Фэн Чжан и Дэвид Лю из Института Брод, много сделали для модификации и улучшения этого метода.
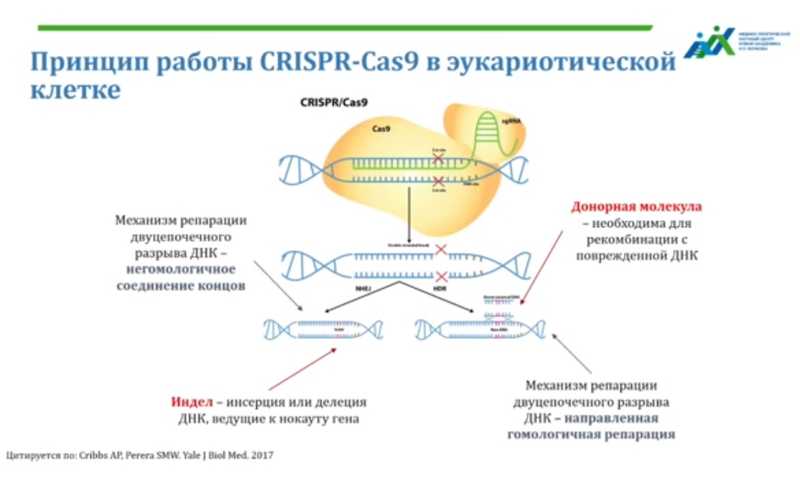
Далее Светлана Смирнихина объяснила, как эта молекулярная система работает у бактерий, защищая их от фагов, и как Дудна и Шарпантье приспособили ее для направленного редактирования геномов. В систему редактирования входят два основных компонента: нуклеаза Cas9, необходимая для разрезания ДНК, и гидовая (направляющая) РНК, которая по принципу комплементарности обеспечивает распознавание целевого участка ДНК. Третий небольшой компонент (PAM) на противоположной цепи необходим для того, чтобы Cas9 связалась с ДНК. Все это нужно для того, чтобы обеспечить разрезание ДНК в определенном участке.
Затем включаются механизмы репарации, которыми клетка реагирует на разрыв. Репарация может пойти по двум путям. Первый путь — негомологичное соединение концов — «это похоже на то, как мы зашиваем дырку», объясняет Светлана Анатольевна: в месте сшивания происходит повреждение в виде инделов (выпадение или вставка нуклеотидов). Этот способ репарации ведет к нарушению кодирующей последовательности и нокауту гена, но он в клетке доминирует. Второй путь — гомологичная репарация — включает рекомбинацию с донорной молекулой ДНК, которую мы даем клетке, и тогда фрагмент ДНК замещается на нужный нам фрагмент. Как раз этот способ ведет к исправлению мутаций. К сожалению, гомологичная репарация происходит реже и только в определенные фазы клеточного цикла. Хотя, если для геномного редактирования нужно просто выключить какой-то ген, то подходит и первый способ — нокаут гена, что намного проще.
Достоинства и недостатки
Метод геномного редактирования CRISPR-Cas9 имеет несколько важных достоинств. Прежде всего, внесенные изменения сохраняются в дочерних клетках, которые получатся после деления отредактированной клетки. Это дает надежду на лекарственный препарат, который можно будет ввести один раз в жизни. Важное преимущество — легкость дизайна редактирующей конструкции и доставки в клетку. Существуют множество модификаций этой технологии, удобных для разных целей, в частности, можно уменьшить размер конструкции, что облегчит доставку. Наконец, эффективность редактирования достаточно высока, особенно если речь идет о нокауте гена.
Основной недостаток CRISPR-Cas9 — низкая специфичность. Целевая последовательность нуклеотидов, которую надо отредактировать, может встретиться где-то еще на молекуле ДНК, и тогда изменения случатся там, где они не должны быть, — это называется офтаргетным действием. Второй недостаток — низкая частота гомологичной репарации, поэтому сделать нокаут гена проще, чем исправить мутацию. К недостаткам относится и низкая частота редактирования обоих аллелей; чаще редактируется только один из двух, хотя обычно исправления одного аллеля бывает достаточно, чтобы симптомы заболевания не проявлялись. Наконец, с помощью CRISPR-Cas можно исправить лишь небольшие мутации, но не крупные делеции и не хромосомные нарушения. Хотя в теории 99% наследственных заболеваний можно вылечить таким способом.
Но главная проблема — как уже говорилось, офтаргетное действие, то есть создание двуцепочечного разрыва ДНК вне локуса-мишени, что может вести к дополнительным мутациям в геноме. Самая большая опасность в том, что из-за офтаргетных разрывов может активироваться какой-либо протоонкоген, и это приведет к раку.
Чтобы повысить специфичность метода, применяют его модификации. Например, используют не нуклеазу, а никазу — фермент, который не создает двуцепочечных разрывов, а режет только одну цепь.
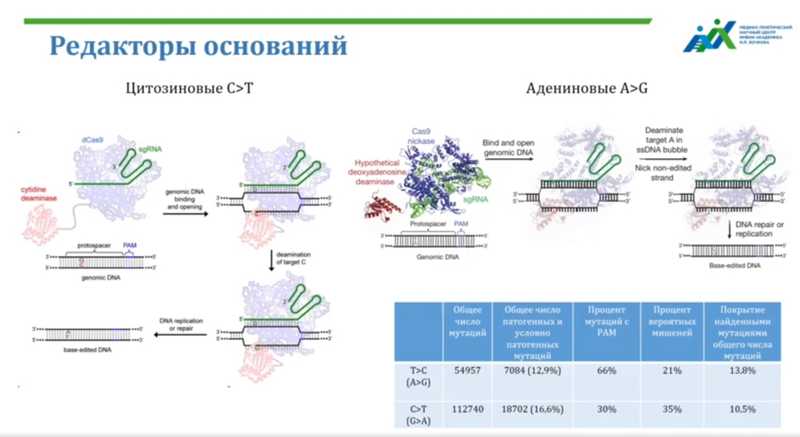
Кроме того, для редактирования используют редакторы оснований — в них работает дезаминаза, фермент, который отщепляет аминогруппу от азотистого основания, что приводит к замене одного нуклеотида на другой. Разрыва молекулы ДНК при этом не происходит, так как для взаимодействия с ДНК используется неактивная форма Cas9 (dead Cas9), несущая дезаминазный домен. Например, цитозиновые редакторы оснований конвертируют цитозины в тимины, адениновые — конвертируют аденины в гуанины. Таким образом можно исправлять точечные мутации без риска внести делеции или инсерции.
Еще один вид модификаций — праймированное редактирование с использованием обратной транскриптазы — позволяет вносить протяженные изменения.
Кстати, dead Cas9 может нести на себе белок, регулирующий активность гена: доставка его в определенный участок приводит к избирательному включению или выключению гена-мишени.
Разрешения и запреты
Переходя к практическому применению CRISPR-Cas9, Светлана Смирнихина подчеркнула, что сейчас основное применение метода — это создание моделей заболеваний, на клеточных культурах или на животных (99% моделей заболеваний сейчас делаются таким способом). Но, конечно, самое интересное — это перспектива лечения болезней при помощи геномного редактирования. Теоретически, методом CRISPR-Cas9 в случае направленной гомологичной репарации мы можем исправить мутацию в каком-либо гене или встроить целый ген, если он не работает. Но пока этот вариант геномного редактирования остается на уровне научных разработок, до клиники он не дошел.
Более простой способ получения генотерапевтических препаратов допускает, что негомологичная репарация, ведущая к нокауту гена, — приемлемый вариант для терапии. Например, пациентам с ВИЧ-инфекцией может помочь нокаут CCR5 — рецептора, который обеспечивает проникновение вируса в Т-клетку. У пациентов забирают периферическую кровь, в Т-клетках нокаутируют ген CCR5, и клетки, лишенные рецепторов, возвращают в организм пациенту. Этот подход к терапии называют ex vivo. Второе направление — лечение онкологических заболеваний. Для этого применяют нокаут гена PDCD1, который кодирует поверхностный рецептор Т-клеток, позволяющий раковым клеткам уйти от иммунного ответа. Схема лечения такая же, что и для ВИЧ.
Сейчас в клинических исследованиях находятся три метода геномного редактирования, и среди них преобладает метод CRISPR-Cas9 — проходят 109 клинических исследований (год назад было всего 30, подчеркнула Светлана Смирнихина).
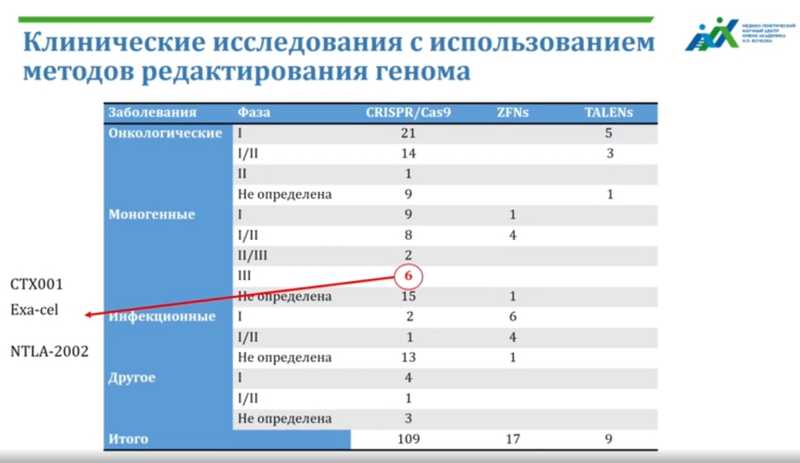
Это препараты для лечения онкологических заболеваний (большинство основаны на нокауте гена PDCD1), инфекционных — в основном для лечения ВИЧ (нокаут гена CCR5). Дальше всего продвинулись препараты для лечения моногенных заболеваний — шесть клинических исследований дошли до фазы 3, и это исследования двух препаратов.
Первый препарат лечит гемоглобинопатии. Например, бета-талассемию — болезнь, при которой бета-глобин не образуется, в результате разрушаются эритроциты, возникает анемия и железо откладывается во внутренних органах. Или серповидноклеточную анемию, при которой эритроциты больного имеют характерную серповидную форму. Оба заболевания возникают из-за мутаций в гене HBB. Стратегия терапии состоит в том, чтобы увеличить синтез фетального гемоглобина, который будет работать вместо гемоглобина взрослого. Для этого методом CRISPR-Cas9 нокаутируется ген BCL11A, который в норме блокирует синтез фетального гемоглобина у взрослого человека. После нокаута BCL11A его синтез восстанавливается, и симптомы заболеваний уменьшаются. Это тоже ex vivo терапия: у пациента берут кровь, выделяют гемопоэтические стволовые клетки, редактируют их с образованием нокаута гена BCL11A и трансплантируют пациенту. Эффект был настолько хорошим, что в 2023 году FDA одобрило первый препарат на основе CRISPR-Cas9 — Касгеви (exa-cel, CTX-001) — для лечения бета-талассемии и серповидноклеточной анемии. Препарат, что неудивительно, дорогой, в США он стоит 2,2 млн долларов.
Второй препарат, NTLA-2002, направлен на лечение аутоиммунного заболевания — ангионевротического отека. В отличие от Касгеви, это in vivo терапия: человеку вводят наночастицы с CRISPR-Cas9 конструкцией, и целью геномного редактирования в данном случае является нокаут гена KLKB1, кодирующего белок калликреин, ответственный за заболевание.
В списке заболеваний, для которых проводятся клинические исследования терапии методом геномного редактирования — гемофилия В, мукополисахаридозы I и II типов, врожденный амавроз Лебера, пигментный ретинит, миодистрофия Дюшенна, врожденные нарушения слуха, недостаточность альфа-1-антитрипсина, нейрофиброматоз, транстиретиновый амилоидоз.
В конце лекции Светлана Смирнихина остановилась на такой неоднозначной теме, как CRISPR-Cas9-редактирование эмбрионов, и показала на примерах, почему этот подход не работает. Первая попытка была сделана в Китае еще в 2015 году. Эксперимент проводили на триплоидной зиготе, поскольку такие эмбрионы нежизнеспособны. С помощью CRISPR-Cas9 редактировали ген HBB, используя донорную молекулу, с которой должна была произойти рекомбинация. Анализ результатов показал, что у половины эмбрионов не произошло ничего, у трети эмбрионов произошел разрыв ДНК с негомологичным соединением концов, у 13% — гомологичная рекомбинация со вторым аллелем того же гена, и только у 7% результат был достигнут, то есть эффективность очень низкая. Вторая проблема состоит в том, что может возникнуть мозаицизм: часть клеток эмбриона будет отредактирована, часть — нет. Чтобы исключить мозаицизм, было предложено редактировать не эмбрионы, а половые клетки.
Развитие этого направления привело к рождению в 2019 году из отредактированных эмбрионов двух девочек. Китайский ученый Хэ Цзянькуй использовал CRISPR-Cas9, чтобы получить нокаут гена CCR5 и добиться невосприимчивости к ВИЧ-инфекции. Рождение этих девочек вызвало великое множество этических вопросов, касающихся в том числе ответственности за возможные негативные последствия и пр. В результате международная комиссия выпустила мораторий на применение методов редактирования в отношении наследуемого генома. К нему присоединились все страны, в том числе Китай. Таким образом, на сегодняшний день можно редактировать эмбрионы с исследовательской целью, можно отрабатывать методику, но переносить отредактированные эмбрионы женщине для рождения детей законодательно запрещено.
Вопрос, который Светлана Анатольевна вывела на последнем слайде: «Так что же такое геномное редактирование — панацея, модная штука или гибель человечества?» Не панацея — не все болезни оно может вылечить; не просто модная штука — гораздо больше; ну а чтобы исключить последнее, надо использовать его грамотно и с осторожностью.



 Меню
Меню





 Все темы
Все темы




 0
0






