МД-2023: Классификация генетических вариантов в онкологии
На конференции «Молекулярная диагностика 2023» прошли целых две секции по онкогенетике, и одна из них была посвящена классификации генетических вариантов. Как определить значимость неизвестного варианта в развитии опухоли? На какие клинические рекомендации следует ориентироваться? Что делать, когда результаты секвенирования не подтверждают наблюдаемую клиническую картину? Ответы на эти и многие другие вопросы — в этом материале.

Анастасия Жевлова
Фото:
Денис Зыбин
На какие рекомендации по классификации генетических вариантов в онкологии следует ориентироваться? Такой вопрос рассмотрел в своем докладе Дмитрий Михайленко из ФГБНУ «МГНЦ им. академика Н.П. Бочкова». Классификация генетических вариантов сейчас составляет одну из центральных проблем: вопрос о ней возникает, когда врач выписывает заключение и принимает решение о дальнейших назначениях и действиях. На сегодняшний день существует отечественный консенсус, который базируется на ряде принятых зарубежных рекомендаций. Вопросы классификации затрагивают герминальные и соматические мутации. Так, в диагностическом заключении указывают патогенные и вероятно патогенные генетические варианты. В связи с указанием варианта с неопределенной клинической значимостью (VUS) желательно давать пояснение: необходимо ли при его обнаружении провести сегрегационный анализ в семье, сделать функциональный тест или что-то еще. Кроме того, в заключении могут указывать патогенные/вероятно патогенные варианты в гене, который не является причиной данного заболевания. Такие указания также требуют пояснений — например, вариант может быть еще не описанной причиной болезни или указывать на другую наследственную патологию.
Оценка онкогенности соматических мутаций опирается на стандарты классификации, принятые в совместных рекомендациях Clinical Genome Resource (ClinGen), Cancer Genomics Consortium (CGC) и Variant Interpretation for Cancer Consortium (VICC) в 2022 году. Также существует целый ряд учебно-методических пособий и методических рекомендаций по динамическому наблюдению пациента с теми или иными наследственными онкологическими синдромами.

Схем и подходов к определению клинической значимости той или иной соматической мутации в настоящий момент существует много. Интерпретируя соматические варианты, следует ориентироваться не на отдельные базы данных, а подходить к вопросу комплексно. В практике встречались случаи, когда некоторые базы данных содержат противоречивые данные или информации недостаточно, тогда как в других мутация классифицируется как патогенная. Детальное рассмотрение поможет точнее установить, можно ли назначать конкретный класс препаратов пациенту, у которого обнаружен редкий вариант.
Более подробно критерии патогенности мутаций с потерей функции (LoF) рассмотрела Анастасия Жевлова. Критерий патогенности может быть очень сильный (PVS1), сильный (PS1-4), средний (PM1-5) или вспомогательный (PP1-5). Сложности в применении критерия PVS1 в оценке LoF мутаций состоят, в частности, в том, что они могут обладать разной значимостью. Не все варианты находятся в основных транскриптах, поэтому необходимо проверять, в каком именно транскрипте обнаружена мутация. Кроме того, не во всех генах LoF-варианты оказываются причиной заболевания. Интерпретация также зависит от расположения варианта внутри гена, и это подводит нас к тому, что при оценке патогенности мутации необходим индивидуальный подход и анализ.
В частности, LoF-варианты могут приводить к образованию транскриптов с преждевременным стоп-кодоном. Для удаления таких транскриптов в клетке существует система нонсенс-опосредованной деградации (NMD), однако не все мутантные транскрипты этой деградации подвергаются. При определении патогенности мутации важно учесть, будет ли проходить NMD (для предсказания этого существуют специальные инструменты), а также определить, насколько повреждение критично для функции белка и каков его размер.
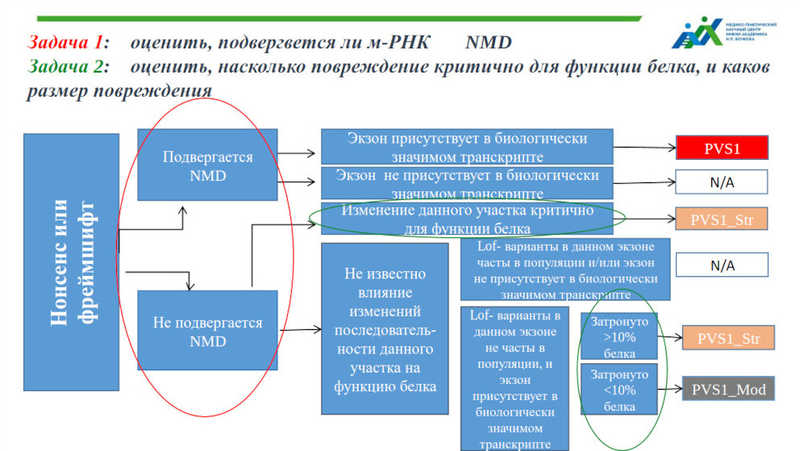
Аналогичный алгоритм приведен в современных клинических рекомендациях по определению патогенности и для других нарушений, например, потери стоп-кодона или альтернативного старта транскрипции. Тем не менее, докладчица подчеркнула важность индивидуального подхода и работы с литературными данными при работе с конкретным вариантом.
Также на секции рассмотрели применение популяционных критериев при интерпретации вариантов — им был посвящен доклад Татьяны Кекеевой. Таких критериев существует четыре: три в поддержку доброкачественности варианта (BA1, BS1, BS2) и один — патогенности (PM2). BA1 — очень сильный независимый критерий доброкачественности, который состоит в том, что популяционная частота варианта превышает 5%. Если же аллельная частота превышает ожидаемую для заболевания, в дело вступает критерий BS1 (сильный критерий доброкачественности). При определенных условиях сильным может быть также критерий BS2, который указывает на доброкачественность в случае, когда вариант встречается у здоровых людей. Оценка критериев BS1 и BS2 принципиальна для классификации патогенности часто повторяющихся вариантов. Критерий патогенности PM2 при этом является умеренным или поддерживающим. В качестве умеренного он используется, когда анализируемый вариант отсутствует в группе контроля (ее объем должен составлять не менее 50 тысяч человек). При встречаемости варианта у здоровых с частотой менее 0,002% этот критерий становится поддерживающим. Таким образом, при интерпретации варианта с опорой на популяционные критерии выше вероятность определить его как более доброкачественный.
При применении критериев, однако, следует учитывать некоторые важные моменты. Так, оценку BS1 желательно проводить на основании данных популяции того пациента, у которого обнаружен анализируемый вариант. Кроме того, при интерпретации варианта следует применять геноспецифичные критерии, поскольку пороговые уровни встречаемости для тех или иных генов могут отличаться.
Собственным опытом диагностики поделился Алексей Цуканов, который привел в качестве примера из практики случай семейного аденоматоза толстой кишки. В исследование включили семью, в которой у трех родственников этот диагноз был подтвержден, еще двое членов семьи были здоровы, и один человек не был обследован. Поиск новых патогенных вариантов выявил мутацию в гене NSUN7 у всех пораженных аденоматозом членов семьи. Однако — и здесь мы возвращаемся к применению критериев патогенности — частота встречаемости этого варианта в России по данным ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» составляет 0,2%. При этом случаи семейного аденоматоза толстой кишки встречаются один раз на 10000, и согласно существующим критериям найденный вариант нельзя считать патогенным для данного заболевания. Позже методом MLPA (мультиплексная лиганд-зависимая амплификация зонда) у пациентов выявили крупную перестройку, затрагивающую ген APC. Эчто согласуется с известными на сегодняшний день данными — патогенные варианты APC связаны с примерно 90% случаев семейного аденоматоза толстой кишки. Найденная делеция, как показали исследования на других пациентах, может рассматриваться как вероятно патогенная, однако ее обнаружение требует тщательного сопоставления с клиническими признаками, а также обязательного подтверждения наличия делеции референсным методом.
Тему критериев продолжила Ирина Демидова, рассказав о функциональных исследованиях для NGS-диагностики герминальных вариантов в онкологии. Она осветила проблему вариантов неясного клинического значения. К 2017 году в гене BRCA1 было описано около 5200 герминальных вариантов, в BRCA2 — более 6800. Их большую часть (1450 в BRCA1 и 2400 в BRCA2) составляют миссенс-варианты. По данным Clinvar, 88% таких вариантов в BRCA1 и 94% — в BRCA2 остаются классифицированными как VUS или варианты с неоднозначной интерпретацией.
Сегрегационный анализ вариантов неясного клинического значения затруднен по ряду причин. Так, многие варианты детектированы в одной или двух семьях, из-за чего сегрегационный анализ не имеет достаточной силы. Кроме того, в популяции могут возникать спорадические опухоли, не асоциированные с носительством герминального варианта. Также ассоциация VUS с заболеванием не гарантирует его возникновения, иными словами, не все носители варианта заболеют раком. Кроме того, сегрегационный анализ осложняется двойным (по линиям обоих родителей) носительством варианта.
Чтобы оценить повреждающее воздействие обнаруженного варианта на белок, проводятся функциональные исследования. Подходы к ним во многом зависят от основных функций генов. Кроме того, они связаны с особенностями изучаемых белков. Например, самые распространенные методы изучения BRCA1 направлены на полноразмерный белок, тогда как в случае BRCA2 это затруднено его большим размером, и большее распространение получила характеризация отдельных последовательностей.
Функциональные исследования белка можно проводить на разных уровнях (например, в клеточных или бесклеточных системах или in vivo), и каждый из подходов обладает своими особенностями и ограничениями. При оценке их валидности критично оценивать корректность постановки эксперимента, а также учитывать основные метрики — чувствительность и специфичность (допустимая граница составляет 80–85%). В качестве контролей важно использовать как референсную последовательность, так и известные патогенные и непатогенные варианты.
Александр Друй посвятил доклад интерпретации генетических вариантов в детской онкологии. Интерпретировать соматические и герминальные варианты следует по-разному, поэтому первым этапом становится определение того, к какой категории относится анализируемый вариант. Золотой стандарт в этом определении — секвенирование конституциональной ДНК пациента. Заподозрить герминальный или потенциально герминальный вариант можно на основании доли альтернативного аллеля — вряд ли речь идет о герминальной мутации при частоте аллеля, например, 1015%. Также важно учитывать сам ген, тип варианта и его локализацию в кодирующей последовательности. Кроме того, отличить категорию мутации помогут и фенотипические показатели. Например, обнаруженная мутация в CTNNB1 практически наверняка будет соматической, поскольку носители герминального варианта обладают очень характерным патологическим фенотипом и редко доживают до двух-трех лет. Другим примером служат мутиации в NRAS — герминальный вариант замены в этом белке обуславливает синдром Noonan 6, тогда как при соматической мутации белок выступает в роли онкогена.
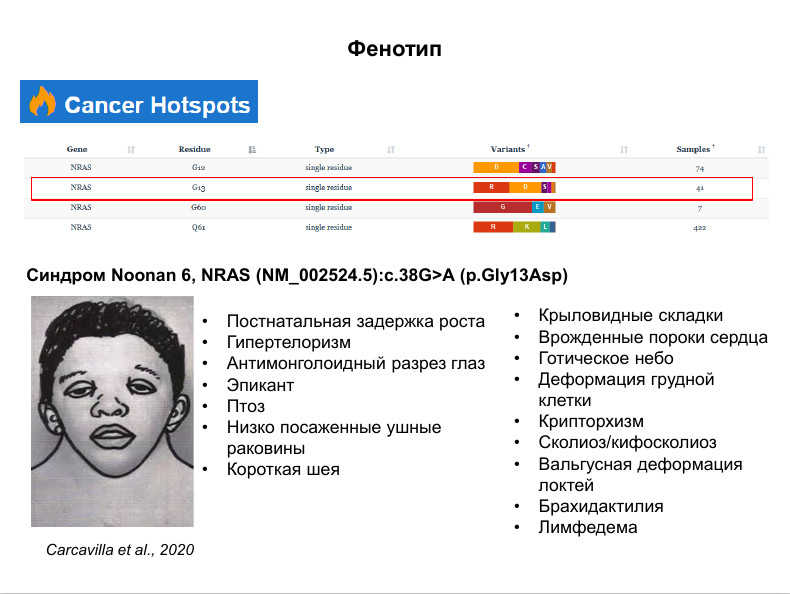
Клинически значимые варианты не ограничиваются небольшими изменениями в нуклеотидной последовательности, но также включают химерные конструкции или вариации числа копий гена (CNV). Кроме того, диагностическим маркером может служить измененный профиль метилирования. (Подробнее об анализе паттернов метилирования рассказывали на секции, посвященной молекулярно-генетическим исследованиям в онкологии.)
У фенотипического анализа есть и обратная сторона, которая проявляется на другом уровне. Разные опухоли могут иметь схожий фенотип, например, при гистологическом анализе, что подчеркивает важность использования молекулярных маркеров при исследовании опухоли. Стоит, однако, помнить, что клиническое значение маркера может зависеть от опухолевого молекулярного контекста.
Но не всегда результаты генетического тестирования позволяют объяснить происхождение опухоли. Встречаются случаи, когда у пациента диагностируют признаки наследственного опухолевого синдрома, а секвенирование дает отрицательный результат. О том, почему это происходит и как быть в такой ситуации, рассказала Татьяна Лисица. Наследственный опухолевый синдром характеризуют, в частности, ранний возраст возникновения опухолей, их множественность, а также отягощенность семейного анамнеза. При такой клинической картине можно заподозрить наличие у пациента мутаций, ассоциированных с заболеванием, и направить его на генетическое исследование. В ряде случаев секвенирование таких мутаций не выявляет.
Причиной могут быть, например, проблемы дизайна панели — отдельные регионы в гене могут не покрываться секвенированием. Кроме того, причиной развития заболевания может стать интронный вариант, который также не затрагивается панелью — в таком случае требуются дополнительные исследования. Также детекцию вариантов может затруднить наличие псевдогена, поэтому при анализе стоит тщательно подходить к данным картирования прочтений, например, включать в расчет различные веса для неоднозначных выравниваний. Кроме того, проблему могут создавать протяженные инсерции или делеции в гене, которые не всегда выявляются выбранным методом секвенирования. Встречаются и варианты, когда ген, ответственный за развитие патологического фенотипа, не исследован и не входить в панель. Наконец, в ряде случаев опухоль может все-таки оказаться спорадической.
Таким образом, столкнувшись с ситуацией, когда заподозренный у пациента наследственный опухолевый синдром не подтверждается данными секвенирования, стоит тщательно проанализировать клиническую картину, а также провести ревизию данных NGS. В ряде случаев имеет смысл продолжить тестирование: дополнительно исследовать непокрытые участки, расширить панель или провести исследование другим методом, например, применив MLPA. Такую возможность следует обсудить с пациентом и предложить ему подобный вариант.
Людмила Спирина поделилась результатами проекта по секвенированию пациентов с раком желудка. До 80% пациентов диагностируются на III-IV стадии заболевания из-за бессимптомности течения и отсутствия скрининговых программ. Помимо оперативного вмешательства, в течение года после которого опухоль прогрессирует в 50% случаев, для лечения пациентов применяют химио- и иммунотерапию. Последняя направлена на контрольные точки иммунитета (препарат пембролизумаб) или на Her2 (препарат трастузумаб) в зависимости от молекулярного статуса опухоли.
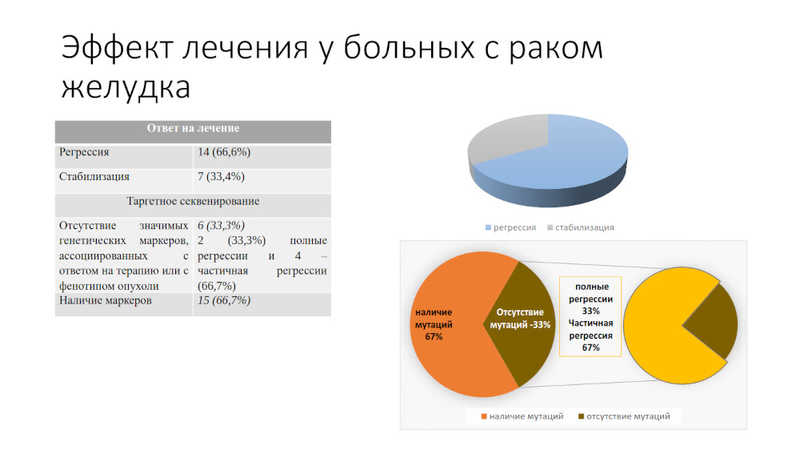
Чтобы определить, как в дальнейшем можно улучшить подходы к терапии рака желудка, было проведено исследование на небольшой (21 человек) когорте пациентов. В рамках исследования провели таргетное секвенирование с применением ампликонной панели ONCONETIX, включающей 48 генов. У нескольких пациентов выявили множественные мутации, ассоциированные с регрессией или стабилизацией в ответ на лечение. Так, при регрессии у участников исследования встречались мутации в генах PTEN и ERBB либо PTEN и PIK3CA. Стабилизация была ассоциирована с двойными и тройными мутациями: в p53, PIK3CA и SMAD4, либо KRAS и PIK3CA, либо PTEN и CTNNB1. Опухоли, положительные по PD-L1, характеризовались множественными и разнообразными мутациями в трансформированных клетках. Анализ молекулярных характеристик опухоли, таким образом, показал, как генетический ландшафт опухоли может вносить вклад в вариабельность ответа на комбинированное лечение рака желудка.
Доклад, который представила Юлия Жусина, был посвящен одной из проблем интерпретации соматических вариантов в опухолях. Достаточно ли для опухолевых биомаркеров первого уровня одобрения FDA, полученного на основе конкретного клинического исследования?
Если критерии CMG для герминальных вариантов достаточно четко отражают причинно-следственную связь находки с обнаруженным вариантом и позволяют поставить диагноз, то критерии первого уровня по классификации AMP не всегда отражают клиническую пользу биомаркера. Ее учитывает только классификация ESCAT (ESMO Scale for Clinical Actionability of molecular Targets). В перспективе она планирует решить ряд недостатков AMP, связанных со следующими вопросами. В частности, при анализе соматических вариантов важно понимать, было ли адекватным лечение контрольной группы в исследовании, на данные которого опирается классификация. Кроме того, необходимо оценивать, соответствуют ли результаты исследования изначальному дизайну — встречаются случаи, когда проводилось исследование превосходства (superiority trial), а выводы сообщают о том, что обе тактики лечения эффективны, но одна из них менее токсична для пациента. К возможным недостаткам исследований также можно отнести неадекватность лечения после прогрессирования заболевания. Учитывать необходимо и корректность post hoc подгруппового анализа, основанного на биомаркерах.
Приведенное в докладе исследование показало: за 2006–2020 на основании 92 генетических маркеров было одобрено 53 препарата, и две трети из них получили одобрение по суррогатным конечным точкам — частоте ответа и беспрогрессивной выживаемости пациентов. Только один из семи одобренных таким образом препаратов улучшал общую выживаемость.
Следующие два доклада были посвящены рассмотрению случаев из практики частных генетических центров. В первом из них Дарья Хмелькова (центр «ГЕНЕТИКО») рассказала о тонкостях интерпретации данных секвенирования при наследственных опухолевых синдромах. Эти моногенные заболевания характеризуются сравнительно поздним возрастом начала и предположительно сниженной пенетрантностью. Из этого следует, во-первых, присутствие носителей патогенных вариантов в контрольных популяционных выборках, а во-вторых, сложности анализа косегрегации. Последние объясняются тем, что у старших родтсвенников заболевание могло не проявиться, кроме того, их может уже не быть в живых.
Наследственный опухолевый синдром чаще всего ассоциирован с заболеваниями в генах-онкосупрессорах, это могут быть LoF мутации или CNV. Сообщение вариантов в заключении ведет к принятию клинических решений, что может сказываться на плане лечения пациента и обследовании его семьи. Важный момент здесь — интерпретация VUS. По результатам NGS очень важна консультация врача-генетика, который сможет адекватно оценить VUS, опираясь на критерии патогенности в том числе с учетом особенностей популяции и характерной для нее частоты встречаемости варианта. Следует помнить, что всегда присутствует вероятность неверной интерпретации результатов, и в работе с миссенс-вариантами есть смысл соблюдать «презумпцию невиновности», чтобы не переоценить их патогенность для данного случая. В качестве примера докладчица привела несколько исследований, по данным которых большая часть (около 75%) проанализированных в работах VUS были реклассифицированы как безвредные.
Владислав Милейко («Онкодиагностика АТЛАС») поделился опытом интерпретации герминальных и соматических мутаций. Как уже упоминалось в рамках секции, интерпретация опухолевых вариантов опирается на базы данных и ген-специфичные руководства. В онкологии достаточно остро стоит вопрос, где от интерпретации лабораторного специалиста следует перейти к интерпретации клинициста.
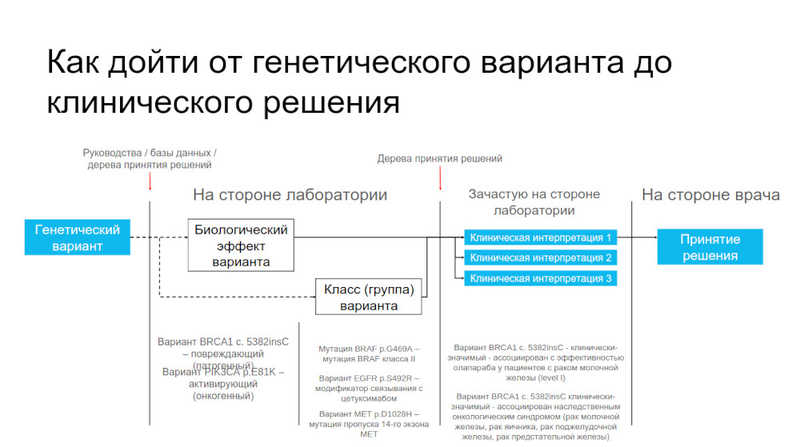
Чтобы обеспечить грамотную интерпретацию, при обнаружении варианта данные о нем рекомендуется предоставлять вместе с информацией о его влиянии на биологическую функцию, герминальной или соматической природе и рядом других деталей, которые позволят специалисту самостоятельно оценить сделанные сотрудником лаборатории выводы. Перспективный подход — это дополнение генетического тестирования опухоли in silico исследованием, которое позволит предсказать природу варианта и его онкогенность. Кроме того, производитель тест-систем и алгоритмов, обеспечивающих классификацию варианта должен разделять с лабораторией ответственность за результаты исследования.
Информация о докладчиках
Михайленко Дмитрий Сергеевич, к.м.н., ФГБНУ «МГНЦ им. академика Н.П. Бочкова», г. Москва
Жевлова Анастасия Игоревна, ФГБНУ «МГНЦ им. академика Н.П. Бочкова», г. Москва
Кекеева Татьяна Владимировна, к.м.н., ФГБНУ «МГНЦ им. академика Н.П. Бочкова», г. Москва
Цуканов Алексей Сергеевич, д.м.н., ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» Минздрава России
Демидова Ирина Анатольевна, к.м.н., ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
Друй Александр Евгеньевич, к.м.н., ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России, г. Москва
Лисица Татьяна Сергеевна, ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА России, г. Москва; ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, г. Москва
Спирина Людмила Викторовна, д.м.н., ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук», г. Томск; ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России, г. Томск
Жусина Юлия Геннадьевна, Медико-генетический центр «Геномед»
Хмелькова Дарья Николаевна, Центр генетики и репродуктивной медицины «ГЕНЕТИКО»
Милейко Владислав Айкович, «Онкодиагностика АТЛАС»


 Меню
Меню





 Все темы
Все темы




 0
0