Определены изменения в макрофагах при воспалении головного мозга
Исследователи из Брюссельского университета проанализировали изменения в мозге во время воспаления, вызванного паразитарной инвазией. Они показали, как разные типы макрофагов управляют иммунным ответом, а также выяснили, что ответ на инфекцию резидентных и рекрутированных макрофагов имеет различную динамику во время инфекции и после выздоровления.
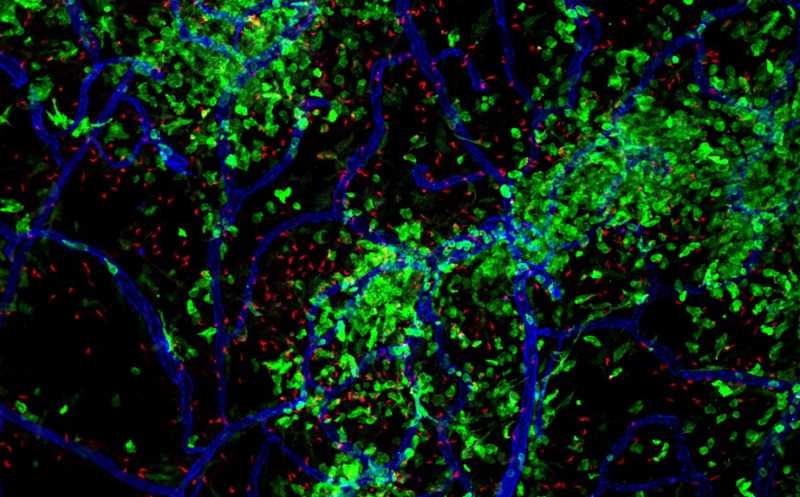
Исследователи из Брюссельского свободного университета вместе с коллегами из других научных центров решили изучить реакцию микроглии, пограничных макрофагов и рекрутированных макрофагов на воспаление в нервной ткани мозга, вызванное паразитическим простейшим Trypanosoma brucei.
С точки зрения иммунологии мозг можно разделить на три компартмента. Первый включает в себя пограничные органы с пронизанным порами эндотелием, такие как твердая оболочка, сосудистое сплетение и циркумвентрикулярные органы, обеспечивающие коммуникацию между кровью и мозгом и трафик иммунных клеток. Второй компартмент содержит спинномозговую жидкость и отделен от первого барьером эпителиоцитов и фибробластов — иммунные клетки могут попасть туда только при определенных обстоятельствах. Третий и самый иммунологически привилегированный компартмент ─ паренхима, где находятся функциональные ткани мозга. Она отделена от спинномозговой жидкости барьером из астроцитов в субдуральном и периваскулярном пространствах и эпиндимой (клетками, выстилающими желудочки). Пограничные участки мозга, которые могут контактировать с кровью, содержат разнообразные иммунные клетки, а в паренхиме содержатся в основном макрофаги.
Тканевые резидентные макрофаги — ключевые регуляторы развития мозга, поддержания гомеостаза в нем. Макрофаги в паренхиме называются микроглией, а в непаренхимальной ткани ─ пограничными макрофагами (border-associated macrophages, BAM). Микроглия и BAM имеют различия в экспрессии ключевых генов. Особенности реакции микроглии на воспаление неоднократно исследовались, однако функционирование BAM во время болезни до сих пор до конца не изучено. Кроме того, при воспалении в мозг могут привлекаться моноциты из крови и превращаться в рекрутированные макрофаги. Отличия их от BAMs и микроглии также остаются неизвестными.
Для моделирования нейровоспаления авторы работы инфицировали мышей T. brucei. Путем количественного определения паразитов в разных компартментах мозга учёные проследили, как трипаносома проникает в мозг, инфильтрируя поэтапно пограничные участки, цереброспинальную жидкость и паренхиму. Параллельно этому инвазия паразитов приводила к дезинтеграции барьеров мозга и инфильтрации тканей периферическими миелоидными клетками.
Секвенирование единичных клеток показало, что рекрутированные макрофаги отличаются от активированной резидентной микроглии по своему воспалительному статусу. Они проявляли большую транскрипционную пластичность, адаптируя экспрессию антимикробных генов.
Пространственное положение рекрутированных макрофагов определяли с помощью серийной двухфотонной томографии. Оказалось, что микроглияподобные клетки при воспалении аккумулируются на границе между кровью и цереброспинальной жидкостью в сосудистом сплетении. Применение метода fate mapping совместно с секвенированием единичных клеток подтвердило наличие микроглия-подобных клеток вокруг желудочков и в месте разрастания клеток Колмера (эпиплексусных макрофагов), а также показало наличие транскрипционных расхождений между резидентными и рекрутированными макрофагами.
В эксперименте с истощением резидентных макрофагов и использованием генетического таргетирования было обнаружено, что резидентные макрофаги осуществляют первичную защиту, заключающуюся в провоспалительном ответе, увеличении проницаемости барьеров мозга и привлечении периферических иммунных клеток.
Также было проанализировано состояние иммунной системы после ослабления симптомов заболевания на фоне лечения меларсопролом. Рекрутированные макрофаги при этом быстро покидали мозг, а резидентные возвращались к своему привычному гомеостатическому состоянию. «Мы были поражены тем, как быстро рекрутированные кровью макрофаги удалялись из мозга, как только уничтожались паразиты. Это подчеркивает, насколько важно, чтобы мозг быстро возвращался в нормальное состояние после того, как с инфекцией покончено», — говорит руководитель работы профессор Киаваш Мовахеди.
Долгосрочные транскрипционные изменения были нехарактерны для микроглии, но наблюдались среди BAM, обеспечивая у них иммунологическую память, которая способна изменить реакцию на будущие инфекции.
Таким образом, бельгийские ученые обнаружили различия в механизмах действия и ответах на воспаление микроглии, пограничных и резидентных макрофагов. Дальнейшее изучение транскрипционных и генетических механизмов изменений в резидентных макрофагах может сформировать новые представления о возможных терапевтических стратегиях, устраняющих дисфункции мозга после инфекций и воспалений.
Генная терапия уменьшает повреждения мозга у мышей при черепно-мозговой травме
Источники
Vlaminck K. D., et al. Differential plasticity and fate of brain-resident and recruited macrophages during the onset and resolution of neuroinflammation. // Immunity, published on October 12, 2022. DOI: 10.1016/j.immuni.2022.09.005
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








