Препарат, редактирующий ген в клетках печени, снижает уровень «плохого» холестерина в крови
Объявлены первые результаты клинического исследования препарата VERVE-102 компании Verve Therapeutics. Редактор оснований селективно доставляется в клетки печени и инактивирует ген белка PCSK9, который вызывает деградацию рецептора липопротеинов низкой плотности (ЛПНП). В исследовании участвовали 14 человек с гетерозиготной семейной гиперхолестеринемией и преждевременной ишемической болезнью сердца. Уровень связанного с ЛПНП холестерина в крови снизился в среднем на 53%, а максимальное снижение при наибольшей дозировке достигло 69%.
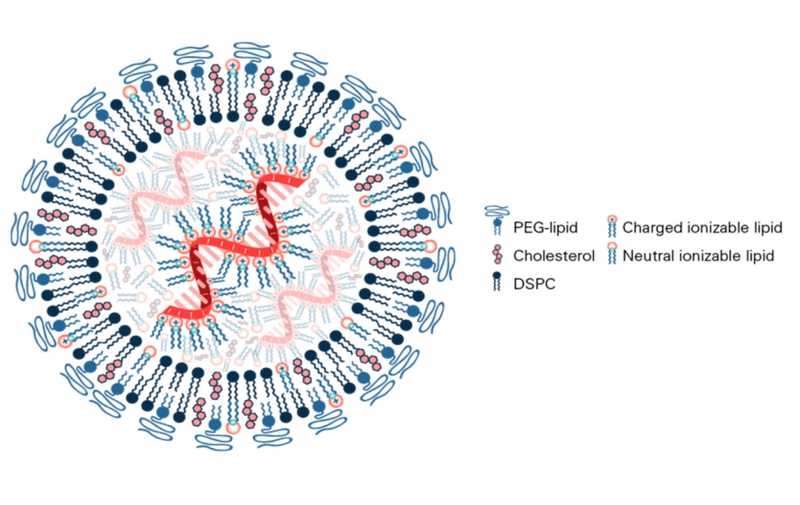
Компания Verve Therapeutics объявила о предварительных результатах фазы 1b клинического испытания препарата VERVE-102. Генотерапевтический препарат на основе CRISPR, вносящий исправление в ген in vivo (в организме пациента), снижает уровень холестерина липопротеинов низкой плотности (Х-ЛПНП) в крови. В фазе 1b клинического испытания Heart-2 участвуют пациенты с гетерозиготной семейной гиперхолестеринемией (HeFH) и (или) преждевременной ишемической болезнью сердца (признаки ИБС у мужчин не старше 55 лет и женщин не старше 65 лет); обеим группам пациентов необходимо снижение Х-ЛПНП.
Семейная гиперхолестеринемия— это наследственное генетическое заболевание, которое приводит к высокому уровню холестерина, в том числе связанного с ЛПНП, и способствует развитию тяжелых сердечно-сосудистых заболеваний в возрасте 20–30 лет. Существует множество мутаций, вызывающих семейную гиперхолестеринемию, — в основном это мутации в LDLR (гене рецептора ЛПНП, необходимого для их поглощения), но причиной могут быть и мутации в других генах. Мутации усиления функции в гене PCSK9 встречаются относительно редко, но в то же время PCSK9 (пропротеиновая конвертаза субтилизин-кексинового типа 9) — одна из наиболее перспективных мишеней для терапии, снижающей ЛПНП-Х.
PCSK9 — пропротеиновая конвертаза, то есть фермент, который активирует другие ферменты, отщепляя от них пептид, ингибирующий их каталитическую активность. Кроме того, он вызывает деградацию рецептора ЛПНП вместо его возвращения на мембрану после эндоцитоза ЛПНП, таким образом, на фоне его повышенной активности уровень Х-ЛПНП возрастает. Существует несколько естественных мутаций, инактивирующих этот ген: у таких людей, напротив, чрезвычайно низкий уровень холестерина, очень хорошие сердечно-сосудистые профили и при этом нет очевидных осложнений, связанных с этой мутацией.
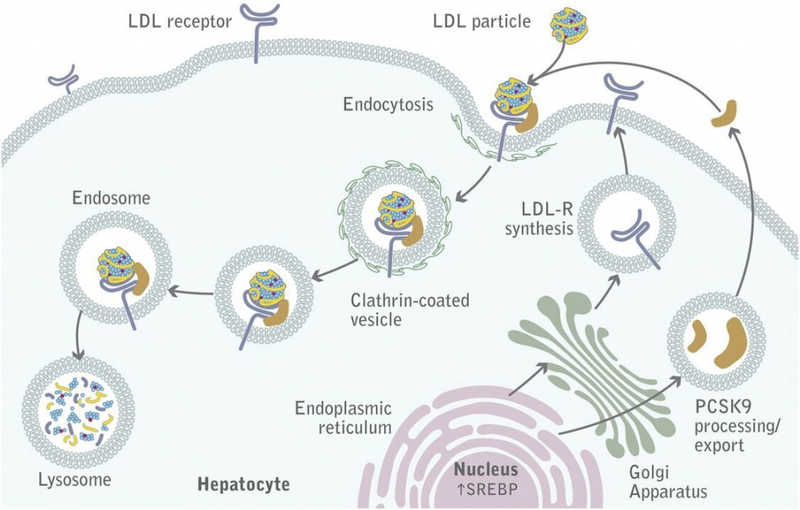 Взаимоотношения рецептора ЛПНП и белка PCSK9. Инактивация PCSK9 с помощью моноклонального антитела или воздействие киРНК или антисмыслового олигонуклеотида (ASO) на его мРНК способствует появлению рецептора на мембране и снижению уровня ЛПНП в крови. Аналогичный эффект может оказать редактирование гена PCSK9 в ядре. Credit:
Wikimedia |
CC BY 4.0
Взаимоотношения рецептора ЛПНП и белка PCSK9. Инактивация PCSK9 с помощью моноклонального антитела или воздействие киРНК или антисмыслового олигонуклеотида (ASO) на его мРНК способствует появлению рецептора на мембране и снижению уровня ЛПНП в крови. Аналогичный эффект может оказать редактирование гена PCSK9 в ядре. Credit:
Wikimedia |
CC BY 4.0
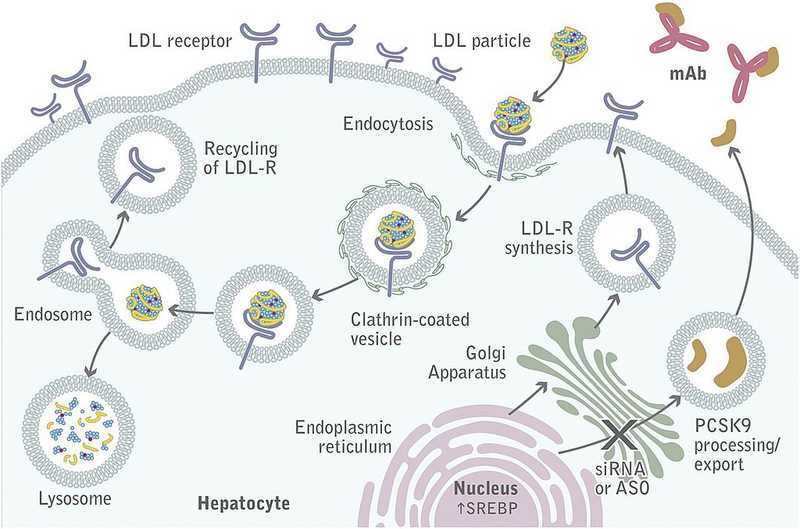
У PCSK9 нет традиционного сайта связывания малых молекул, тем не менее на рынке есть моноклональные антитела, нацеленные на этот белок. Препарат инклисиран на основе короткой интерферирующей РНК (киРНК, siRNA) —разрабатывается дочерней компанией Novartis, The Medicines Company, которая получила лицензию от Alnylam Pharmaceuticals, ведущего разработчика препаратов на основе интерферирующей РНК.
VERVE-102 — это препарат для редактирования генов. Одна его доза навсегда отключает ген PCSK9 в клетках печени, и таким образом достигается долговременное снижение уровня Х-ЛПНП. VERVE-102 содержит матричную РНК (мРНК) аденинового редактора оснований и направляющую РНК, нацеленную на ген PCSK9. Редакторы оснований, в отличие от «обычных» CRISPR-Cas-редакторов, не разрезают нити ДНК, а модифицирует азотистое основание, что приводит к замене «буквы»-нуклеотида, например, как в данном случае, А на G.
Активные компоненты, инкапсулированные в липидную наночастицу, вводятся внутривенно в виде инфузии, которая занимает два-четыре часов.
PCR.news в 2021 году писал о результатах испытаний этого подхода на обезьянах. В 2022 году Verve Therapeutics объявила о начале клинических исследований препарата VERVE-101 для редактирования in vivo в клетках печени того же гена PCSK9. Сообщалось, что препарат содержит матричную РНК аденинового редактора оснований, лицензированного компанией Beam Therapeutics (статья 2020 года об этой технологии).
Результаты были многообещающими, однако год назад компания объявила о приостановке набора в первую фазу исследования из-за побочных эффектов. (У одного из шести пациентов, получавших VERVE-101 в дозе 0,45 мг/кг, вырос уровень фермента печени АЛТ и снизился уровень тромбоцитов при отсутствии других симптомов.) Отклонения в лабораторных показателях исчезли самостоятельно в течение нескольких дней, однако Verve Therapeutics переключилась на обновленную версию препарата, VERVE-102.
Вторая версия отличается от первой по двум характеристикам липидных наночастиц. В их состав входит другой ионизируемый липид (катионный ионизируемые липиди — ключевые компоненты липидных наночастиц), а новая запатентованная технология доставки GalNAc-LNP от Verve Therapeutics обеспечивает проникновение липидных наночастиц в гепатоциты через рецептор липопротеинов низкой плотности или рецептор асиалогликопротеина.
GalNAc (N-ацетилгалактозамин) сейчас активно используется в генной терапии in vivo, так как селективно связывается с рецептором ASGPR на клетках печени. С его помощью, например, компания Alnylam осуществляет доставку своих киРНК, а Wave Life Sciences, которая в октябре прошлого года сообщила об успешном терапевтическом редактировании мРНК при дефиците альфа-1-антитрипсина (AAT), — комплементарный олигонуклеотид, вызывающий редактирование. В обоих случаях доставляется конъюгат GalNAc-РНК.
Итак, 14 участников фазы 1b клинического Heart-2, по которым представлены данные, получали VERVE-102 в трех вариантах дозировки (0,3 мг/кг, 0,45 мг/кг и 0,6 мг/кг). Они хорошо переносили терапию, серьезных нежелательных явлений (SAEs), связанных с лечением, или клинически значимых отклонений лабораторных показателей, ни у кого не наблюдалось. Наблюдение продолжалось не менее 28 дней.
Однократная инфузия VERVE-102 вызывала дозозависимое снижение уровней белка PCSK9 в и Х-ЛПНП в крови. Среднее снижение Х-ЛПНП в крови составило 53%, а максимальное — 69%. (Максимальное снижение наблюдалось у четырех участников, получавшей дозу 0,6 мг/кг.)
В настоящее время клиническое исследование Heart-2 набирает участников в четвертую когорту, участники которой получат в дозе 0,7 мг/кг, в Великобритании, Канаде, Израиле, Австралии и Новой Зеландии. На 7 апреля 2025 года Verve два человека уже получили препарат в этой дозировке, и ранние лабораторные и клинические данные подтверждают ее безопасность.
Verve заключает соглашение о сотрудничестве по препаратам, таргетирующим PCSK9, с Eli Lilly and Company, и рассчитывает получить решение от Lilly во второй половине 2025 года.
Одиннадцатого апреля Verve Therapeutics получила от FDA разрешение на ускоренную регистрацию (Fast Track Designation) VERVE-102. Этот статус призван облегчить разработку и внедрение препарата.
Редактирование оснований in vivo позволило выжить мышам, зараженным прионами
Источник
Verve Therapeutics Announces Positive Initial Data from the Heart-2 Phase 1b Clinical Trial of VERVE-102, an In Vivo Base Editing Medicine Targeting PCSK9 // Verve Therapeutics. Apr 14, 2025


 Меню
Меню





 Все темы
Все темы




 0
0







