Редактирование оснований в стволовых клетках крови против бета-гемоглобинопатий
В Nature Medicine вышла статья о терапии бета-гемоглобинопатий (бета-талассемии и серповидноклеточной анемии) на основе редактирования генома стволовых клеток крови. Отредактировав отдельные нуклеотиды в геноме этих клеток, авторы включили в них синтез фетального гемоглобина, что должно смягчить симптомы болезни.
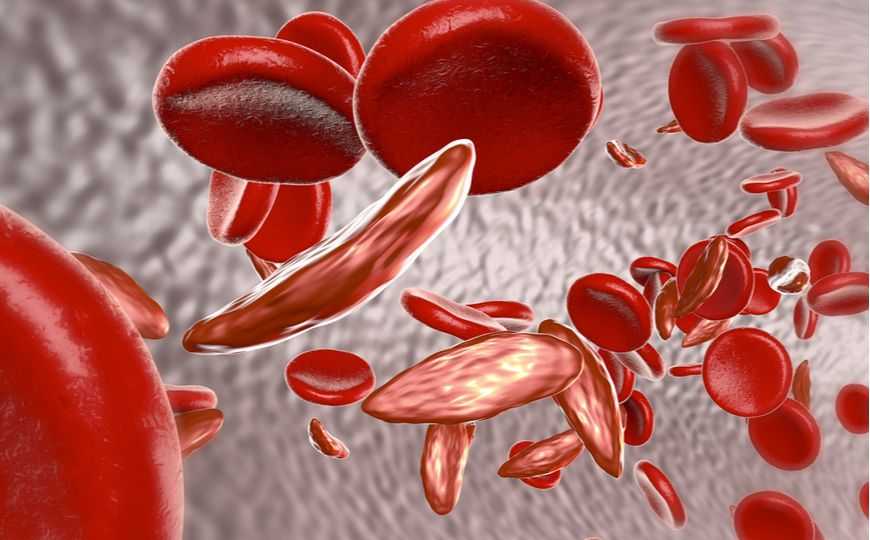
Программируемое редактирование генома гематопоэтических стволовых клеток на данный момент активно исследуется с целью создания методов терапии гематологических заболеваний, в том числе бета-гемоглобинопатий. Мишенью часто является ген BC11LA (B-cell lymphoma/leukemia 11A). Этот ген кодирует регуляторный белок, который связывается с ДНК и, в частности, подавляет продукцию фетального гемоглобина. С другой стороны, восстановление продукции гемоглобина F может улучшить состояние больных с серповидноклеточной анемией и бета-талассемией. В августе 2019 года компании Vertex Pharmaceuticals и CRISPR Therapeutics впервые применили технологию CRISPR-редактирования под названием CTX001 для лечения серповидноклеточной анемии (подробнее в Итогах года на PCR.news). Мишенью был ген BC11LA в стволовых клетках крови пациента.
Чтобы снизить продукцию белка BC11LA, можно воздействовать не на сам ген, а на его энхансер, например, внося в него инделы с помощью CRISPR. Но есть альтернативный путь — редактирование оснований, то есть замена азотистого основания в последовательности ДНК без разрезания нуклеотидной цепи с помощью ферментов нуклеотиддезаминаз, направляемых в нужный участок генома таким же образом, как это делается для CRISPR с нуклеазной активностью.
Такой вариант предложили исследователи из Института Брода и Гарвардской медицинской школы с соавторами. Они заменяли цитозиновые основания в энхансере гена BC11LA клеток эритроидного ряда (предшественников эритроцитов). Для этого использовали редактор оснований A3A (N57Q)-BE3, который вводили в клетки методом электропорации вместе с гидРНК. Исследования были проведены на CD34+ гемопоэтических стволовых клетках из периферической крови здоровых пациентов, пациентов с бета-талассемией и серповидноклеточной анемией.
Биаллельное редактирование цитозина в определенном положении (замена на T или G) приводило к индукции фетального гемоглобина в клетках, полученных от больных, такой же, как и нуклеазное редактирование с возникновением инделов. Морфология эритроцитов после редактирования приближалась к норме.
Исследователи обнаружили, что для успешной замены оснований необходима более высокая концентрация рибонуклеопротеина, содержащего редактор оснований и гидРНК, нежели системы Cas9, но при нескольких повторных циклах электропорации эффективность замены становится выше, хотя понижается выживаемость гематопоэтических клеток.
Кроме редактирования оснований в энхансере BC11LA, исследователи корректировали мутацию в промоторе гена бета-гемоглобина −28A>G (T>C на комплементарной цепи), широко распространенную в Китае. Однако наряду с терапевтическими исправлениями наблюдались и нетерапевтические, и неотредактированные аллели. Эти результаты говорят о том, что перспективу терапевтического применения метода может улучшить усовершенствованная система доставки или увеличение эффективности редактирования.
Авторы работы проверили свой метод на генотоксичность, то есть на замены в участках генома, схожих с мишенью. Было обнаружено два таких участка, в которых произошла неспецифическая замена, однако оба они находились вне кодирующей зоны и никак не влияли на жизнедеятельность клеток. Частота офтаргетных мутаций составила около 2–7 %.
Исследователи отмечают, что для дальнейшей разработки терапии с помощью редактора оснований до применения в клинических разработках необходимо провести более точный и подробный анализ возможной генотоксичности.
Источник
Jing Zeng, et al. // Therapeutic base editing of human hematopoietic stem cells. // Nature Medicine, 2020; DOI: 10.1038/s41591-020-0790-y


 Меню
Меню





 Все темы
Все темы



 0
0