Рецептор AHR защищает легкие при инфекции
AHR — рецептор ароматических углеводородов — функционирует как транскрипционный фактор. Британские ученые показали, что при вирусной инфекции AHR защищает легкие. В частности, он не дает повыситься проницаемости сосудов и предотвращает инфильтрацию эритроцитов и лейкоцитов в легкие. Лиганды AHR попадают в организм с пищей, так что модификация диеты может предотвратить снижение активности AHR после инфекции и повысить устойчивость к повторным заболеваниям.
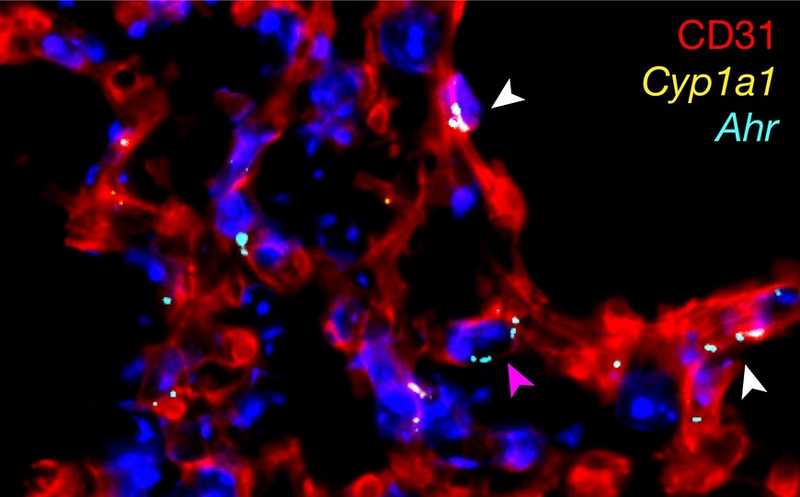
Мышиные легкие. Эндотелиальные клетки обозначены красным, ядра — синим, AHR — голубым, а Cyp1a1 — желтым.
Credit:
Jack Major, Nature (2023) | Пресс-релиз
Ответ организма на инфекцию чаще всего рассматривают с точки зрения иммунных клеток. Однако в последнее время все больше внимания уделяется не-иммунным клеткам, находящимся в барьерных тканях, таких как ткани легких. В новой работе британские ученые показали, что активность рецептора AHR в клетках сосудистого эндотелия легких защищает ткани легкого при инфекции, а также предотвращает патологическое повышение проницаемости сосудов и инфильтрацию красных кровяных клеток и лейкоцитов в альвеолы.
AHR (aryl hydrocarbon receptor) — это рецептор ароматических углеводородов, функционирующий как транскрипционный фактор. AHR отвечает за поддержание барьерной функции кишечника и легких, однако механизм его работы в легких до сих пор не был до конца понятен.
Активность AHR и CYP1A1 (фермента, активируемого AHR) в легких была подтверждена при помощи флуоресцентных меток. AHR экспрессировался во всех типах клеток, сильнее всего — в CD31+ эндотелиальных клетках. В то же время активность CYP1A1 была показана преимущественно в эндотелии сосудов легких с низкими уровнями экспрессии в других клетках. Экспрессия обоих белков в CD31+ эндотелиальных клетках была дополнительно подтверждена количественным ПЦР.
Для изучения связи активности AHR и ответа организма на инфекцию авторы использовали Cyp1-/- мышей, у которых отсутствуют три белка семейства CYP1, включая CYP1A1. Из-за отсутствия этих ферментов организм не способен метаболизировать лиганды AHR, что повышает его активность. Данное явление было подтверждено in vitro перед переходом к экспериментам с мышиными моделями. Мышей заражали вирусом гриппа А штамм X31.
Cyp1-/- мыши оказались более устойчивыми к связанной с инфекцией проницаемости сосудов, что было видно по меньшему количеству эритроцитов и иммунных клеток в альвеолах легких. Также снижался уровень маркеров повреждения легких, таких как альбумин в бронхоальвеолярном лаваже. При этом изменений в вирусной нагрузке в сравнении с мышами дикого типа не наблюдалось. У Cyp1-/- животных были ниже смертность и воспалительный ответ на инфекцию. Такие же результаты наблюдались при заражении животных другим штаммом вируса — Cal09 (H1N1).
Чтобы понять, как отсутствие AHR повлияет на организм, ученые получили рекомбинантных мышей с таргетной делецией AHR в эндотелиальных клетках сосудов при помощи Cre-рекомбиназы. У рекомбинантных мышей в ответ на вирусную инфекцию возросла проницаемость сосудов и инфильтрация клеток крови в легкие, также наблюдались более выраженные повреждения легких, включая утолщение плевры.
Для более подробного изучения механизмов работы AHR авторы провели РНК-секвенирование эндотелиальных CD31+ клеток легких рекомбинантных мышей и мышей дикого типа до и после инфекции. До инфекции данные всех животных кластеризовались вместе. Однако после заражения вирусом рекомбинантные мыши разительно отличались от дикого типа по профилю экспрессии. Изменилась экспрессия сигнальных путей ответа на клеточный стресс, метаболизма и клеточной гибели.
Авторы также проанализировали транскриптом эпителиальных клеток легких. Оказалось, что делеция AHR влияет и на экспрессию генов в эпителии, но тоже только после вирусной инфекции. Исследователи отдельно отмечают повышение экспрессии генов, связанных с апоптозом и кератинизацией в эпителиальных клетках у рекомбинантных мышей. Такой профиль экспрессии ассоциирован с образованием кератинизированных участков в легких, что нарушает газообмен.
У рекомбинантных мышей также наблюдалось нарушение апелинового сигналинга, который контролирует в том числе кровяное давление и развитие новых сосудов. Дальнейшие опыты показали, что фармакологическая блокада активности апелина приводила к тому же эффекту, что и делеция AHR. Это говорит о том, что эффект AHR на проницаемость сосудов и защиту тканей легкого обеспечивается через влияние на сигнальный путь апелина.
Наконец, авторы заметили, что уровень активности AHR падает после перенесенной инфекции. Так как большинство лигандов AHR поступают с пищей, исследователи предположили, что падение активности рецептора связано с нарушением питания, ассоциированным с инфекцией. Действительно, кормление мышей пищей, богатой лигандами AHR, восстанавливало активность рецептора и повышало устойчивость к повторным инфекциям.
Таким образом, авторы описали механизм защитного действия AHR при инфекции. Полученные результаты могут стать основой для разработки новых терапевтических подходов.
Новый классификатор подскажет, кому нужен скрининг на рак легких
Источник:
Major, J. et al. Endothelial AHR activity prevents lung barrier disruption in viral infection. // Nature, published August 16, 2023. DOI: 10.1038/s41586-023-06287-y


 Меню
Меню





 Все темы
Все темы




 0
0








