Слияние митохондрий обеспечивает синаптическую пластичность нейронов гиппокампа
Синаптическая пластичность считается одним из ключевых механизмов обучения и памяти. Немецкие ученые выяснили, что важную роль в ее поддержании играет слияние митохондрий в нейронах. Так, гранулярные клетки (разновидность нейронов гиппокампа), в которых этот процесс был нарушен, хуже встраивались в уже существующие нейронные сети и отмирали, не выдерживая конкуренции с нейронами дикого типа.
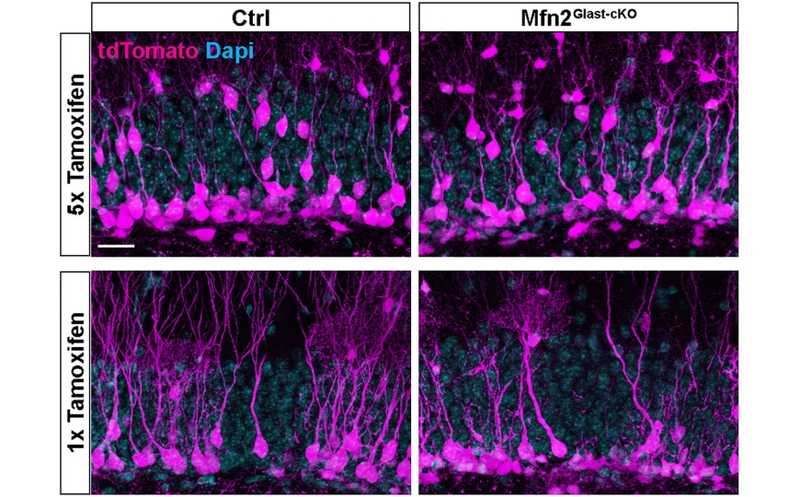
Плотность нейронов, в которых произошла тамоксифен-индуцированная рекомбинация, в зубчатой извилине мышей. Более высокие дозы тамоксифена усиливали рекомбинацию в нейронах, гетерозиготных по митофузину 2, и способствовали повышению их плотности.
Credit:
Neuron (2024). DOI:
10.1016/j.neuron.2024.03.013 |
CC BY-NC-ND
Некоторые области мозга, в частности, гиппокамп, обладают способностью к нейрогенезу не только в ходе эмбрионального развития, но и на протяжении взрослой жизни. Чтобы успешно интегрироваться в нейронные сети гиппокампа, незрелые нейроны обладают особым периодом повышенной синаптической пластичности, однако до сих пор оставалось неясным, какие механизмы ее поддерживают. Авторы статьи в журнале Neuron обнаружили, что когда созревающие нейроны вступают в этот критический период, в их дендритах усиленно сливаются митохондрии, и это изменение их морфологии способствует синаптической пластичности.
Митохондрии в нейронах регулируют выработку энергии и метаболитов, участвуют в контроле концентрации ионов кальция, продуцируют активные формы кислорода (АФК) и влияют на редокс-статус клетки — все это, как считается, критично для долгосрочного функционирования синапса. Функция самих митохондрий тесно связана с их структурой. В частности, укорочение митохондрий в аксонах связано с усилением их транспорта в синаптические терминали и обратно — так они могут регулировать ветвление аксонов и передачу сигнала.
Ученые отследили морфологию митохондрий в гранулярных клетках зубчатой извилины гиппокампа. Для этого они воспользовались ретровирусами, кодирующими флуоресцентные белки митохондриальной и цитозольной локализации, — их стереотаксически вводили мышам в зубчатую извилину, а затем визуализировали митохондрии с помощью конфокальной микроскопии. Исследование вели от двух до восьми недель клеточного возраста, то есть от начала ветвления дендритов до приобретения клетками зрелого фенотипа. В возрасте первых трех недель митохондрии в дендритах нейронов были короткими и располагались хаотично, а на четвертой претерпевали заметные изменения — удлинялись и распределялись более равномерно. Дальнейший анализ выявил два типа поведения митохондрий — они сливались или мигрировали по клетке, причем частота их слияний была значимо увеличена в возрасте четырех недель.
Чтобы более подробно исследовать динамику слияния митохондрий, авторы работы сосредоточились на генах, ответственных за слияние внешних митохондриальных мембран — митофузинах 1 и 2. С помощью Cre-рекомбиназы авторы работы получили гранулярные клетки с условным нокаутом того или иного митофузина. К шести неделям, когда контрольные митохондрии уже обладали стабильной морфологией и крупными размерами, митохондрии в нокаутных по одному из митофузинов клетках были сильно фрагментированы. Интересно, что одновременный нокаут сразу двух белков не приводил к ухудшению фенотипа по сравнению с одиночными мутантами.
Затем авторы проанализировали распределение митохондрий в дендритах нормальных и нокаутных клеток. Оказалось, что дендритные шипики контрольных клеток располагались в областях, заполненных митохондриями, тогда как при нокауте в основании дендритных шипиков митохондрий зачастую не было. В целом дендриты нокаутных по митофузинам клеток были более округлые, чем в контроле.
Исследователи также выяснили, что нарушение слияния митохондрий снижает выживаемость нейронов, полученных при нейрогенезе во взрослом возрасте. На эту мысль ученых натолкнула сравнительно низкая встречаемость трансдуцированных клеток в образцах. И действительно, к шести неделям выживаемость нокаутных гранулярных клеток снижалась примерно на 50% по сравнению с нейронами мышей дикого типа, помеченными флуоресцентным белком. Сам нейрогенез при этом не был затронут нокаутом.
Авторы работы предположили, что снижение жизнеспособности нейронов может быть результатом нарушения синаптической пластичности, а не тяжелой митохондриальной дисфункции, которая в противном случае должна была бы вызвать обширную нейродегенерацию. Они провели опыты с обогащением окружающей среды, то есть поместили мышей в обстановку, стимулирующую синаптическую пластичность клеток гиппокампа. Оказалось, что нокаутные по митофузину 2 мыши такой синаптической пластичности не демонстрировали — число дендритных шипиков у них не возрастало, в отличие от контрольных мышей. Анализ электрофизиологических характеристик, который ученые провели на переживающих срезах мозга, также подтвердил это предположение — нокаут митофузинов нарушал долговременную потенциацию нейронов.
Конкуренция созревающих гранулярных клеток, встраивающихся во взрослый гиппокамп, во многом регулируется на синаптическом уровне. Ученые задались вопросом, влияет ли на этот процесс усиленное слияние митохондрий в начале критического периода пластичности. Они индуцировали рекомбинацию в новообразующихся гранулярных клетках с помощью тамоксифена, варьируя его дозировки. При высоких дозах тамоксифена рекомбинация происходила активно — ее отслеживали по флуоресцентной метке, — и в митохондриях нейронов восстанавливалась экспрессия митофузина 2. В таких условиях восстанавливалась и их плотность. Это указывает на то, что выживаемость нейронов не связана с нейродегенерацией, и предполагает роль экспрессии митофузина 2 в регуляции конкурентного выживания.
Дальнейшие опыты показали, что при нокауте митофузина нарушается встраивание новообразованных нейронов в существующие нейронные сети гиппокампа. Ученые картировали синаптические связи гранулярных клеток гиппокампа мышей, помещенных в обогащенную среду на четыре недели. При дефиците митофузина 2 нейроны хуже образовывали новые синаптические связи — как локальные, так и удаленные. Кроме того, нокаутные по митофузину 2 нейроны с меньшей вероятностью встраивались в поведенчески значимые нейронные сети после повторного воздействия такой же среды на мышь.
Авторы работы заключают: слияние митохондрий на определенном этапе развития нервных клеток, сформированных во взрослом мозге, необходимо для обеспечения синаптической пластичности.
TIMP2 регулирует нейропластичность гиппокампа, влияя на внеклеточный матрикс
Источник
Sandra M.V. Kochan et al. Enhanced mitochondrial fusion during a critical period of synaptic plasticity in adult-born neurons. // Neuron (2024). DOI: 10.1016/j.neuron.2024.03.013


 Меню
Меню





 Все темы
Все темы




 0
0








