Внеклеточный матрикс впитывает лишний интерферон
Немецкие и французские ученые описали роль внеклеточного матрикса в нейтрализации избытков интерферона гамма. Интерферон связывается с гепарансульфатом во внеклеточном матриксе. Удаление отвечающего за связывание аминокислотного мотива увеличивало содержание интерферона в плазме и приводило к развитию фатальной токсичности в ответ на хроническую инфекцию у мышей.
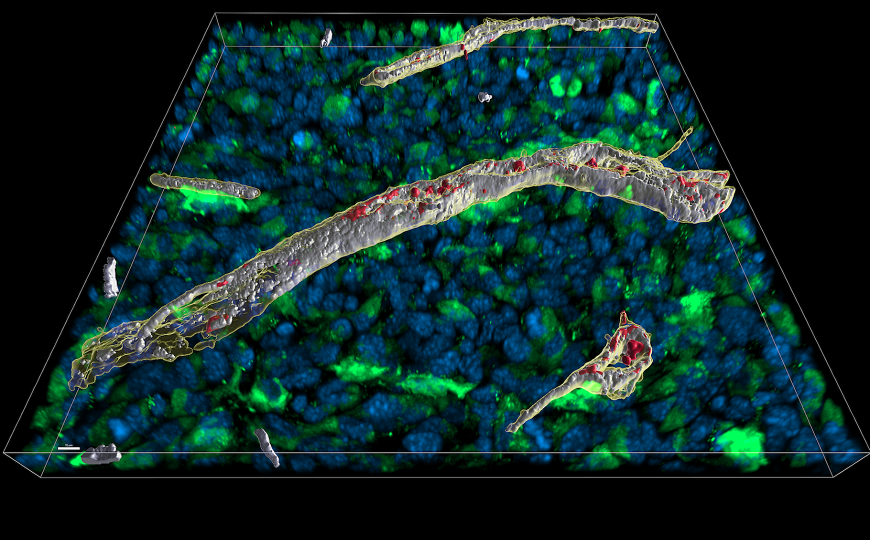
Микроскопический анализ среза тканей мыши после выпуска интерферона гамма.
Credit:
Blankenstein Lab, Technology Platform Advanced Light Microscopy, Max Delbrück Center | Пресс-релиз
В процессе эволюции иммунная система все лучше и лучше приспосабливалась к борьбе с патогенами. Однако у такой «гонки вооружений» есть побочный эффект. С ростом защитного потенциала иммунной системы растет и риск аутоиммунных реакций. Поэтому организм формирует механизмы, помогающие сдерживать иммунитет. Так, ученые из Германии и Франции показали, что внеклеточный матрикс функционирует как «губка», впитывающая лишний интерферон гамма (IFNγ) и предотвращающая его распространение за пределы места инфекции.
Известно, что, кроме соответствующего рецептора, интерферон гамма способен связываться с гепарансульфатом (HS) во внеклеточном матриксе (ECM). За связывание отвечает мотив из четырех положительно заряженных аминокислот (KRKR) на C-конце IFNγ. При этом точные функции KRKR-мотива до сих пор оставались неизвестными.
Сравнивая белковые последовательности IFNγ разных видов, ученые обнаружили, что, хотя сами белки крайне полиморфны, KRKR-мотив является очень консервативным. Отклонения в структуре мотива встречаются только у ограниченного ряда видов. При этом замены в мотиве всегда происходят на положительно заряженные аминокислоты. Такая степень консервативности обычно указывает на устойчивую эволюционную функцию.
Для изучения функции KRKR-мотива группа индуцировала экспрессию IFNγ и IFNγ с делецией KRKR-мотива (IFNγΔKRKR) в клеточных культурах. Выяснилось, что делеция KRKR-мотива не влияет на биоактивность интерферона. При этом IFNγΔKRKR полностью терял способность связываться с ECM. Интересно, что делеция KRKR-мотива также замедляла процесс связывания интерферона с его рецептором. При этом стабильность комплекса не страдала.
Для анализа паттернов связывания интерферона in vivo ученые использовали мышей Ifng–/–/Ifngr1–/–, у которых отсутствует собственная экспрессия интерферона гамма и его рецептора. У животных формировали опухоли, экспрессирующие IFNγ или IFNγΔKRKR, помеченные GFP. Далее ткани опухоли рассекали и окрашивали при помощи антител к эндотелиальным клеткам и HS. Оказалось, что IFNγΔKRKR колокализуется с HS в десять раз реже, чем IFNγ. При этом локальные концентрации интерферона не отличались, а вот содержание IFNγΔKRKR в плазме крови было значительно выше, чем IFNγ. Исходя из полученных результатов, ученые пришли к выводу, что ECM «впитывает» лишний интерферон, не позволяя ему попасть в системный кровоток.
Индукция экспрессии IFNγΔKRKR в мышах, экспрессирующих собственный рецептор интерферона, приводила к развитию системной токсичности в течение нескольких дней. Животные теряли значительно больше веса, чем при индукции экспрессии IFNγ. Наблюдалась также тенденция к большему повышению температуры, однако статистической значимости различия не достигали. Содержание IFNγΔKRKR в плазме на третий и пятый дни превышало таковое для IFNγ в три раза.
Наконец, ученые решили проверить, как делеция KRKR влияет на иммунный ответ на разные стимулы. Разовые острые стимуляции, такие как введение анти-CD3 антител или липополисахарида, вызывали резкое повышение содержания интерферона в плазме с дальнейшим возвращением к базовому уровню. Такая реакция наблюдалась как у IFNγΔKRKR мышей, так и у животных, несущих дикий тип интерферона. Следующим шагом стало заражение мышей специальным штаммом вируса лимфоцитарного хориоменингита (LCMV-Docile). Этот штамм вызывает хроническую, но самоограничивающую инфекцию, обеспечивающую продолжительную стимуляцию антигеном из-за задержки вывода вирусных частиц. Инфекция LCMV-Docile приводила к развитию острой иммунной токсичности у IFNγΔKRKR мышей, вплоть до некроза печени. У IFNγWT мышей подобного эффекта не наблюдалось.
Таким образом, работа продемонстрировала ключевую роль внеклеточного матрикса в локализации интерферона и предотвращении иммунной токсичности.
Витамины D2 и D3 по-разному влияют на иммунную систему человека
Источник:
Kemna J., et al. IFNγ binding to extracellular matrix prevents fatal systemic toxicity // Nature Immunology (2023), published February 02, 2023. DOI: 10.1038/s41590-023-01420-5


 Меню
Меню





 Все темы
Все темы




 0
0








