Выявлен маркер стволовых клеток, формирующих опухоли после трансплантации
Эмбриональные стволовые клетки и индуцированные плюрипотентные стволовые клетки — перспективные инструменты регенеративной медицины, поскольку они способны дифференцироваться в любые типы тканей. Тем не менее, их использование сопряжено с риском развития опухолей после трансплантации. Команда ученых из Японии нашла способ идентифицировать проблемные клетки в культуре до трансплантации по экспрессии рецептора тирозинкиназы EPHA2 — удаление EPHA2-положительных клеток из культуры снижало риск образования опухолей после пересадки.
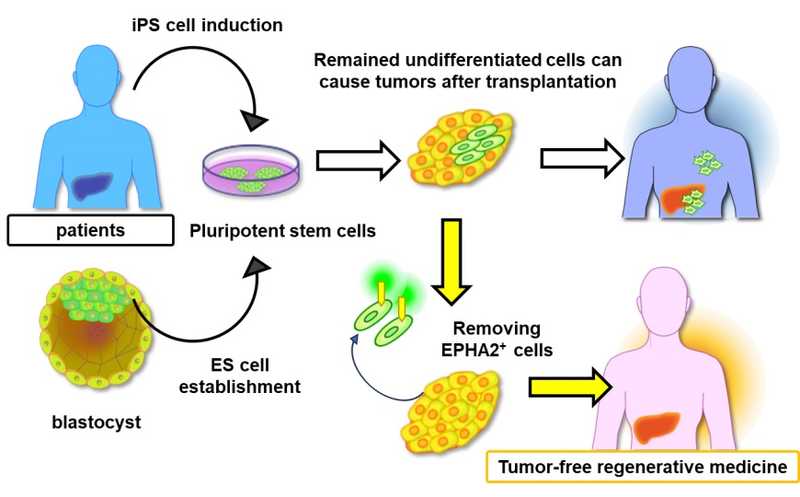
Новый способ предотвращения опухолеобразования в терапии с использованием стволовых клеток.
Credit:
Atsushi Intoh |
пресс-релиз
Эмбриональные стволовые клетки (ESC) и индуцированные плюрипотентные стволовые клетки (iPSC) способны дифференцироваться в различные клеточные линии, что делает их мощными инструментами в регенеративной медицине. Благодаря своей уникальной способности дифференцироваться почти в любой тип ткани, iPSC могут широко использоваться для восстановления поврежденных и стареющих органов. Однако склонность этих стволовых клеток к образованию тератом в организме реципиента вызывает серьезные опасения и затрудняет их терапевтическое применение. Один из подходов к тому, чтобы обеспечить безопасное использование стволовых клеток в медицине — идентифицировать и уничтожить проблемные клетки в культурах до трансплантации.
Группа ученых под руководством Ацуши Инто (Atsushi Intoh) и Акиры Курисаки (Akira Kurisaki) из Института науки и технологий Нары (Япония) предположила, что EPHA2, рецептор тирозинкиназы, активирующийся в процессе раннего развития и патогенеза, может быть ответственен за удерживание стволовых клеток в недифференцированном состоянии. Данные секвенирования РНК единичных клеток (scRNA-seq) ранних эмбрионов уже показали, что Epha2 экспрессируется на стадии бластоцисты, а затем его экспрессия затухает; это позволяет предположить, что Epha2 служит маркером плюрипотентных стволовых клеток. Чтобы проверить свою гипотезу, исследователи создали линию мышиных ESC с нокдауном Epha2 с помощью РНК-интерференции. Анализ показал, что маркеры недифференцированного состояния были подавлены в клетках с нокдауном — это указывает на то, что потеря Epha2 вызывает спонтанную дифференцировку. Последующий анализ также показал, что спонтанно дифференцировавшиеся клетки с нокдауном Epha2 экспрессировали маркерные гены, представляющие все три зародышевых слоя.
Ученые также исследовали паттерн экспрессии человеческого EPHA2 в недифференцированных клетках. Уровни мРНК EPHA2 значительно снижались после спонтанной дифференцировки индуцированных плюрипотентных стволовых клеток человека (iPSC), что соответствует тенденции, наблюдаемой в эмбриональных стволовых клетках мыши. Однако анализ методом FACS (сортировка флуоресцентно-активированных клеток) выявил гетерогенную экспрессию EPHA2 на поверхности клеток — она наблюдалась примерно у 12% недифференцированных iPSC. Этот паттерн также наблюдался в ESC человека, что указывает на наличие отдельной субпопуляции EPHA2+ среди плюрипотентных стволовых клеток человека. Анализ геномных данных выявил высокую степень консервативности локусов EPHA2 как у человека, так и у мыши. В локусе EPHA2 человека активные энхансерные регионы в iPSC содержат несколько сайтов связывания для OCT4 и NANOG, кроме того, клетки EPHA2+, в отличие от EPHA2–, экспрессируют эти транскрипционные факторы, но не SOX2.
Далее команда ученых исследовала совместную экспрессию EPHA2 и OCT4 в недифференцированных клетках. Для этого была создана линия эмбриональных стволовых клеток мыши, в которой промотор Oct4 был связан с EGFP (Oct4-egfp) — это позволило визуализировать экспрессию Oct4 в недифференцированных клетках. Ученые обнаружили, что EGFP сильно экспрессировался в недифференцированных клетках, но его экспрессия снижалась при их дифференцировке.
Исследователи предположили, что стволовые клетки, экспрессирующие EPHA2 и неспособные к дифференцировке, могут быть ответственны за образование опухолей при трансплантации в целевой орган. Для проверки этой гипотезы они подготовили культуры стволовых клеток и искусственно индуцировали их дифференцировку в клетки печени. С помощью антител к EPHA2, соединенных с магнитными наночастицами, ученые извлекли EPHA2+ клетки из колоний перед трансплантацией мышам. У животных, которым пересаживали обедненные EPHA+ клетками трансплантаты, значительно реже образовывались опухоли.
«EPHA2, таким образом, — это потенциальный маркер для отбора недифференцированных стволовых клеток, позволяющий снизить риск опухолеобразования после трансплантации стволовых клеток в рамках регенеративной терапии», — комментирует профессор Курисаки. Дальнейшие исследования EPHA2 могут привести к разработке более безопасных и эффективных терапевтических протоколов, сокращая разрыв между изучением стволовых клеток и их клиническим применением.
Как «отформатировать» стволовой клетке эпигенетическую память?
Источник
Atsushi Intoh et al., EPHA2 is a novel cell surface marker of OCT4-positive undifferentiated cells during the differentiation of mouse and human pluripotent stem cells. // Stem Cells Translational Medicine, 2024; szae036, DOI: 10.1093/stcltm/szae036
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








