Новые тесты на коронавирус: информативнее и быстрее
Как сделать ПЦР-тест, способный отличить штамм дельта от других штаммов коронавируса? Чем заменить ПЦР-тестирование, чтобы получать результат быстрее? На вопросы PCR.NEWS отвечает Герман Шипулин, заместитель генерального директора по научно-производственной деятельности Центра стратегического планирования ФМБА России.
Герман Шипулин, заместитель генерального директора по научно-производственной деятельности Центра стратегического планирования (ЦСП) ФМБА России, рассказывает о двух новых российских тестах на коронавирус, зарегистрированных ЦСП ФМБА. Один, «АмплиТест SARS-CoV-2 VOC v.2», идентифицирует «варианты, вызывающие опасения» — британский, южноафриканский, бразильский и индийский штаммы. Второй тест, «АмплиТест SARS-CoV-2 LAMP», основан на изотермической амплификации и предназначен для быстрого выявления коронавируса в образцах. Это технология, которая придет на смену ПЦР.
 Г.А. Шипулин
Г.А. Шипулин
Охота на новые штаммы
В Москве снова был резкий рост заболеваемости. Он совпал с распространением новых вариантов, вызывающих опасения, в первую очередь «индийского» штамма (B.1.617.2, или дельта).
Сайт Nextstrain представляет в графической форме результаты секвенирования коронавирусных геномов, помещенные в базу GISAID
(на рисунке ниже — примерно 3,3 тысячи геномов). По темпам секвенирования Россия отстает от других развитых стран, например от США и Великобритании, где счет геномов, загруженных в GISAID, идет на сотни тысяч. Тем не менее хорошо видно, как изменяются частоты вариантов, секвенированных в нашей стране, и как распространилась в мае-июне линия B.1.617.2 (зеленый цвет).
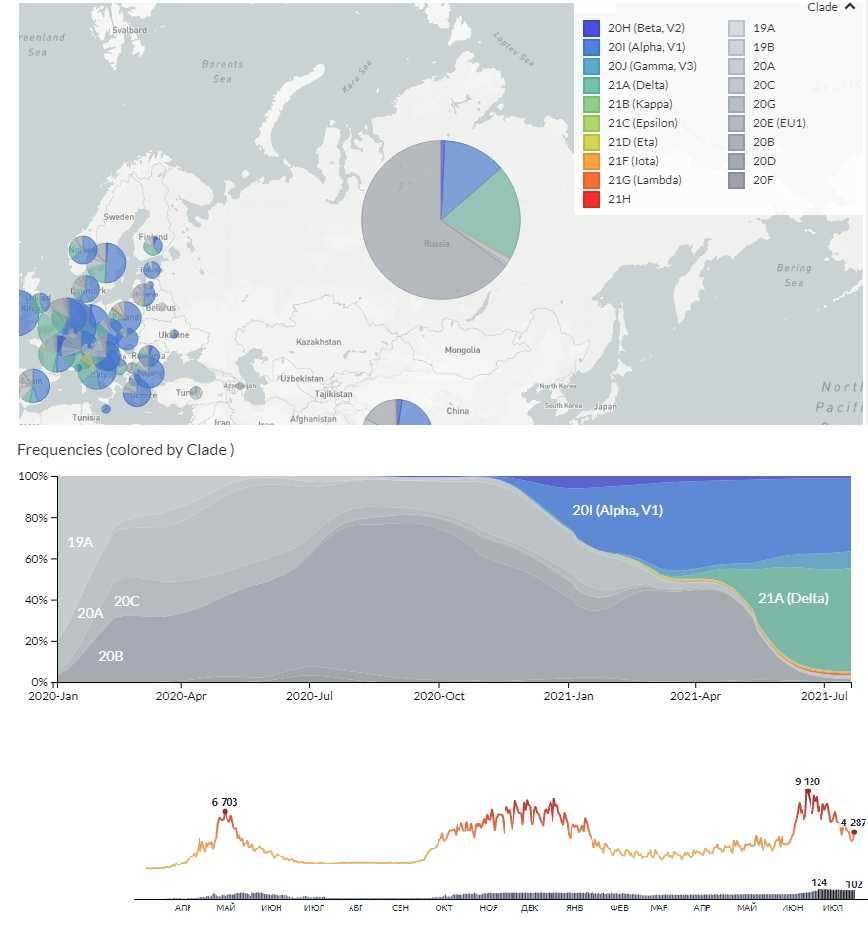 Данные Nextstrain по распространенности различных штаммов в РФ (2021-07-20). Внизу — заболеваемость COVID-19 и смертность в Москве (статистика Яндекс)
Данные Nextstrain по распространенности различных штаммов в РФ (2021-07-20). Внизу — заболеваемость COVID-19 и смертность в Москве (статистика Яндекс)
Аналогичные результаты получили в ЦСП ФМБА, причем в Москве рост «индийской» линии был еще более стремительным, чем в среднем по стране. Первый случай инфицирования B.1.617.2 на территории России был выявлен специалистами ЦСП в апреле, отметила руководитель ФМБА Вероника Скворцова. Уже к середине мая в Москве частота представленности этой линии достигла 9,9% от всех выявленных вариантов SARS-CoV-2, в последнюю неделю мая — 25%, в первую неделю июня — 35%, а 16 июня — уже 87%. Распространение B.1.617.2 сопровождалось резким ростом заболеваемости и смертности.
Дельта — неприятный вариант. Судя по экспериментальным и эпидемиологическим данным, он распространяется быстрее альфы и уклоняется от иммунного ответа успешнее беты (хотя вакцинированные люди все же защищены лучше невакцинированных). Кроме того, у инфицированных этим штаммом гораздо выше вирусная нагрузка. Можно предположить, что это способствует и распространению, и более быстрому развитию болезни.
Оценивать распространенность таких вариантов вируса в популяции крайне важно. Если в стране появляется вариант с подобными свойствами и его частота растет, то, возможно, следует ужесточить карантинные меры.
Как отличить один штамм коронавируса от другого? Секвенирование — надежный способ, но дорогой и трудоемкий, кроме того, секвенировать вирусный геном сложно, если РНК в образце мало — менее 105–106 копий.
Чтобы наблюдать за распространением тех или иных мутаций, можно использовать тесты на основе полимеразной цепной реакции (ПЦР). Этот метод выявления широко распространенных и важных линий вируса рекомендован ВОЗ. Праймеры подбирают к участкам генома, которые содержат мутации, характерные для той или иной клады вируса. За счет этого можно различить геном с мутацией и без нее по тому, пойдет или не пойдет амплификация. Конечно, только в том случае, если праймеры достаточно специфичны, чтобы «почувствовать» замену одного нуклеотида.
К разработке ПЦР-набора для выявления к вариантам особого эпидемиологического значения (VOC) в ЦСП ФМБА приступили весной. В это время к VOC, имеющим международное распространение, были отнесены линии B.1.1.7 («британская», по новой номенклатуре — альфа), B.1.351 («южноафриканская», бета) и P.1 («бразильская», гамма), причем B.1.1.7 и в единичных случаях B.1.351 были выявлены на территории РФ. Первая версия — набор «АмплиТест SARS-CoV-2 VOC v.1» — позволяет отличить от «старых» вариантов альфу и бету/гамму.
Информация об «индийских» вариантах B.1.617.1 и B.1.617.2 в России появилась уже после того, как «АмплиТест SARS-CoV-2 VOC v.1» получил регистрационное удостоверение. О «бразильском» штамме гамма Роспотребнадзор сообщил совсем недавно, 22 июля. Но то, что новые штаммы придут в Россию, было понятно с самого начала. Решение о разработке новой версии теста приняли в мае, и теперь эта версия тоже зарегистрирована.
Почему так долго? Сколько требуется времени, чтобы разработать ПЦР-набор для выявления нового штамма?
— Сейчас говорят, что за четыре дня можно набор разработать. На самом деле не только нельзя, но еще и вредно требовать таких сроков, — объясняет Герман Шипулин. — Я посчитал, сколько времени нужно: на синтез праймеров два-три дня, пять дней на синтез флуоресцентно меченого зонда, потом — ферменты. Неделя уходит только на то, чтобы синтезировать качественные компоненты. Еще нужно выбрать оптимальный вариант, на это день-два нужно, но это тоже время. Но даже если ты всё скапал, это никакой не «прототип набора», как выражаются некоторые журналисты. Это заготовка. Ее необходимо валидировать, иначе вы назовете неработающий набор работающим, и он будет давать врачам недействительные данные. Валидация проводится на контроле, контроль тоже нужно запланировать и создать. Для нашего первого набора лучшие специалисты Москвы это делали — все бросили и за пять дней создали положительные контрольные образцы с рекомбинантной РНК. Дальше идет валидация. Она должна проводиться не только на контрольных образцах, но и на положительных образцах пациентов. Положительные образцы нужно добыть, охарактеризовать, желательно — количественно, чтобы понять аналитическую чувствительность. В общем, я за то, чтобы такие наборы делать как минимум три недели, месяц — идеальный срок. У нас и ушел где-то месяц. В середине мая мы приступили, в середине июня закончили разработку. Еще на написание документов недели две, и подача на регистрацию — еще около месяца.
Вторая версия набора, «АмплиТест SARS-CoV-2 VOC v.2», получила регистрационное удостоверение 21 июля. Набор внедрен в производство и готов к серийному выпуску на производственной площадке ЦСП ФМБА.
Как ПЦР-тест определяет штаммы коронавируса? Первая версия набора «АмплиТест SARS-CoV-2 VOC v.1» выявляет шесть маркеров в вирусном геноме: четыре ключевые мутации в S-гене SARS-CoV-2 — N501Y, E484K, P681H и делецию 69-70del, а также кодоны 501 и 484 гена S без мутации. В результате тест позволяет выявлять сочетание мутаций N501Y, P681H и 69-70del, характерное для «британской» линии B.1.1.7, а также сочетание мутаций N501Y и E484K, характерное для «южноафриканской» B.1.351 и «бразильской» P.1.
Вторая версия выявляет также «индийский» штамм дельта (B.1.617.2) — мутации L452R и P681R, характерные для дельты и «дельты плюс» (варианта штамма дельта с дополнительной мутацией K417N). Таким образом, «АмплиТест SARS-CoV-2 VOC v.2» различает четыре новых варианта вируса.
 «АмплиТест SARS-CoV-2 VOC v.2»
«АмплиТест SARS-CoV-2 VOC v.2»
— Вы испытывали набор прямо во время третьей вспышки в Москве? — спрашиваю Германа Шипулина.
— Да, потому что на тот момент мы уже пробили 500 образцов, мы же секвенировали параллельно. Первый случай B.1.617.2 мы обнаружили около 18 апреля. Сейчас его в московских образцах, наверное, 99%. Им легко заразиться, поскольку медианная вирусная нагрузка в выделениях из респираторного тракта примерно в тысячу раз выше. Мы это видим даже по уменьшению количества ПЦР-циклов. Кроме того, эффективность вакцин в отношении индийского штамма якобы снижается — на самом деле в Израиле, в Англии, в других странах, где привитых много, рост новых случаев есть, но летальность не растет, она низкая. Это говорит о том, что вакцинированные все же защищены.
— А если вируса в образце много, высокая чувствительность теста не перестанет быть преимуществом? Наступит время низкочувствительных быстрых тестов?
— Да, есть вероятность того, что там, где много «индийского» штамма, быстрые ИХА-тесты не будут давать большого количества ложноотрицательных результатов, мы получим практически полное совпадение с ПЦР. Однако не хотелось бы, чтобы эти тесты полностью заменили ПЦР. В будущем придет новый штамм, который найдет другой способ распространения в популяции, не за счет вирусной нагрузки, а, например, за счет еще более эффективного ускользания от иммунитета. У индийского штамма появилась еще одна буква R — аргинин в фуриновом сайте, их там теперь не два, а три, это все знают. И плюс у него мы нашли еще две мутации в структурных генах, не связанных с поверхностными белками, которые есть только у российских штаммов — в других странах они очень редкие.
— Они на вирулентность, на патогенность не влияют?
— Это мы изучаем сейчас. Но прямых доказательств, что влияют, у нас пока нет.
В наборах «АмплиТест SARS-CoV-2 VOC» используются так называемые выпрямленные зонды с LNA-модифицированными основаниями. Они дают возможность отличить участок вирусного генома с заменой единственного нуклеотида от такого же участка без мутации.
— Мы одни из немногих в России, кто умеет синтезировать LNA, — говорит Герман Шипулин. — И за счет этого удается достичь высокой специфичности. Результаты проверяем полногеномным секвенированием, а потом отдельно секвенируем локусы в S-гене.
Аналитическая чувствительность набора составила 1×103 копий/мл РНК SARS-CoV-2 — это хороший результат. Специфичность проверили на РНК штаммов сезонных коронавирусов человека, а также SARS-CoV и MERS-CoV, вирусов гриппа, парагриппа, риновирусов и ДНК бактерий, вызывающих инфекции нижних или верхних дыхательных путей, и убедились, что набор не «путает» SARS-CoV-2 с другими респираторными инфекциями.
Во время регистрационных клинических испытаний во всех образцах из носо- и ротоглотки выявили все присутствующие целевые мутации, при этом неспецифичных ложных результатов не было. Показатели диагностической чувствительности и специфичности по результатам этих испытаний составили 100%. С 95%-ной доверительной вероятностью диагностическая чувствительность для выявления варианта дельта — 94,2–100%, для альфы — 91,1–100%, для вариантов бета и гамма — 89,9–100%. Диагностическая специфичность 96,4–100%, соответственно.
Рано или поздно появятся новые штаммы, имеющие международное значение, штамм дельта не будет последним. Что же, все время обновлять наборы?
— Если включить в набор десять вариантов, то он будет очень сложно устроен, им будет неудобно пользоваться, — говорит Герман Шипулин. — Поэтому мы подумываем сейчас о том, чтобы закупить устройство, которое поставляет компания Agena, — масс-спектрометр, который позволяет проделать обычную ПЦР, а потом с помощью мини-секвенирования и последующей масс-спектрометрии выявить в одной пробирке большое количество мутаций. (Подробнее о технологии MassARRAY компания Agena. — PCR.NEWS). Там не нужно зонды синтезировать, а праймеры можно синтезировать за один-два дня. А зонд синтезируется пять дней. И в этом преимущество Agena, для обнаружения новых линий она очень удобна. У них есть экспериментальный набор для выявления 30 линий COVID. Но поскольку этих приборов в России мало, и набор никому не нужен. Мы готовимся такой прибор закупить — может быть, не для диагностических целей, а с целью удешевления надзорного тестирования. Будем проводить предварительное тестирование набором Agena, а потом уже, при положительном результате, секвенирование. Во-первых, секвенирование дорого стоит, во-вторых, оно и не должно быть массовым — достаточно отсеквенировать репрезентативную выборку. Отсеквенировать все образцы от всех пациентов, наверное, с точки зрения фундаментальной науки правильно. С практической точки зрения можно было бы направить ресурсы на что-нибудь другое. Например, на разработку новых вариантов вакцины или на масштабирование производства «Спутника V».
Для пациента не имеет принципиального значения, какой именно штамм коронавируса у него обнаружили: рекомендации по лечению от этого не изменятся, подчеркивает Герман Шипулин. Если обнаружен «индийский» вариант, стоит помнить о повышенной трансмиссивности, но карантинные меры больному и его близким необходимо соблюдать и при заражении «старыми» штаммами. Однако понимать, какие штаммы преобладают в том или ином регионе, как уже говорилось, важно для эпиднадзора и принятия решений о противоэпидемических мерах.
Амплификация — не только ПЦР
Проблема ПЦР-тестов на РНК коронавируса, которая за год пандемии стала очевидна всем, — это сроки выполнения. Для полимеразной цепной реакции необходим температурный цикл: раствор нагревается, охлаждается и снова нагревается десятки раз, пока не будет детектирован продукт. Отсюда и длительное время реакции — час-полтора, и необходимость транспортировки образца из пункта забора в лабораторию: в каждую поликлинику термоциклер для ПЦР не поставишь. А когда результат, сколь угодно точный, доступен лишь через два дня, он теряет актуальность. Ковид-положительный человек успеет вступить в контакт со множеством людей, ковид-отрицательный — может заразиться.
Существуют тесты, основанные на том же принципе амплификации нуклеиновых кислот, что и ПЦР, но реакция в них идет при постоянной температуре (изотермическая амплификация). За счет этого она проходит быстрее и требует более простого оборудования. Тесты на основе изотермической амплификации можно выполнять в местах оказания медицинской помощи, в аэропортах и других транспортных узлах — в любой ситуации, где нужно быстро проверить множество людей.
Уже сейчас появилось больше десятка технологий амплификации нуклеиновых кислот, отличных от ПЦР. Наиболее известна петлевая изотермическая амплификация LAMP. Но есть и другие: RPA (Recombinase Polymerase Amplification), RCA (Rolling Circle Amplification), MDA (Multiple Displacement Amplification), SMART (Signal Mediated Amplification of RNA Technology), HDA (Helicase-Dependent Amplification), NASBA (Nucleic Acid Sequence-Based Amplification), SDA (Strand Displacement Amplification)… Все эти методы изотермические, и все они опережают ПЦР по скорости.
Когда началась пандемия, компания Abbott Alere предложила прибор на основе технологии NEAR (Nicking Enzyme Amplification Reaction). Метод Abbott ID NOW можно считать вариантом SDA-реакции — он основан на вытеснении цепи из дуплекса и внесении одноцепочечных разрывов по обе стороны сайта-мишени. Ранее его уже использовали для диагностики гриппа. На приборе Abbott реакцию амплификации для выявления коронавируса можно провести всего за 10–20 минут.
В России зарегистрировано несколько наборов для выявления РНК SARS-CoV-2 с помощью изотермической амплификации. Наиболее широкое практическое применение нашел набор компании «Эвотек Мирай Геномикс», где используется сходный с LAMP метод SmartAmp, разработанный в японском институте RIKEN.
В апреле 2021 года получил регистрационное удостоверение набор «АмплиТест SARS-CoV-2 LAMP». Важное его преимущество перед другими тестами в том, что он содержит внутренний контрольный образец (ВКО) — тестовую РНК, для которой обратная транскрипция, амплификация и детекция проводятся в той же пробирке, одновременно с целевым участком РНК SARS-CoV-2. Если ВКО не детектируется, значит, что-то пошло не так и отрицательный результат может быть ошибочным.
 «АмплиТест SARS-CoV-2 LAMP»
«АмплиТест SARS-CoV-2 LAMP»
В других зарегистрированных в РФ тестах, и отечественных, и зарубежных, ВКО нет либо реакция с ним проводится в отдельной пробирке. Дело в том, что большинство тестов на основе LAMP используют для детекции результатов интеркалирующие красители, окрашивающие двухцепочечную ДНК, или pH-индикаторы, которые фиксируют изменение pH в ходе реакции. Плюс этих подходов — в простоте, а минус — в неспецифичности. Как интеркалирующие красители, так и индикаторы рН не отличают целевые продукты реакции от побочных и не позволяют выявлять более одной ДНК-мишени: появление любой двухцепочечной ДНК дает один и тот же сигнал. Следовательно, добавить ВКО к образцу невозможно: это будет уже две мишени.
В наборе «АмплиТест SARS-CoV-2 LAMP» для детекции продукта используется праймер с флуоресцентной меткой. Когда такой праймер встраивается в продукт амплификации, гаситель удаляется от флуорофора и возникает сигнал. Поэтому можно быть уверенным, что сигнал говорит о присутствии в образце именно той молекулы, к которой присоединился праймер, — определенной последовательности, а не любой двухцепочечной ДНК. Если же использовать для разных мишеней праймеры с разными флуоресцентными метками, это позволяет регистрировать по различным каналам сигналы об амплификации нескольких мишеней. Именно такой подход позволил включить в тест внутренний контрольный образец.
Но возникает вопрос: если методов изотермической амплификации так много, почему разработчики выбирают именно LAMP — не самый простой и, по литературным данным, не самый быстрый?
— У нас год ушел на подборку ферментов, клонирование части ферментов, оптимизацию реакций. За год хорошо сработал только LAMP, как ни странно, несмотря на то, что механизм реакции сложный, — рассказывает Герман Шипулин. — И большинство, кто пробовал разные реакции, и в России и за рубежом, остановились на LAMP — потому что он позволяет без значительных усилий достичь тех показателей, которые заявлены в статьях, в отличие от остальных реакций. NEAR у нас вообще не заработал: или ошибки в статьях, в патентах, или мы что-то неправильно делали. Пытаемся все-таки его запустить, потому что очень соблазнительно проводить реакцию за 10–15 минут. NASBA у нас работала, но она долго идет, жалко терять полчаса. Пробовали RPA, она пошла, и скорость реакции достаточно большая. Но там очень сложный зонд, очень сложные и дорогие ферменты компании Twist Dx. Пока мы в стадии разработки альтернативных методов амплификации. Но когда COVID возник, уже не было времени экспериментировать, мы взяли то, что у нас работало, поэтому и выбрали LAMP.
Тем не менее LAMP — неидеальный метод, говорит Герман Шипулин. Во-первых, чтобы выявить низкокопийную мишень, уходит 20–30 минут, а это уже долго: если добавить 20 минут на выделение, получается 50 минут. Во-вторых, LAMP требует большого количества праймеров: их не два для каждой мишени, как у ПЦР, а четыре, причем два внутренних праймера распознают по два участка. А еще могут быть нужны один или два зонда, если реакция делается с зондами. Выбрать в исследуемом геноме столько участков для посадки праймеров и зондов непросто. Кроме того, чем больше их задействовано, тем больше вероятность ложноотрицательного результата из-за мутации. По этой причине высоковариабельные вирусы, такие как ВИЧ, ротавирус или норовирус, особенно трудно детектировать с помощью LAMP.
Есть еще и третья проблема: сниженная чувствительность по сравнению с ПЦР. У «АмплиТест SARS-CoV-2 LAMP» заявлена чувствительность 5×103. Насколько это плохо по сравнению с ПЦР-тестами? Штамм дельта дает высокие вирусные нагрузки, но, как уже отмечалось, нельзя рассчитывать, что его не вытеснит другой штамм.
— На рынке есть системы и 104, и хуже, — отвечает Герман Шипулин. — Но при работе с клиническим материалом, если мы берем, например, сто пациентов положительных по ПЦР-тесту, у которого чувствительность теста 103, а потом берем тест с чувствительностью 5×103, то уже видим 10–20% ложноотрицательных результатов. Не хотелось бы такого. Чем раньше мы определим COVID-19 в инкубационном периоде, тем лучше для окружающих. Сейчас мы улучшили структуру зондов, изменили ферменты и смогли заставить наш LAMP работать с чувствительностью 103. И попытаемся еще ее нарастить.
До конца года разработчики планируют подать на регистрацию еще два LAMP-теста для выявления антибиотикорезистентных возбудителей внутрибольничных инфекций — по четыре мишени в каждом. Но по большому счету, LAMP — пройденный этап для ЦСП ФМБА. В скором времени — возможно, уже до конца года — появятся новые тест-системы, лишенные недостатков LAMP.
«Нужно на стол каждому врачу поставить мини-анализатор»
Стремительный рост объемов тестирования во время пандемии открыл новые возможности. В России работает 8–10 тысяч амплификаторов, говорит Герман Шипулин. В них можно проводить как ПЦР, так и реакции на основе LAMP. Тестирование с помощью амплификаторов, конечно, проводится в лабораториях. Пока остается мечтой тестирование point-of-care — в местах оказания медицинской помощи, «у постели больного». Но это должно измениться.
Следующая задача, которую поставил себе ЦСП ФМБА, — создание аппаратуры, с помощью которой быстрый тест можно провести в больнице или поликлинике.
— Когда начинается эпидемия, пациенты в первую очередь идут не в больницы, а в поликлиники, особенно в начале эпидемии. И было бы идеально прямо во время первичного приема и обследования установить лабораторный диагноз, — объясняет Герман Шипулин. — Для этого нужно на стол каждому врачу поставить мини-анализатор. Не только в поликлиники, но и в фельдшерско-акушерские пункты в поселках. В перспективе это будет выглядеть так: медсестра берет у пациента мазок, помещает в картридж с реагентами, вставляет картридж в прибор, и пока идет беседа с пациентом, за 15 минут получаем результат анализа. Если находят вирус, то принимаются все меры, назначается лечение.
— Но такого нет нигде в мире — анализ нуклеиновых кислот в кабинете врача.
— Нет пока ни в одной стране. Конечно, такие приборы разрабатываются, но массово еще нигде не внедрены. Если мы первыми это сделаем, то нам будет честь и хвала. Приборы, картриджи — все это надо разработать и потом еще тиражировать в промышленном производстве.
— Если мы хотим ставить диагноз за 15 минут, тогда понадобятся еще мультиплексные тесты, много мишеней в одном? Пришел к врачу человек с респираторными симптомами, у него может быть коронавирус, или грипп, или РСВ…
— Да, и это еще одна проблема с LAMP: сложно делать мультиплексные тесты. Когда в смеси много праймеров и зондов и каждая мишень начинает формировать «петли» — LAMP означает «петлевая амплификация», — возникает такой колтун из продуктов. Это ограничивает чувствительность. Наш специалист, Юлия Савочкина, добилась того, что в одной пробирке работают четыре мишени. С пятой чувствительность тут же падает, она и с четырьмя уже снижается. При этом ПЦР позволяет детектировать шесть мишеней. Можно сказать, что и четыре хорошо, но нас это не устраивает, мы хотим больше. Поэтому в будущем постараемся уйти в стороны более простых изотермических реакций.
— А на какой стадии сейчас разработка прибора?
— У нас есть партнер и даже макет прибора. Осталось найти финансирование для разработки и создания индустрии. Создать макет — это полдела, нужно наладить производство, поставить его на поток. Пока мы распланировали так, что прибор будет работать для одного пациента 30–40 минут, то есть 15–20 минут выделение нуклеиновых кислот и 15–20 минут реакция амплификации. Все равно долго, но на сегодняшний день мы этого достигли. В дальнейшем будем сокращать сроки.








 Меню
Меню





 Все темы
Все темы




 0
0