Остеопетроз
Болезнь каменных костей, она же «мраморная болезнь». Разбираемся, чем опасна замедленная резорбция костной ткани, мутации в каких генах ответственны за это редкое заболевание и какие существуют подходы к терапии.
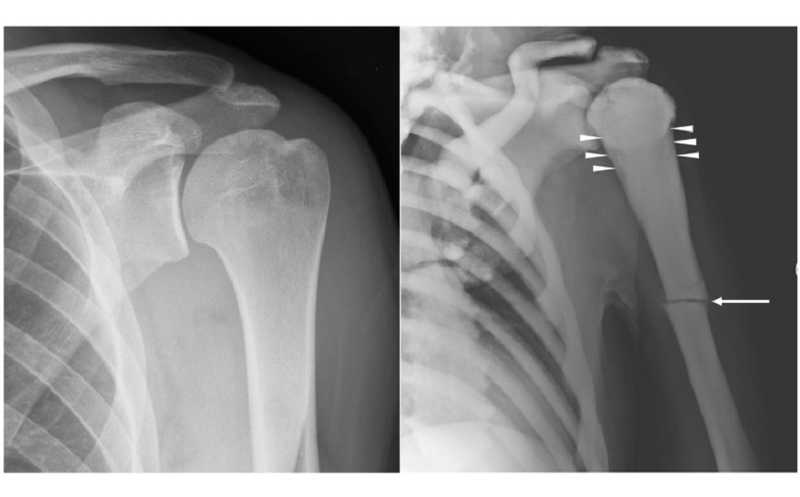
Рентгенограммы плеча молодого здорового мужчины и плеча 45-летнего мужчины с остеопетрозом (ARO); видны атравматический перелом диафиза левой плечевой кости, легкое изменение формы (показано стрелками) и увеличение плотности костной ткани.
Credit:
Genes (2022) DOI: 10.3390/genes13111965 | CC BY 4.0 DEED
Одна из загадок медицины — редкая группа заболеваний с интригующим названием «остеопетроз». По-латыни osteon — «кость», petros — «камень», соответственно, «остеопетроз» можно перевести как «каменные кости». Другое и более известное название этого состояния — «мраморная болезнь» — отражает специфическую картину, полученную при рентгенологических исследованиях: кости людей с этим заболеванием на рентгеновских снимках выглядят увеличенными, плотными и однородными, как камень. Остеопетроз — заболевание с тяжелым течением, однако международных исследований, оценивающих его распространенность, не проводилось. Предполагают, что остеопетроз встречается у одного из 20000 новорожденных.Эта статья — часть большого проекта, посвященного редким заболеваниям и современным подходам к их диагностике и лечению. Над ним работают Роман Деев, первый заместитель директора НИИ морфологии человека им. акад. А.П. Авцына ФГБНУ "РНЦХ им. акад. Б.В. Петровского", Виктория Рыжкова, руководитель офиса Человеческого капитала в Европейском университете, а также врачи, ординаторы и студенты кафедры патологической анатомии Северо-Западного государственного медицинского университета им. И.И. Мечникова Минздрава РФ.
Что плохого в том, чтобы иметь более плотные и толстые кости?
Представьте, что мы возьмем сухую и зеленую ветки. Какую вам будет проще сломать? Конечно, сухую, ведь зеленая будет просто гнуться из-за большего количества воды, которое в ней содержится. Аналогичным образом, кости с высоким содержанием костной ткани имеют в своем составе меньше воды и, следовательно, более подвержены переломам.
Как развивается это заболевание?
Жизнеспособность человеческого организма обеспечивается постоянным обновлением его мельчайших составляющих. Мы даже не замечаем, как всего за два-три дня полностью обновилась вся внутренняя выстилка кишечника, а за 28 дней мы получили новый поверхностный слой кожи. Существует гибкое равновесие между образованием новых структурных единиц и разрушением старых. Кости не являются исключением. На протяжении всего развития человека, начиная с внутриутробного, «работники костной промышленности» трудятся над тем, чтобы наш скелет рос и был устойчив к внешним воздействиям. В этом предприятии участвуют два основных отряда клеток: остеобласты и остеокласты.
Остеобласты — прекрасные строители. И они настолько самоотверженны, что, синтезируя вокруг себя со скоростью 1–2 мкм/день матрикс кости, состоящий из коллагена и минеральных веществ, замуровывают себя внутри. Но для каждой новой постройки нужно место. Здесь на помощь приходят остеокласты, которые, выделяя кислоты и ферменты, расщепляют старую костную ткань и расчищают место для обновления кости. Этот процесс называется резорбцией, и именно он нарушается при остеопетрозе. Причин у этого может быть несколько, но все они обусловлены мутациями в тех или иных генах.
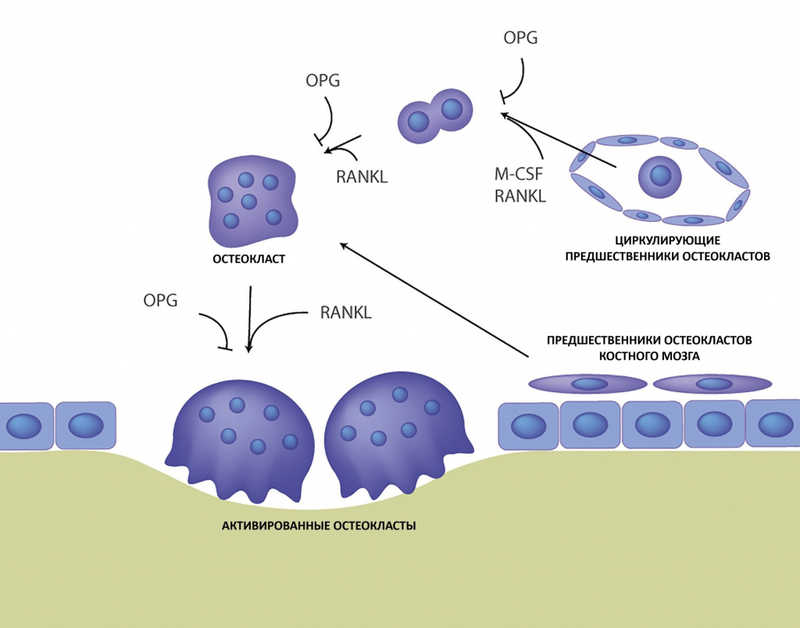 Путь дифференцировки и активации остеокластов из клеток-предшественников. Credit: Mol Ther Methods Clin Dev. 2021. DOI:
10.1016/j.omtm.2020.12.009
Путь дифференцировки и активации остеокластов из клеток-предшественников. Credit: Mol Ther Methods Clin Dev. 2021. DOI:
10.1016/j.omtm.2020.12.009
Напомним, что каждый ген в организме представлен в двух копиях (аллелях). Одну человек получает от матери, другую от отца. Когда мутация проявляет себя при поражении только одной копии, она называется аутосомно-доминантной. Если же для проявления необходимо повреждение обеих копий, а мутация только в одной из двух копий внешне незаметна, она считается аутосомно-рецессивной.
Исходя из этого, различают аутосомно-рецессивный остеопетроз (АРО) и аутосомно-доминантный остеопетроз (АДО). АРО имеет более тяжелое течение и часто проявляется в детстве, поэтому его также называют «злокачественным» и «инфантильным». В России он наиболее распространен в Чувашской республике, что связывают с эффектом основателя — сниженной генетической изменчивостью в популяции, которая берет свое начало от небольшого количества людей. Снижение изменчивости может привести к повышенной частоте аллеля, связанного с генетическими заболеванием; как следствие, у большего количества людей могут встретиться два мутантных аллеля. Среди населения Чувашии таким заболеванием оказался АРО. По данным эпидемиологических исследований, он проявляется у одного из 3879 новорожденных.
Так что это за гены?
Сегодня найдено много мутаций, приводящих к развитию остеопетроза. Мы остановимся на самых распространенных и изученных: TCIRG1, CLCN7, SNX10, OSTM1, PLEKHM1, CAII, RANKL и RANK. Всю эту кучу непонятных букв можно разделить на две группы:
-
Гены, мутации в которых препятствуют резорбции — TCIRG1, CLCN7, SNX10, OSTM1, PLEKHM1, CAII. При этом количество остеокластов сохраняется, но из-за нарушений в процессах транспорта кислот и ферментов они не способны выполнять свою функцию — разрушать костную ткань.
-
Гены, мутации в которых приводят к снижению количества функционирующих остеокластов — RANKL, RANK. В этом случае к смещению равновесия между резорбцией и синтезом костной ткани в сторону последней приводит именно недостаточное количество остеокластов.
То есть в любом случае подавлена функция остеокластов. И к чему это приводит?
При отсутствии свободного места остеобласты продолжают заниматься своим делом и создавать костную ткань. Она заполняет отверстия и пространства черепа, а также полости, предназначенные для костного мозга. Гибкость костей уменьшается, их хрупкость увеличивается. Учитывая, что наибольший рост костей приходится на детский возраст, именно инфантильный остеопетроз характеризуется наиболее злокачественным течением.
Давайте попробуем представить ребенка с этим заболеванием. Наиболее явным признаком будет задержка роста. Она возникает из-за невозможности наладить достаточное кровоснабжение растущей кости в условиях вытеснения красного костного мозга — главного центра кроветворения, где образуются эритроциты — клетки, транспортирующие кислород. Дети с остеопетрозом часто страдают нарушениями слуха и чувствительности в области лица, а также мимики. Это происходит из-за сдавливания соответствующих нервов в естественных отверстиях черепа. Причиной потери зрения считается нарушение кровоснабжения сетчатки или сдавливание зрительного нерва. Хрупкость кости приводит к переломам при ударах, которые человека без этих мутаций травмировали бы гораздо меньше.
Еще один характерный признак — частые инфекционные заболевания. Это наиболее грозное осложнение остеопетроза также связано с тем, что кость замещает красный костный мозг — главный источник защитных противоинфекционных сил организма. В нем вырабатываются не только эритроциты, но и все клетки крови, которые отвечают за способность организма сопротивляться бактериям и вирусам, — клетки иммунной системы.
 Клинические проявления остеопетроза. Художник: Владислав Ефремов
Клинические проявления остеопетроза. Художник: Владислав Ефремов
Остеопетроз, впервые возникший у взрослых, имеет более благоприятное течение. Его наиболее характерные признаки — глухота, нарушения мимики, повышенная хрупкость костей, приводящая к частым переломам. После рентгенографического исследования диагноз не вызывает сомнений, но, несмотря на это, генетическое исследование остается необходимым. Выявление мутаций в конкретных генах помогает не только подобрать наиболее эффективную терапию, но и провести полное консультирование по планированию семьи и возможности развития заболевания у потомства.
А какие есть варианты терапии?
Начиная с 1904 года, когда немецкий радиолог Генрих Эрнст Альберс-Шенберг впервые опубликовал описание остеопетроза, природа и лечение этого заболевания оставались загадкой. И сейчас, имея под рукой весь арсенал методов генетического исследования, зная гены, мутации в которых ответственны за развитие остеопетроза, ученые не перестают работать над новыми подходами к терапии.
Наиболее эффективным методом при инфантильном остеопетрозе считается трансплантация гемопоэтических стволовых клеток (ТГСК), полученных из костного мозга, пуповинной или периферической крови донора. На текущий момент это единственная возможность спасти жизнь ребенку при АРО.
Почему помогают стволовые клетки?
Стволовые клетки крови (СКК) — это незрелые клетки с неограниченным потенциалом деления. Они не способны выполнять никакой функции, но это им и не нужно, ведь их главная роль — дать начало другим клеткам. Полученные в результате их деления клетки начнут созревать и займут свое место в строгой иерархии организма в соответствии со своими обязанностями. Остеокласты тоже происходят из СКК, именно поэтому ТГСК приводит к значимому улучшению пациентов. Другая не менее важная причина — восполнение пула клеток иммунной системы для снижения частоты и тяжести инфекционных заболеваний.
К сожалению, у этого метода есть ряд ограничений. Основное из них — необходимость подбора донора, подходящего пациенту по системе HLA. HLA — это совокупность генов, определяющих антигенную индивидуальность клеток человека. Они наиболее важны для системы иммунитета индивида, так как помогают ей отличать, где свои клетки, а где чужие. Поэтому, чтобы избежать реакции отторжения трансплантата, подбирают доноров, максимально близких по системе HLA к пациенту. Донор и реципиент стволовых клеток должны совпадать по 8 из 8 аллелей четырех генов системы HLA (такого донора называют идентичным) либо по 7 из 8. Если такого совпадения найти не получается, рассматривают возможность использования костного мозга менее подходящего донора.
Кроме того, не при всех типах остеопетроза проведение ТГСК будет эффективным. Так, если мутация локализуется в гене RANKL, продукт которого активирует созревание остеокластов, трансплантация не поможет. Также исследования не показали улучшения прогноза при ТГСК взрослым пациентам с остеопетрозом.
Доступны ли другие варианты лечения?
Интерферон-гамма показал свою эффективность при остеопетрозе, он включен в протоколы лечения тяжелого детского остеопетроза. Сейчас идут клинические исследования, в которых определяется возможность его применения и у взрослых пациентов. Интерферон-гамма способен увеличивать выработку лейкоцитами супероксида — молекулы кислорода с одним «лишним», неспаренным электроном, которая обладает большей способностью к окислению (то есть отдаче электрона). Этот процесс играет важную роль в резорбции костной ткани. Так как остеокласты имеют общее происхождение с лейкоцитами, они тоже способны вырабатывать супероксид. Поэтому исследователи еще в XX веке предположили, что интерферон-гамма может помочь пациентам с остеопетрозом восстановить дефицит этого продукта в костной ткани, и это предположение подтвердилось.
А как насчет генной терапии, которая устраняла бы причину?
В 2020 году было запущено клиническое исследование, организаторы которого решили проверить эффективность и безопасность генной терапии остеопетроза. Предполагалось с помощью лентивирусов заменять мутированный ген TCIRG1 в стволовых клетках пациента, на здоровый (как говорят биологи, «ген дикого типа»). Лентивирусы способны встраивать свой генетический материал в ДНК организма, ими зараженного, поэтому на их основе создают векторы для генной терапии. Добавление к вирусам здорового гена TCIRG1 и заражение ими стволовых клеток пациента позволило бы восполнить его функцию и восстановить работу остеокластов. Авторы планировали проверить свою гипотезу на двух детях с ювенильной формой остеопетроза. К сожалению, исследование было закрыто без объяснения причин.
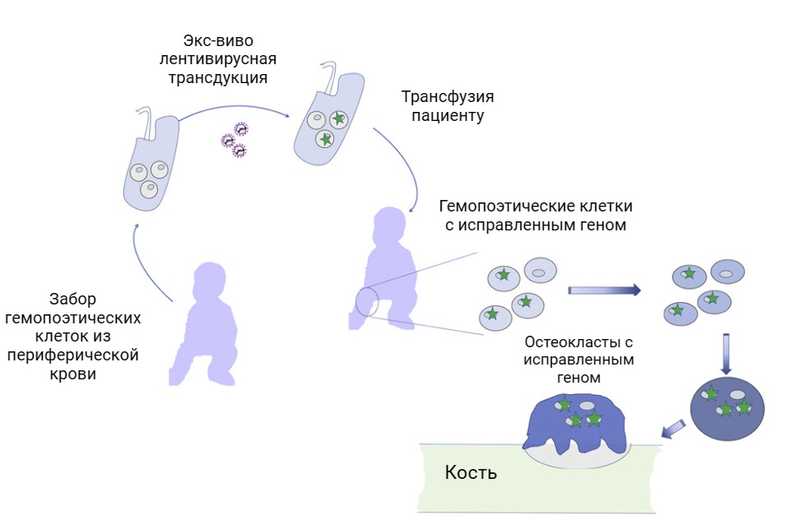 Генная терапия остеопетроза. Из крови пациента получают гемопоэтические клетки, лентивирусы доставляют в них ген TCIRG1 дикого типа, после чего клетки возвращают в организм пациента. Credit: Mol Ther Methods Clin Dev. 2021. DOI:
10.1016/j.omtm.2020.12.009
Генная терапия остеопетроза. Из крови пациента получают гемопоэтические клетки, лентивирусы доставляют в них ген TCIRG1 дикого типа, после чего клетки возвращают в организм пациента. Credit: Mol Ther Methods Clin Dev. 2021. DOI:
10.1016/j.omtm.2020.12.009
Тяжесть течения остеопетроза и его распространенность в отдельных регионах, таких как Чувашская республика, Коста-Рика, регион Вестерботтен в Швеции, дают стимул для медицинского сообщества как можно скорее определить основные звенья развития заболевания и точки приложения терапии. Поскольку генетические технологии становятся все более эффективными и доступными, можно надеяться на очередной прорыв, который поможет нам в борьбе с остепетрозом.
Смотреть видео про изучение остеопетроза


 Меню
Меню





 Все темы
Все темы




 0
0