Решения для контроля качества нуклеиновых кислот от Agilent
Контроль качества библиотек для секвенирования или образцов ДНК и РНК после экстракции— ключевые этапы работы с нуклеиновыми кислотами. Системы автоматизированного электрофореза компании Agilent Technologies облегчат этот процесс и будут полезны в любой лаборатории, где занимаются NGS. Рассказываем о приборах TapeStation в российских научных центрах.

TapeStation 4150
Credit:
SkyGen
У вас есть пробирка с ДНК или РНК, выделенной из биоматериала, либо продукт амплификации. Прежде чем перейти к дальнейшим дорогостоящим этапам работы, необходимо произвести проверку качества нуклеиновой кислоты — определить ее количество и целостность, а также чистоту, поскольку примеси белков или полисахаридов могут ингибировать химические реакции при создании библиотеки для секвенирования. Контроль качества нужен и после получения библиотеки, вне зависимости от протокола; иногда рекомендуют проводить несколько контролей в процессе подготовки библиотеки. В этом случае также проверяют количество (выход) НК, длины фрагментов и наличие контаминации — например, артефактов ПЦР.
Концентрацию ДНК в растворе и чистоту образца (присутствие белков, РНК или иных примесей) можно проконтролировать с помощью спектрофотометрии. Для этого, в частности, определяют соотношения показателей поглощения при определенных длинах волн (260/230 нм, 260/280 нм). Однако даже следовые количества РНК и белка затрудняют спектрофотометрическое определение концентрации ДНК. Этого недостатка лишен метод флуориметрии с применением флуоресцентных красителей, избирательно взаимодействующих с ДНК. Для количественного определения используются также методы на основе ПЦР в реальном времени.
Классический метод, позволяющий определять размер фрагментов ДНК, — гель-электрофорез. Метод замечателен своей наглядностью: положения фрагментов ДНК, мигрирующих в геле, определяется их длинами, так как короткие перемещаются быстрее длинных. «Мазки» под интересующим фрагментом указывают на появление более коротких молекул, то есть деградацию, «гало» в нижней части дорожки может свидетельствовать о присутствии РНК в образце ДНК. Концентрацию нуклеиновой кислоты можно приблизительно оценить по яркости полоски, сравнивая ее со стандартом — визуально, если вы опытный исследователь, или с помощью компьютерного анализа изображения.
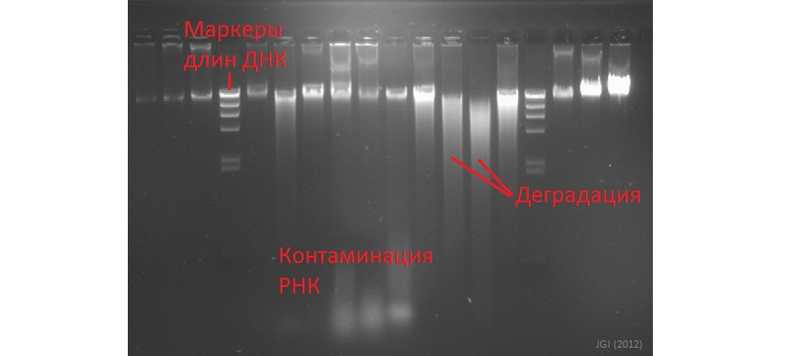
Методы одномолекулярного секвенирования от Pacific Biosciences или Oxford Nanopore требовательны к размеру молекул; важное преимущество этих методов — возможность получения длинных ридов. Для разделения крупных молекул рекомендуют гель-электрофорез в импульсном поле или гель-электрофорез с инверсией поля.
Традиционные электрофоретические методы требуют много времени и усилий. Все более популярным становится контроль качества ДНК с помощью приборов для капиллярного электрофореза, в том числе с применением микрофлюидных технологий. Для контроля качества ДНК микрофлюидным методом нужно специальное оборудование и расходные материалы; электрофорез проходит в капиллярах на готовом к использованию чипе. Подобные автоматизированные методы не только снижают трудозатраты и влияние человеческого фактора, но также минимизируют количества образца, необходимые для анализа и позволяют быстро получить результат. Кроме того, они более чувствительны, чем «традиционный» электрофорез.
Сейчас на российском рынке представлены системы для автоматизированного электрофореза компании Agilent. Так, Bioanalyzer 2100 отличается компактными размерами, его пропускная способность — 10–12 образцов. Он позволяет проводить электрофорез не только ДНК и РНК, но и белков.
 Bioanalyser 2100 | Credit: SkyGen
Bioanalyser 2100 | Credit: SkyGen
Анализаторы TapeStation 4150 и TapeStation 4200 — одни из самых популярных инструментов для контроля качества NGS-библиотек — используют чипы ScreenTape. На таком чипе 16 капилляров, заполненных гелем. Если требуется срочно исследовать малое количество образцов, можно провести электрофорез на нескольких дорожках, а остальные использовать позже, таким образом, расходы на один образец не зависят от количества образцов на цикл. Компания предлагает разные виды тейпов, адаптированные к различным задачам, в зависимости от того, анализируется ли РНК, геномная или бесклеточная ДНК, и какая необходима чувствительность. Пропускная способность TapeStation 4150 — от 1 до 16 образцов, TapeStation 4200 — до 96 образцов.
 TapeStation 4200 | Credit: SkyGen
TapeStation 4200 | Credit: SkyGen
PCR.NEWS выясняет у российских пользователей, для решения каких задач они приобрели системы автоматизированного электрофореза от Agilent и каковы их впечатления. Все три наших собеседника работают с TapeStation 4150, и в каждой из трех лабораторий его используют для контроля качества библиотек.
«На момент выбора это был единственный подходящий прибор под наши задачи»
Илья Кандинов (Центр высокоточного редактирования и генетических технологий для биомедицины, Институт молекулярной биологии имени В. А. Энгельгардта РАН):
— Прибор TapeStation 4150 изначально приобретался нами для анализа готовых NGS библиотек для полногеномного секвенирования. С его помощью мы оцениваем качество и количество финальной библиотеки каждого образца. Позднее мы стали использовать прибор для оценки ПЦР-продуктов и геномной ДНК. И наконец, для оценки ДНК после генно-инженерных манипуляций, таких как реакции рестрикции, лигирования и т.д.
 TapeStation 4150 | Фото: Илья Кандинов
TapeStation 4150 | Фото: Илья Кандинов
С какими объектами вы работаете?
Один из основных объектов нашего исследования — это Neisseria gonorrhoeae, возбудитель гонококковой инфекции. Для генно-инженерных задач и клеточных моделей мы используем стандартный объект исследования — кишечную палочку Escherichia coli.
Почему вы выбрали Agilent?
Нам был нужен прибор, чтобы проводить оценку готовых библиотек для NGS-секвенирования на Illumina. На момент выбора это был единственный подходящий прибор под наши задачи, обладающий необходимыми характеристиками и доступной ценой.
Какие его плюсы для вас наиболее важны? Быстрота получения результатов?
Да, несомненно. Очень хорошая чувствительность, скорость получения результатов, автоматическая обработка и интерпретация результатов. Например, в классическом агарозном гель-электрофорезе нужно вручную интерпретировать сигналы в лунках и оценивать длину ДНК фрагментов в соответствии с маркером; в данном приборе все происходит в автоматическом режиме.
Илья, а вы сравнивали результаты, полученные с помощью классического электрофореза и прибора, ручной метод и автоматический?
Да, мы даже проводили соответствующий эксперимент, когда прибор устанавливался. И первое, на что мы обратили внимание, это хорошая чувствительность прибора, которая позволяет выявлять меньшие концентрации целевого продукта по сравнению с классическим электрофорезом ДНК в агарозном геле.
Производительность, 16 образцов, вас устраивает?
Да. Как правило, один запуск на нашем приборе Illumina MiniSeq — это 12–96 образцов. Для нашего объекта исследования 12 образцов на запуск является оптимальным количеством, поэтому одного картриджа для TapeStation на 16 образцов нам вполне достаточно.
На ScreenTape не обязательно использовать все 16 дорожек одновременно?
Да, действительно. Данный прибор позволяет анализировать от одного до шестнадцати образцов за один запуск. При этом один картридж можно использовать несколько раз.
То есть можно сегодня запустить дорожки 1 и 2, завтра дорожки 3 и 4…
Да. Прибор сам напишет, что дорожки 1 и 2 уже использованы, загрузите, пожалуйста, дорожку 3.
А отрицательные моменты в работе с прибором были?
Для нас недостатком является высокая стоимость реагентики и расходных материалов. К сожалению, использовать прибор в ежедневных задачах получается на несколько порядков дороже, чем классические методы. Картриджи и реагенты необходимо покупать под конкретные задачи. Второй существенный недостаток — маленький срок годности картриджей и реагентов, не больше полугода.
«Честно говоря, не знаю, что может быть проще»
Михаил Эдельштейн, заведующий лабораторией антибиотикорезистентности НИИ антимикробной химиотерапии (Смоленск):
— Мы на этом приборе проверяем выделенную геномную ДНК микроорганизмов и библиотеки для секвенирования на платформе GridION Oxford Nanopore. Основное требование к таким образцам — минимальная фрагментация ДНК. Обычно значения N50 для секвенируемых образцов составляют 24–28 Kb. Это принципиально важно, потому что без длинных прочтений не удается правильно собрать ни хромосомную ДНК, ни тем более плазмиды. У бактерий много разных мобильных элементов и других повторов.
Вы работаете с патогенами?
Наша лаборатория занимается условно патогенными бактериями, которые чаще всего вызывают инфекции у госпитализированных пациентов. Прежде всего это три грамотрицательных возбудителя, наиболее проблемных в контексте антибиотикорезистентности: Klebsiella pneumoniae, Pseudomonas aeruginosa и Acinetobacter baumannii. Из грамположительных — в основном золотистые стафилококки (Staphylococcus aureus).
И вы собираете геномы de novo, чтобы найти факторы резистентности?
Да, это в основном de novo сборка для клинических изолятов. Для отдельных задач используем картирование на референсные геномы, когда есть референс. Но, как правило, это полная характеристика, включая сборку de novo, поиск важных детерминант антибиотикорезистентности (генов и мутаций), анализ их сцепления с мобильными элементами, расположения на плазмидах определенных типов. Такой анализ важен, поскольку именно сцепление с определенными мобильными элементами обеспечивает возможность горизонтального распространения генов резистентности. Есть задачи, которые связаны с анализом популяционной структуры возбудителей, клональности, родственности, эволюции каких-то хромосомных участков генома. Но еще раз: для нас очень важна длина прочтений, поэтому так важен контроль выделенной ДНК и библиотек.
Производительность TapeStation 4150 вас устраивает?
Более чем. Потому что мы контролируем далеко не все образцы, которые идут на геномное секвенирование. Мы флуорометрически контролируем концентрации для всех образцов геномной ДНК перед подготовкой библиотек и на разных этапах подготовки. Но электрофоретически мы контролируем качество выборочно. Как правило, после выделения ДНК какое-то количество образцов из общего пула проверяем на целостность ДНК. Если качество устраивает, то отправляем пул на подготовку библиотек. Точно так же, когда готовы библиотеки, обычно мы их не перепроверяем, если знаем, что все процедуры работают нормально. Но если мы видим, например, по результатам секвенирования, что отдельные образцы «выпадают», то проверяем качество библиотек и принимаем решение, готовить ли их повторно или даже перевыделять геномную ДНК.
Вы пробовали проверять качество библиотек на других приборах?
Да, мы долгое время использовали для фрагментного анализа относительно коротких амплификационных фрагментов Shimadzu MultiNA, прибор, который с аналитической точки зрения, наверное, сильнее. У него выше разрешающая способность для коротких фрагментов. Но сейчас анализ на Shimadzu стал, наверное, еще дороже, чем на Agilent.
Shimadzu — это Япония?
Да, это японский прибор. Электрофорез на кварцевых чипах, в микроканале. Там такой же принцип, примерно такая же производительность, единственное, что вы можете установить в него сразу плашку 96 образцов. В TapeStation 4150 – максимум 16. Но, как я говорил, для наших целей 16 вполне хватает. Ну а с точки зрения простоты использования — я, честно говоря, не знаю, что может быть проще Agilent. Нет никаких особых требований к образцам, ДНК может находиться растворах с разной ионной силой, например, допустимы достаточно высокие концентрации TE. Никакой предварительной подготовки «чипов»: ScreenTape — это готовые полоски с гелем для разеления ДНК. Фактически вы просто разводите ваш образец буферным раствором, в котором находится флуоресцентный краситель, помещаете его в пробирку для анализа, и все.
А техническое обслуживание?
У нас прибор появился относительно недавно, мы пока ни с какими техническими проблемами не сталкивались. То, что указано в руководстве по техническому обслуживанию прибора, — элементарно просто. В целом именно это мы и хотели. Обычно, чем больше общий парк оборудования, тем больше проблем. Но TapeStation — это простой и надежный прибор, который требует минимума человеческих ресурсов, очень удобный в работе и быстрый.
Экономит ваше время, а не тратит?
Это точно.
«Эта концентрация не истина в последней инстанции, зато — для каждого фрагмента»
Александр Друй, заведующий лабораторией молекулярной онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России (Москва):
— В первую очередь мы на нем делаем контроль качества библиотек перед NGS. Менее представленная задача — входящий контроль качества нуклеиновых кислот, в первую очередь РНК.
Вы работаете с образцами FFPE?
Практически тотально. Это 99% наших образцов.
Насколько я знаю, для этих образцов вопрос контроля качества стоит остро.
Да. Точнее, это зависит от того, какую нуклеиновую кислоту мы с вами обсуждаем. Если это ДНК, то ДНК там фрагментирована, но, конечно, она сохраннее, чем РНК. Если мы говорим про РНК, она еще более фрагментирована. Когда-то давно, еще не на TapeStation, а на 2100 Bioanalyzer, мы измеряли RIN — RNA Integrity Number — и всегда из парафина, из FFPE получали RIN около 2. Естественно, ни о какой сохранности рибосомальных пиков там речи не было. Высокофрагментированная РНК со средней длиной около 150 нуклеотидов.
Значит, до TapeStation у вас был Bioanalyzer?
Bioanalyzer, да. Мы с него начинали. Скажем так, предшественник TapeStation, он поменьше. Тоже хороший прибор для электрофореза. TapeStation удобней, потому что не надо заправлять картриджи гелем. Там уже есть картриджи — как пленочки с капиллярами, заполненными гелем, ты просто смешиваешь образец с загрузочным буфером и помещаешь в прибор, он даже сам накапывает на этот картридж.
И они бывают разные, под различные задачи. Вы какие используете?
Они бывают разные, для РНК и для ДНК. Для ДНК мы используем картриджи двух видов. То, что называется broad range, для широкого диапазона концентраций, и high sensitivity, которые адаптированы под низкие концентрации ДНК.
А низкие концентрации ДНК — это какие, например?
От десяти пикограммов на микролитр, как-то так.
Такой чувствительности можно достигнуть на классическом электрофорезе, или это нереально?
На обычном точно нет. Наверное, на полиакриламиде это можно сделать, но на обычном агарозном форезе — нереально. И к тому же капиллярный электрофорез позволяет не только оценивать размерный состав относительно маркера молекулярного веса, но и по уровню флуоресценции рассчитывать концентрацию. Да, это менее точно, чем, например, измерять концентрацию методом флуориметрии, с интеркалирующими красителями. Тем не менее это способ оценки концентрации, и в чем его преимущество — мы можем по площади под кривой рассчитать концентрацию молекул ДНК разного размера. А любые жидкостные методы, такие как Qubit, дают общую концентрацию всей ДНК, которая плавает в пробирке. Еще раз повторю, что концентрация, которую определяет TapeStation, не истина в последней инстанции, она не особенно точная. Зато — для каждого фрагмента.
Есть еще какие-то особенности прибора, привлекательные для вас?
Я бы сказал, он такая рабочая лошадка, у него достаточно живучие реактивы, он удобный в плане загрузки и запуска. Конечно, если сравнивать его со «старшими братьями», вроде Fragment Analyzer, о которых заявляют, что они могут разделять продукты с отличием в один-два нуклеотида, такого он не может — но у меня таких задач просто нету. А если понадобится, для этого есть капиллярный секвенатор. Под свои задачи этот прибор вполне адекватен.
Методы контроля качества нуклеиновых кислот соответствуют международным стандартам исследовательской работы и обеспечивают получение высококачественных данных. Высокая культура эксперимента, хорошие привычки с самых первых шагов научного пути особенно важны для российских лабораторий. Мы видим, что ведущие ученые, работающие и с эукариотическими, и с бактериальными геномами, уделяют контролю качества «входящих» образцов и NGS-библиотек самое пристальное внимание. Ведь если первый этап неудачен, все последующие этапы бессмысленны. Не пожалеть усилий и убедиться, что ДНК или РНК в вашем образце именно такая, как вам нужно, — правильное решение: «все, что делаешь, делай хорошо». В конечном счете эти усилия окупятся, сэкономят время и деньги исследователя. А инструменты от Agilent помогут вам в этом.
Партнерский материал


 Меню
Меню





 Все темы
Все темы




 0
0