Иммунный ответ в печени на терапию вирусными векторами подавляет блокада интерлейкина 1
В последнее время широко развиваются подходы для генной терапии различных заболеваний, но генная терапия может провоцировать иммунную реакцию в печени. Исследователи из США и Японии выяснили, что в ответ на терапию аденоассоциированными вирусами в печени активируются CD8+ Т-лимфоциты. Их активация зависит от сигнального пути IL-1-R1 – MyD88 и не зависит от Toll-подобного рецептора 9 или интерферонов 1 типа.
Credit:
Molecular Therapy. 2024. DOI: 10.1016/j.ymthe.2023.11.029 | CC-BY-NC-ND
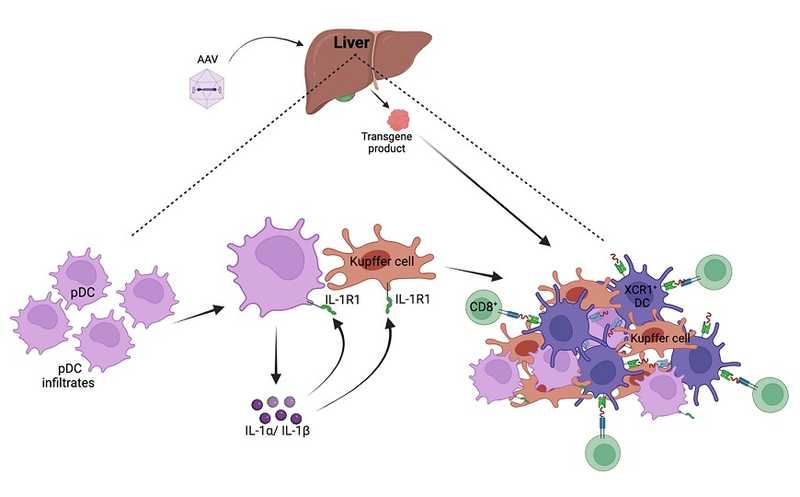
Генная терапия основана на введении в клетки организма здоровых копий гена вместо дефектных или отсутствующих. Чаще всего доставку генов осуществляют с помощью вирусных векторов. Однако иногда иммунная система пациента принимает вектор за реальную вирусную угрозу, что провоцирует развитие иммунной реакции. Авторы статьи в Molecular Therapy решили выяснить молекулярные механизмы активации CD8+ Т-лимфоцитов в печени в ответ на терапию аденоассоциированными вирусами (AAV).
В работе использовались флуоресцентно меченные аденоассоциированные вирусы серотипа 8 (AAV8) с геном овальбумина. Авторы внутривенно ввели AAV8 мышам дикого типа и мышам различных иммунодефицитных линий. В результате у животных было трансдуцировано примерно 20% гепатоцитов. При этом 70% мышей дикого типа имели в кровотоке CD8+ Т-клетки, специфичные к овальбумину, но таких клеток не было у мышей с дефицитом рецепторов CD4 и MHC II. Однако 62,5% мышей с дефицитом IFN 1 типа и 60% мышей с дефицитом TLR9 имели специфичные к овальбумину Т-лимфоциты. Это показывает, что сигналинг IFN 1 типа и TLR9 не нужен для формирования иммунного ответа на продукт генной терапии.
Примечательно, что Т-клетки, реагирующие на овальбумин, не образовывались у мышей с дефицитом белка MyD88, участвующего в передаче сигнала от Толл-подобных рецепторов, или с дефицитом IL-1R1 — рецептора интерлейкина 1 первого типа, который взаимодействует с MYD88. Следовательно, образование CD8+ Т-клеток, специфичных к продукту генной терапии, зависит от сигнального пути IL-1-R1 – MyD88.
IL-1R1 — это рецептор для IL-1a и IL-1b. Авторы решили проверить, какую роль эти два цитокина играют в иммунном ответе на генную терапию. После введения AAV с овальбумином мышей обрабатывали или антителами к IL-1a, или антителами к IL-1b, или комбинацией этих антител. Еще одна группа мышей получала антагонист человеческого IL-1R — препарат анакинру, применяемый при воспалительных заболеваниях. Одиночная блокада IL-1a или IL-1b уменьшала долю мышей, у которых были специфичные к овальбумину Т-клетки (до 33% или 55% соответственно). Комбинированная блокада обоих цитокинов вызывала еще большее снижение, аналогичное использованию анакинры (до 19–20%). Следовательно, и IL-1a, и IL-1b играют роль в иммунном ответе, однако IL-1a, видимо, более значим.
Далее авторы решили выяснить, какие клетки, инфильтрующие печень, продуцируют IL-1. Окраска на IL-1a и на различные поверхностные маркеры выявила клетки, экспрессирующие B220 и PDCA-1, — это плазмацитоидные дендритные клетки (pDC). Окрашивание на IL-1a и XCR1 выявило взаимодействие pDC с миелоидными дендритными клетками, с клетками Купфера и с CD8+ Т-лимфоцитами. С помощью проточной цитометрии авторы показали значительное повышение количества клеток Купфера и pDC через 1-2 недели после введения AAV. Эти результаты позволяют предположить, что иммунный ответ в печени на генную терапию зависит от взаимодействия XCR1+ миелоидных дендритных клеток с плазмацитоидными дендритными клетками и с клетками Купфера.
Полученные в ходе исследования результаты открывают возможности для повышения эффективности генной терапии с помощью аденоассоциированных вирусов. Нежелательный иммунный ответ в печени на терапию может быть подавлен блокадой IL-1.
«Концепцию защиты генных терапий путем блокирования определенных иммунных реакций можно применить ко многим генетическим заболеваниям, таким как гемофилия, лизосомные болезни накопления и метаболические заболевания», — говорит Роланд Херцог из Медицинской школы университета штата Индиана, один из руководителей исследования.
Источники
Kumar S.R.P., et al. TLR9-independent CD8+ T Cell Responses in Hepatic AAV Gene Transfer Through IL-1R1-MyD88 Signaling // Molecular Therapy. 2024. DOI: 10.1016/j.ymthe.2023.11.029
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








