Вакцина против разных штаммов ВИЧ стала на шаг ближе?
В журналах группы Science опубликовано четыре статьи о разработке вакцин против ВИЧ-1, которые индуцируют продукцию антител, нейтрализующих различные штаммы вируса. Только такая вакцина может обеспечить надежную защиту. Авторы статей разрабатывают технологию таргетирования зародышевой линии, которая подразумевает направление в нужную сторону созревания В-клеток с помощью последовательных иммунизаций специально сконструированными антигенами.

Частица ВИЧ-1 отделяется от мембраны инфицированной Н9 Т-клетки
Credit:
NIH | flickr.com
Эпидемия ВИЧ продолжается больше четырех десятилетий, однако одобренной вакцины до сих пор нет. Вакцина, которая надежно защитит человека от ВИЧ-1, должна индуцировать образование широконейтрализующих антител (антитела широкого спектра, ШНАТ или bnAb), то есть таких, которые нейтрализуют большинство циркулирующих штаммов. Даже «пассивное» введение таких антител может защитить от ВИЧ-инфекции (подробнее об антителе VRC01 на PCR.NEWS). В журналах группы Science вышло сразу четыре статьи, посвященных вакцинам, индуцирующим выработку антител широкого спектра против ВИЧ.
Ведущей стратегией в разработке вакцин против ВИЧ считается таргетирование зародышевой линии (germline-targeting, GT) — иммуногены, специфически воздействующие на наивные В-клетки человека, в которых мутируют гены иммуноглобулинов, с тем, чтобы в результате наивные клетки дали начало клонам, продуцирующим ШНАТ. (Подробнее об этой стратегии в нашем разборе.)
Все ШНАТ распознают эпитопы Env — оболочечного белка ВИЧ. Env — это тример из трех гетеродимеров, образованных гликопротеинами gp120 и gp41 (продукты расщепления белка gp160). Среди таких кластеров эпитопов — сайт связывания рецептора CD4 (CD4bs) или так называемый суперсайт гликозилирования N332 в петле V3 gp120 (V3-N332) — гликозилирование по этому сайту консервативно у различных подтипов ВИЧ, поэтому он важен.
ШНАТ у ВИЧ-инфицированных могут появиться спустя годы после инфекции, в ходе своеобразной коэволюции иммунной системы. Появляются первоначальные нейтрализующие антитела, вирус от них уклоняется, затем следует новый раунд эволюции В-клеток с дальнейшим «созреванием аффинности» нейтрализующих антител.
VRC01 и другие антитела этого класса связываются с сайтом CD4bs. Как и антитела, распознающие V3-N332, они часто обнаруживаются у пациентов. Вопрос в том, удастся ли вызвать вакцинацией быстрое появление подобных антител. Для этого необходимо, во-первых, активировать наивные В-клетки с подходящими генами иммуноглобулинов, а во-вторых, имитировать их последующую эволюцию с помощью последовательных иммунизаций. Это должно быть достигнуто правильным подбором иммуногенов для каждого этапа. За «праймингом» (активацией наивных В-клеток) должен следовать «шейпинг» клеток памяти и, наконец, «отделка» — появление В-клеток, нейтрализующих широкий спектр штаммов, при иммунизации антигенами, наиболее похожими на нативные. При этом клоны-предшественники продуцентов ШНАТ на каждом этапе могут быть вытеснены другими клонами.
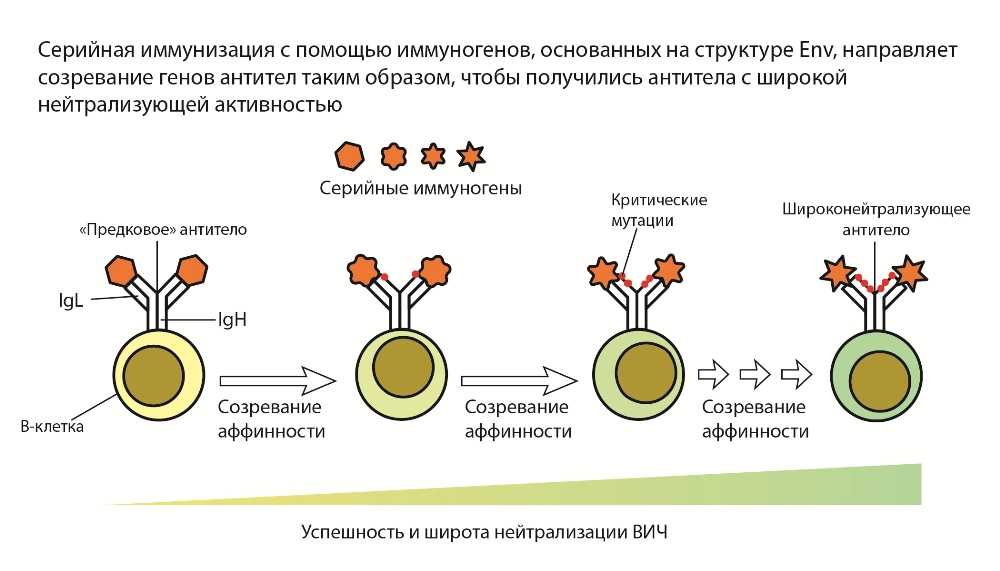 Серийная иммунизация направляет эволюцию В-клеток, чтобы получить клоны, которые продуцируют антитела, нейтрализующие различные штаммы. Источник: Science 2019. DOI: 10.1126/science.aaz8647 (с изменениями)
Серийная иммунизация направляет эволюцию В-клеток, чтобы получить клоны, которые продуцируют антитела, нейтрализующие различные штаммы. Источник: Science 2019. DOI: 10.1126/science.aaz8647 (с изменениями)
Для генерации ШНАТ используют модифицированные варианты оболочечного белка ВИЧ (Env), причем замены вносятся таким образом, чтобы направлять эволюцию В-клеток в нужную сторону и в итоге получить антитело, распознающее белки Env дикого типа, существующие в разных штаммах вирусов. Уильям Шифф, один из создателей концепции GT-вакцинации, назвал этот процесс shepherding, по ассоциации с работой пастушьих собак, которые гонят овец в нужном направлении. (Шифф — соавтор либо руководитель всех этих четырех работ.)
Пока еще не получена полная последовательность иммуногенов, необходимых для шепердинга, ведутся работы над первыми этапами — праймингом перспективных наивных В-клеток и первым раундом шейпинга (бустингом). Этим этапам посвящены четыре статьи, о которых идет речь.
Один из вариантов Env для GT, полученный командой Шиффа, — eOD-GT8, представляющий собой часть белка gp120. Он может формировать 60-мерные наночастицы и стимулирует образование ШНАТ класса VRC01, которые взаимодействуют с CD4-связывающим сайтом gp120. Исследователи продемонстрировали переход ко второму этапу — шейпингу, созреванию клеток памяти.
Авторы статьи в Science Translational Medicine, Кристофер Коттрелл и его коллеги, вводили 60-мер (вероятно, это должно читаться как «эксинтомер», от εξήντα — «шестьдесят») белка eOD-GT8 трансгенным мышам, экспрессирующим В-клеточные рецепторы класса VRC01, — это был прайминг. А затем мышей вакцинировали другим иммуногеном — 60-мером core-g28v2. (То и другое вводили как в виде белка, так и в виде мРНК, кодирующей белок.) В результате этой бустерной вакцинации появились антитела класса VRC01, которые успешно нейтрализовали ВИЧ-подобные псевдовирусы в культуре. Правда, в оболочечном белке этих псевдовирусов отсутствовало гликозилирование по определенному сайту, которое у вирусов дикого типа препятствует нейтрализации, но авторы рассчитывают, что эту проблему удастся решить. Они полагают, что второй иммуноген можно включать в фазу 1 клинических исследований IAVI G002, вслед за IAVI G001, в которой исследуется 60-мер eOD-GT8.
Сюэсун Ван и его коллеги (статья в Science Immunology) вводили мышам мРНК в липидных наночастицах, кодирующую eOD-GT8, а затем в такой же форме — один из трех иммуногенов для бустерной фазы. Они перенесли мышам несколько различных линий гуманизированных В-клеток, чтобы имитировать конкуренцию между В-клетками, возникающую во время иммунизации. Они подтвердили, что мРНК-вакцина подходит для этапа прайминга.
Авторы двух других статей использовали иммуноген N332-GT5 с адъювантом на основе сапонина, который должен был стимулировать генерацию антител к сайту V3-N332. Джон Стейхен с коллегами протестировали тример N332-GT5 на восьми макаках-резусах, иммунная система которых намного ближе к человеческой, чем у мышей. У всех животных активировались и пролиферировали предшественники В-клеток, секретирующих ШНАТ класса BG18. Таким образом, и этот иммуноген подходит для первой стадии GT.
В четвертой статье (Чжэньфэй Сэ с соавторами) описано, как гуманизированным мышам вводили мРНК в липидных наночастицах, кодирующую N332-GT5, а затем один из двух иммуногенов бустерного этапа, которые должны были уменьшить неспецифическое связывание антител. При этом также активировались и пролиферировали В-клетки, секретирующие антитела-предшественники BG18.
Тример N332-GT5 уже проходит фазу 1 клинического исследования. Про КИ вакцин на основе 60-мерных наночастиц, как белков, так и мРНК, мы писали в 2022 году.
Исследования на животных имеют понятные ограничения. Тем не менее в трех из четырех работ рассмотрен этап шейпинга антител против ВИЧ, и результаты дает надежду, отмечают авторы обзора в Science.
Три дозы вакцины против ВИЧ вызвали появление антител, нейтрализующих разные штаммы
Источники
Christopher Cottrell, et al. Heterologous prime-boost vaccination drives early maturation of HIV broadly neutralizing antibody precursors in humanized mice // Science Translational Medicine. 16 May 2024. DOI: 10.1126/scitranslmed.adn0223
Xuesong Wang, et al. mRNA-LNP prime boost evolves precursors toward VRC01-like broadly neutralizing antibodies in preclinical humanized mouse models // Science Immunology. 16 May 2024. Vol 9, Issue 95. DOI: 10.1126/sciimmunol.adn0622
Jon Steichen, et al. Vaccine priming of rare HIV broadly neutralizing antibody precursors in nonhuman primates // Science, 17 May 2024. Vol 384, Issue 6697. DOI: 10.1126/science.adj8321
Zhenfei Xie, et al. mRNA-LNP HIV-1 trimer boosters elicit precursors to broad neutralizing antibodies // Science, 17 May 2024. Vol 384, Issue 6697. 10.1126/science.adk0582


 Меню
Меню





 Все темы
Все темы




 0
0







