Есть ли надежда на вакцину от ВИЧ?
Недавно начались клинические испытания мРНК-вакцин против ВИЧ. Против COVID-19 мРНК-вакцины выступили на отлично, вдруг они и СПИД сумеют победить? Спойлер: в любом случае не так быстро, путь предстоит длинный.
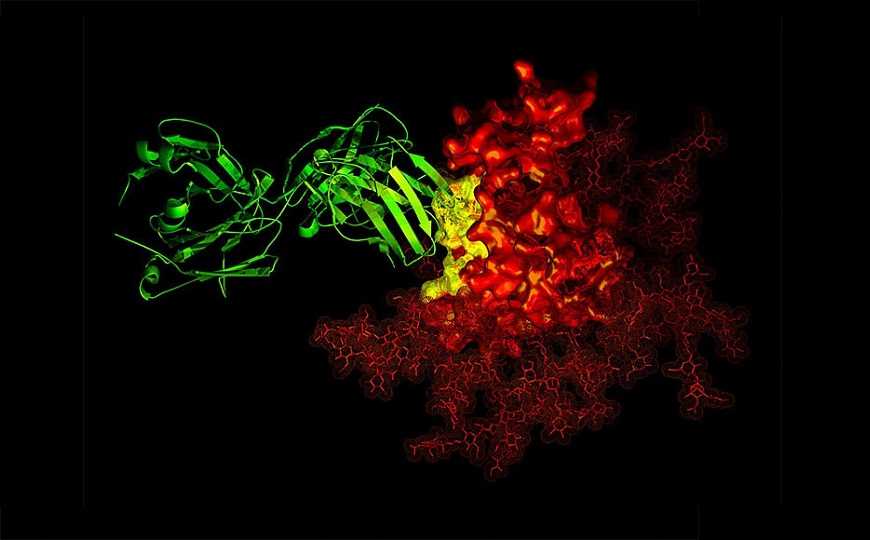
Широконейтрализующее антитело B12 (зеленый цвет) в контакте с мишенью (желтый) на gp120 ВИЧ-1 (красный).
Credit:
NIH | flickr.com
Национальные институты здравоохранения (NIH) 14 марта 2022 года начали первую фазу клинических испытаний вакцины mRNA-1574 от ВИЧ, разработанной компанией Moderna. Ежегодно ВИЧ заражает 1,8 миллиона человек, что делает разработку вакцины приоритетной задачей. Новости об исследованиях вакцин от ВИЧ периодически появляются, но действенной вакцины до сих пор нет. В этом материале мы разбираемся, какие подходы сейчас считаются перспективными.
Что нужно знать про структуру ВИЧ в контексте создания вакцины?
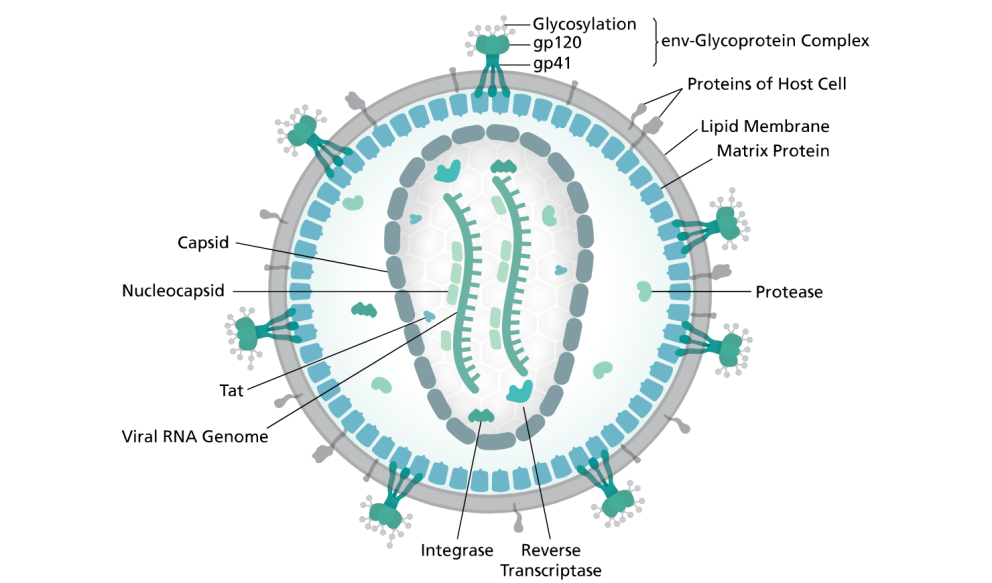
Единственный вирусный белок на поверхности частицы ВИЧ — оболочечный гликопротеин ВИЧ (Env) — это тример из трех гетеродимеров, образованных гликопротеинами gp120 и gp41 (продукты расщепления белка gp160). Env отвечает за связывание с клеточным рецептором CD4 и его корецептором — чаще всего CCR5 или CXCR4.
 Credit: Википедия CC BY-SA 4.0
Credit: Википедия CC BY-SA 4.0
Поскольку только белок Env экспонирован на поверхность вируса, то иммунный ответ при вакцинации в большинстве кандидатных вакцин нацелен именно на него. Env сильно гликозилирован — гликаны составляют до 50% его общей массы. Гликопротеин gp41 содержит трансмембранный участок и отвечает за заякоривание Env в мембране, а в состав gp120 входит сайт связывания рецептора CD4.
Почему вакцинация нативным белком Env не защищает от ВИЧ-инфекции?
Клинические исследования вакцины VaxSyn, представляющей собой рекомбинантный белок gp160, были проведены еще в конце 1980-х (см. таблицу 1 в обзоре 2020 года «Major Scientific Hurdles in HIV Vaccine Development: Historical Perspective and Future Directions»). Несмотря на появление нейтрализующих антител у вакцинированных людей, она не предотвращала заражение ВИЧ. Сейчас ученые считают, что причина в высокой вариабельности вируса. Антитела к вариабельным доменам одного варианта вируса не защищают от других вариантов.
Какие еще стратегии создания вакцины от ВИЧ были испытаны?
Попыток было множество — всего проводилось более 250 клинических исследований различных вакцин. В 1988–2003 годах в качестве вакцин тестировали разные варианты белка Env. Испытывали как инъекции рекомбинантного белка, так и его доставку векторами на основе вирусов коровьей или птичьей оспы. Иногда вакцина включала также и другие вирусные белки.
К вирусным белкам добавляли адъюванты, в том числе таргетные — способствующие активации определенных типов иммунных клеток.
В 2004–2008 годах, когда не оправдались первые надежды на вакцины, вызывающие выработку антител, начали появляться вакцины, нацеленные на T-клеточный ответ — а именно на активацию CD8+, или цитотоксических, T-клеток, которые играют ключевую роль в борьбе с ВИЧ-инфекцией. Их активация происходит за счет узнавания главного комплекса гистосовместимости первого класса (MHC I), презентирующего на поверхности клеток человека вирусные пептиды из цитоплазмы клетки.
Внеклеточные антигены (например, белки бактерий или компоненты белковой вакцины против ВИЧ) презентируются на MHC II и не активируют цитотоксические Т-клетки. Они могут активировать CD4+-Т-клетки, или Т-хелперы, но этот тип ответа менее желателен. Поэтому вакцины, активирующие CD8+ Т-клетки, должны работать аналогично вирусам — содержать ген или мРНК, проникать в клетку и там вызывать экспрессию антигена.
Так как MHC I презентирует пептиды всех внутриклеточных белков (и собственных белков клетки, и всех белков вируса, поразившего клетку), вакцина, нацеленная на T-клеточный ответ, теоретически может включать широкий спектр белков вируса, а не только Env. В клинических исследованиях HVTN 502, HVTN 503 и HVTN 505 тестировали вакцины, основанные на аденовирусах или инъекции ДНК, доставляющих гены вирусных белков Gag, Pol и Nef (и в одном случае также Env).
Названия многих клинических исследований, о которых пойдет речь, содержат аббревиатуру HVTN — «в честь» HIV Vaccine Trial Network, организации по клиническим исследованиям вакцин от ВИЧ, которая действует с 2003 года. Она не занимается созданием вакцин, но большая часть их клинических исследований проходит через неё.
Интересно, что белковые вакцины все-таки могут до некоторой степени активировать CD8+ T-клетки, если содержат адъювант, увеличивающий сродство к дендритным клеткам. Дело в том, что дендритные клетки способны осуществлять кросс-презентацию, то есть презентацию внеклеточного патогена на MHC I.
Позже появились мозаичные вакцины — они представляют собой аденовирус, доставляющий различные компоненты различных подтипов вируса. Одно клиническое испытание мозаичной вакцины уже завершено, но точка в этой истории пока не поставлена.
Далее были испытаны, но не оправдали надежд вакцины, основанные на пассивной инъекции широконейтрализующих антител (о таких антителах читайте ниже). И, наконец, на текущем историческом этапе начали тестировать вакцины, нацеленные на генерацию широко нейтрализующих антител.
Какой максимальной эффективности вакцины удалось достичь?
Статистически значимой эффективности удалось достичь лишь в одном клиническом исследовании (КИ) — RV144, также известном как «тайское исследование». Она составила 31,2% спустя 42 месяца после вакцинации. В этом КИ были объединены две ранее изученные вакцины: 3 праймирующие дозы были основаны на модифицированном вирусе птичьей оспы, который доставлял гены белков Env, Gag, Pol, а буст-доза представляла собой комбинированный гликопротеин gp120 двух подтипов ВИЧ, которые используют для проникновения в клетку хозяина корецепторы CCR5 и CXCR4 соответственно. Впрочем, результаты этих клинических исследований поставили под сомнение, когда в 2020 году модифицированная и более иммуногенная версия вакцины в КИ HVTN 702 показала нулевую эффективность в защите от заражения ВИЧ.
В 2021 году завершились КИ Imbokodo среди женщин в Африке. Исследуемая вакцина была мозаичной. Эффективность достигла 25% с 95%-ным доверительным интервалом от -10,5 до 49,3%, но этот результат статистически не значим. Фаза 3 КИ Mosaico, в которых тестируется на другой группе риска другая схема вакцинации — та же аденовирусная вакцина, что в Imbokodo, дополненная другими белками — еще продолжается.
Что такое широконейтрализующие антитела к ВИЧ и можно ли их получить с помощью вакцинации?
У 20–30% людей, зараженных ВИЧ, спустя несколько лет образуются антитела, способные таргетировать различные генетические варианты ВИЧ, поскольку они распознают консервативные эпитопы. На такие широконейтрализующие антитела (bNAb, ШНАт) возлагают большие надежды. Однако нативные тримеры Env не подходят для их получения. Поэтому разработчики вакцин создают модифицированные тримеры.
Интересная методология была разработана группой Уильяма Шифа, иммунолога из Института Скриппса и исполнительного директора по разработке вакцин в Центре нейтрализующих антител некоммерческой организации IAVI (Международная инициатива по вакцине против СПИДа). Это germline targeting, или нацеливание на зародышевую линию. Такая вакцина должна инициировать созревание предшественников В-клеток, вырабатывающих ШНАт.
Широконейтрализующие антитела против ВИЧ имеют особенности, нехарактерные для других антител. Например, у них длиннее участок тяжелой цепи иммуноглобулина, контактирующий с Env (HCDR3). В ходе созревания В-клетки гены иммуноглобулина мутируют, чтобы увеличить аффинность антител к антигену; в генах ШНАт частота мутация особенно высока, в результате В-лимфоциты, производящие ШНАт, относительно редки, их трудно отобрать. Поэтому для вакцинации, которая должна обеспечить появление ШНАт, используются не только специально сконструированные белки, но и особая стратегия иммунизации, которая повышает количество таких клеток.
Первая иммунизация активирует и увеличивает численность наивных В-клеток, экспрессирующих немутированные антитела, способные эволюционировать в ШНАт. Второй иммуноген «отбирает» среди ответивших на первую иммунизацию В-клеток те, которые имеют подходящие соматические мутации. В итоге серия иммунизаций, где каждый следующий иммуноген более специфичен, чем предыдущий, приводит к отбору В-клеток с «нужными» мутациями, производящих ШНАт (подробнее). Этот процесс Шиф назвал «shepherding», по аналогии с тем, как пастушьи собаки направляют овец, чтобы те бежали в верном направлении.
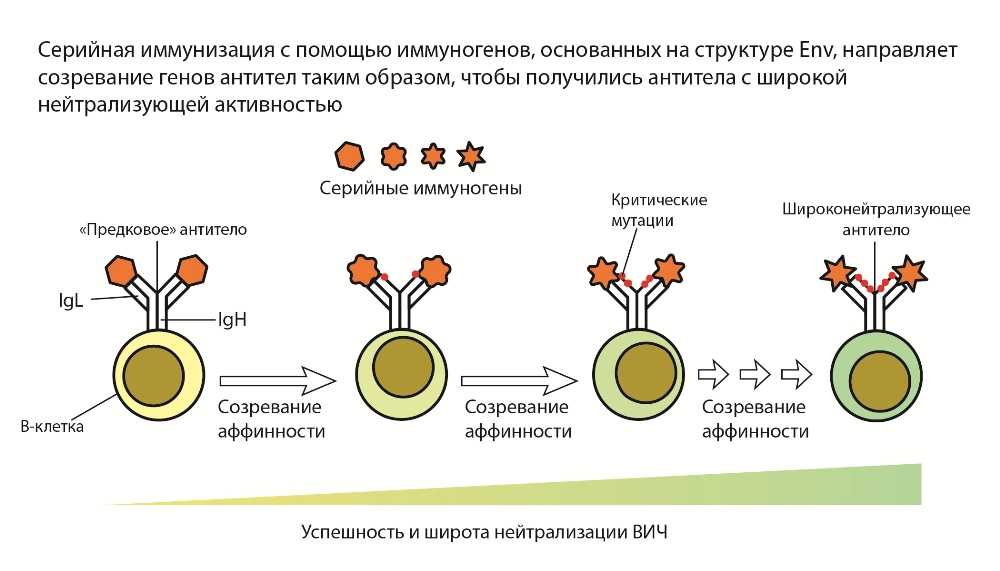 Путь к вершине эволюции В-клетки — продукции широконейтрализующих антител против ВИЧ. Источник: Science 2019. DOI: 10.1126/science.aaz8647 (с изменениями)
Путь к вершине эволюции В-клетки — продукции широконейтрализующих антител против ВИЧ. Источник: Science 2019. DOI: 10.1126/science.aaz8647 (с изменениями)
Чем отличаются модифицированные тримеры Env, нацеленные на генерацию ШНАт?
Первый стабильный тример BG505 SOSIP.664 для вакцинации был создан в 2013 году. В структуру Env внесли следующие изменения: соединили S-S связью белки gp120 и gp41 (в нативной версии Env они связаны нековалентно); заменили один из изолейцинов gp41 на пролин, чтобы зафиксировать состояние белка до слияния с клеткой; улучшили сайт расщепления фурином исходного белка gp160, чтобы расщепление на gp120 и gp41 было более полным; удалили часть белка gp41, необходимую для связывания с мембраной.
В дальнейшем структуру тримера BG505 SOSIP.664 еще оптимизировали, проведя модификацию MD39 — замены некоторых аминокислот на гидрофобные, которые создали новые гидрофобные взаимодействия, дополнительно фиксирующие белок в закрытом состоянии и уменьшающие экспонирование высоковариабельной петли V3.
Такой белок был основой, все еще не нацеленной на генерацию определенного класса ШНАт. Команда Уильяма Шиффа провела эволюционный отбор вариантов Env, связывающих ШНАт класса PGT121, с использованием клеточного дисплея, а потом перенесла выявленные мутации на искусственный тример. Широконейтрализующие антитела PGT121 — это антитела, зависимые от гликозилирования по так называемому суперсайту гликозилирования N332 – такое гликозилирование консервативно у различных подтипов ВИЧ.
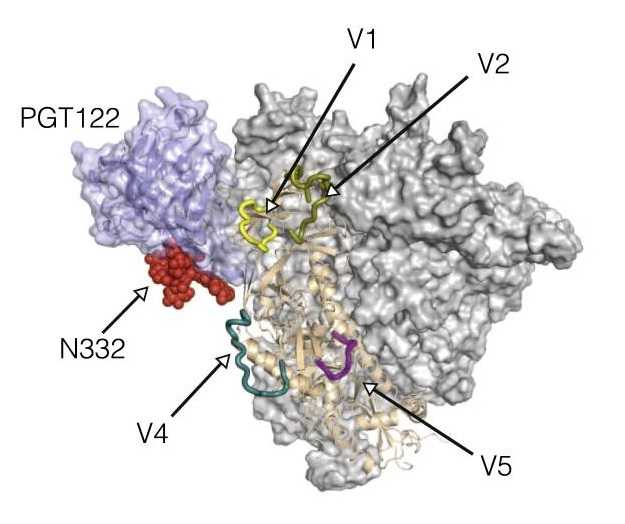 Антигенсвязывающий фрагмент PGT122 (сиреневый цвет, полупрозрачная поверхность) взаимодействует с тримером gp140 BG505 SOSIP Вид сбоку, цветами показаны вариабельные петли и сайт N332 одной из субъединиц тримера. Credit: Immunity. 2016. DOI: 10.1016/j.immuni.2016.08.016 | CC
Антигенсвязывающий фрагмент PGT122 (сиреневый цвет, полупрозрачная поверхность) взаимодействует с тримером gp140 BG505 SOSIP Вид сбоку, цветами показаны вариабельные петли и сайт N332 одной из субъединиц тримера. Credit: Immunity. 2016. DOI: 10.1016/j.immuni.2016.08.016 | CC
Эти антитела кажутся перспективными, поскольку наиболее часто формируются у людей с ВИЧ, вероятно, из-за доступности этого консервативного гликана, расположенного на «верхушке» тримера. Помимо этого, авторы отбирали варианты, нацеленные на зародышевую линию B-клеток. Полученный вариант тримера — BG505 MD39 — лег в основу мРНК-вакцины (наконец-то мы до нее дошли в нашей истории!).
Еще один искусственный вариант Env, также полученный командой Шиффа и тоже предназначенный для нацеливания на зародышевую линию — eOD-GT8, «искусственный внешний домен», представляющий собой часть белка gp120. Он способен самостоятельно формировать 60-мерные наночастицы и нацелен на образование ШНАт класса VRC01, которые взаимодействуют с CD4-связывающим сайтом gp120. Подобные антитела были получены от ВИЧ-инфицированных, разработчики рассчитывают получить их и в ответ на вакцину.
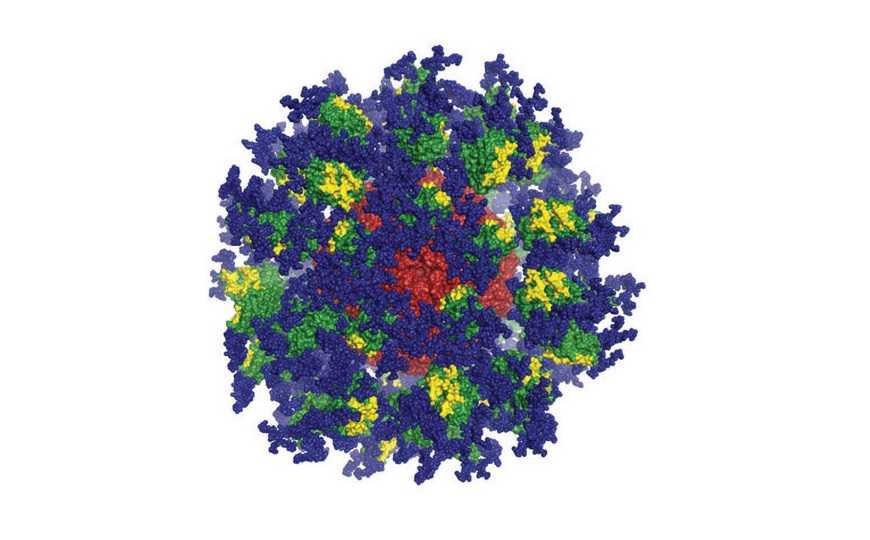 60-мер eOD-GT8. Credit: Пресс-релиз JAVI
60-мер eOD-GT8. Credit: Пресс-релиз JAVI
Значит, мРНК-вакцины против ВИЧ будут содержать гены этих модифицированных вариантов Env?
Различные искусственные варианты Env уже начали тестировать в клинических исследованиях в виде белков. Например, первую фазу клинических испытаний белковой вакцины, основанной на BG505 SOSIP.664, планируют завершить совсем скоро — в мае 2022 года. Теперь решили обратиться к мРНК-технологии.
В компании Moderna воспользовались опытом, приобретенным при разработке мРНК-вакцин от SARS-CoV-2, для создания прототипов мРНК-вакцины от ВИЧ . Клинические исследования HVTN 302 вакцины на основе мРНК BG505 MD39 начались 14 марта 2022 года. В них будут участвовать три варианта вакцины: 1) BG505 MD39.3 mRNA; 2) BG505 MD39.3 gp151 mRNA; 3) BG505 MD39.3 gp151 CD4KO.
Разработчики не раскрывают, чем именно отличаются эти варианты. По всей видимости, gp151 — указание на размер белка (стандартный BG505 SOSIP — это gp140). В третьем варианте вакцины, вероятно, снижена аффинность BG505 к CD4. Связывание иммуногенного белка с CD4 имеет ряд негативных последствий: снижение эффективной дозы иммуногена, маскирование эпитопов.
В Moderna эта вакцина имеет внутреннюю маркировку mRNA-1574, а клинические исследования обозначены как HVTN 302.
Так чья вакцина?
Короткого ответа нет: большие проекты не делаются одними руками. Последовательности мРНК в составе вакцин созданы исследователями Консорциума Скриппса по разработке вакцин против ВИЧ/СПИДа (CHAVD), финансируемого NIAID, Института Скрипса, Центра нейтрализующих антител IAVI, финансируемого Фондом Билла и Мелинды Гейтс, и Moderna, говорится в пресс-релизе Национальных институтов здравоохранения США. Производит вакцины Moderna по контракту с NIAID.
Как будут проходить клинические испытания?
Шесть групп по 18 человек получат внутримышечную инъекцию одной из трех мРНК-вакцин в дозе 100 или 250 мкг. Всего будет три дозы вакцины: на старте испытаний, через 2 месяца и через 6 месяцев. Возраст участников — от 18 до 55 лет. В ходе первой фазы исследователи проверят, формируются ли IgG антитела к тримеру BG505 и его отдельным эпитопам, и выяснят, способны ли антитела сыворотки нейтрализовать штамм вируса HIV-1. Изучат также T-клеточный ответ и возможные побочные эффекты вакцинации.
В январе 2022 года сообщалось о начале КИ вакцины против ВИЧ, разработанной компанией Moderna — это другая вакцина?
Даже две вакцины, и для них тоже использованы наработки команды Шиффа. Moderna совместно с IAVI участвовала в разработке мРНК-вакцин от ВИЧ на основе 60-мерных наночастиц — mRNA-1644 (eOD-GT8) и mRNA-1644v2-Core (Boost Core-g28v2).
Первая фаза клинических исследований началась 27 января 2022 года. Сорок восемь участников получат одну или две дозы mRNA-1644, из них 32 — также буст mRNA-1644v2-Core. Еще 8 человек получат только mRNA-1644v2-Core. Одна из задач этих клинических исследований – понять, насколько прайм-буст схема действительно способствует созреванию желаемых B-клеток.
Ранее eOD-GT8 тестировали в клинических исследованиях в виде белка, и результат был обнадеживающим: у 97% получивших вакцину наблюдался B-клеточный ответ.
Есть надежда, что эти мРНК вакцины окажутся спасением от ВИЧ?
Пока непохоже. Сами разработчики рассматривают их как «исследовательские», сообщают в пресс-релизе на сайте HVTN. Исследовательские вакцины не предполагают создания защиты от ВИЧ, но позволяют ученым продвинуться в изучении иммунного ответа на разные варианты кодируемых белков и понять, будет ли ответ на мРНК-вакцины отличаться от ответа на белковые вакцины.
«Применение мРНК-технологии к исследованиям вакцин от ВИЧ — определяющий момент для этой области знаний», — отметил Ларри Кори, ведущий исследователь HVTN.
PS. Есть и еще один способ: доставка гена широконейтрализующего антитела, например, VRC07, с помощью вирусного вектора. Зачем этот долгий и мучительный процесс серийной иммунизации, если можно заставить клетки организма сразу вырабатывать «правильное» антитело? (Правда, только одного типа.) Предполагается, что такая вакцина может действовать как терапевтическая, уменьшая резервуары вируса в организме ВИЧ-инфицированного. Результаты первой фазы дают основания для осторожного оптимизма: у некоторых участников экспрессия антитела оставалась на высоком уровне несколько лет.


 Меню
Меню





 Все темы
Все темы




 0
0