Восстановление иммунного ответа после химиотерапии активируется микрофлорой кишечника
Исследователи из Японии установили в экспериментах на мышах, что восстановление количества нейтрофилов в крови после трансплантации стволовых клеток или химиотерапии зависит от кишечного микробиома. Так, назначение мыши антибиотиков замедляло этот процесс.
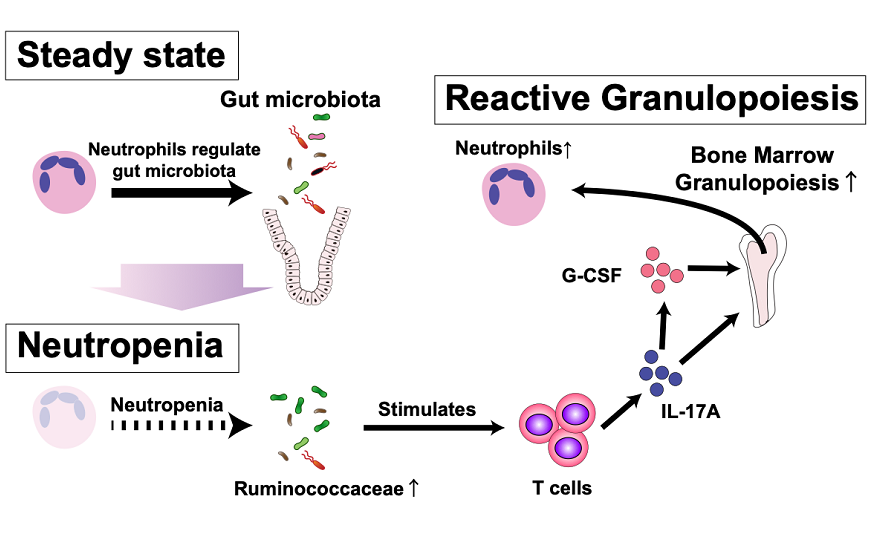
В нормальных условиях нейтрофилы регулируют микробиоту кишечника. Когда количество нейтрофилов падает, состав кишечной микробиоты изменяется, заставляя Т-клетки вырабатывать IL-17A, который, в свою очередь, активирует продукцию нейтрофилов в костном мозге (реактивный гранулопоэз).
Credit:
Daigo Hashimoto | Пресс-релиз
Важнейший элемент врожденной иммунной системы — нейтрофилы, фагоциты, уничтожающие патогены. Низкое количество нейтрофилов в крови (нейтропения) индуцирует гранулопоэз — образование зернистых лейкоцитов, к которым относятся и нейтрофилы, однако механизмы запуска гранулопоэза при падении количества нейтрофилов до конца не изучены. Сотрудники медицинского факультета Университета Хоккайдо (Япония) обнаружили на моделях мышей, что решающую роль в этом играет кишечный микробиом.
Различают экстренный гранулопоэз, обусловленный присутствием бактерий, и реактивный гранулопоэз, который происходит в отсутствие микробных инфекций. Реактивный гранулопоэз возникает после нейтропении, вызванной трансплантацией гемопоэтических стволовых клеток (которая сопровождается подавлением собственного иммунитета пациента) или химиотерапии рака.
Японские исследователи хотели понять, с помощью каких механизмов нейтропения включает гранулопоэз в двух последних сценариях. Они вызывали длительную нейтропению у мышей (трансплантацией стволовых клеток или противоопухолевым препаратом 5-фторурацилом) и измеряли у них уровни цитокинов, связанных с гранулопоэзом. Увеличилось количество двух цитокинов: гранулоцитарного колониестимулирующего фактора (G-CSF) и интерлейкина 17A (IL-17A). Рост количества нейтрофилов был значительно замедлен у мутантных мышей с дефицитом IL-17A или Т-клеток, а когда таким мышам вводили Т-клетки от мышей дикого типа, рост ускорялся. Таким образом, IL-17A имеет решающее значение для восстановления нейтрофилов, и его основной источник — Т-клетки.
Ранее в других исследованиях было показано, что микробиом кишечника и гемопоэз костного мозга могут влиять друг на друга. Авторы новой работы обнаружили, что если кишечная микрофлора мыши подавлялась антибиотиками, Т-клетки снижали выработку IL-17A и восстановление нейтрофилов нарушалось. Если же мышам со стерильным кишечником трансплантировали фекальную микробиоту от мышей с нейтропенией (но не от контрольных, у которых нейтропении не было), то гранулопоэз у них активировался.
Это позволяет сделать вывод, что микробиота, связанная с нейтропенией, может стимулировать реактивный гранулопоэз. При нейтропении контроль микробиома кишечника со стороны нейтрофилов ослабевает, увеличение количества некоторых таксонов (например, руминококков) стимулирует Т-клетки, они начинают вырабатывать IL-17A, и это активирует производство новых нейтрофилов.
Открытие может иметь клиническую значимость, поскольку быстрое восстановление нейтрофилов после трансплантации стволовых клеток и химиотерапии снижает риск инфекций. Авторы надеются в будущем установить, существуют ли перекрестные взаимодействия микробиома кишечника и гранулопоэза у людей. Возможно, удастся подобрать антибиотики, которые не будут полностью уничтожать бактерии, поддерживающие гранулопоэз.
Источник
Xuanzhong Chen, et al. Reactive granulopoiesis depends on T-cell production of IL-17A and neutropenia-associated alteration of gut microbiota // PNAS USA, November 21, 2022. 119 (48) e2211230119. DOI: 10.1073/pnas.221123011


 Меню
Меню





 Все темы
Все темы




 0
0








