Илья Кофиади и молекулярная кухня иммунных реакций
Об особенностях работы иммунной системы при коронавирусной инфекции, трансплантации и онкопатологиях рассказал д.б.н. Илья Андреевич Кофиади (Институт иммунологии ФМБА России) на лекции научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье». Это третья лекция в блоке, посвященном иммунной системе. Команда PCR.NEWS за два года пандемии очень много узнала об иммунном ответе, тем не менее мы сами прослушали эту лекцию с большим интересом. Всегда полезно систематизировать знания.
Главные действующие лица
Во всех учебниках врожденная и адаптивная иммунные системы рассматриваются отдельно друг от друга. Однако на самом деле это деление весьма умозрительное. Существует очень много мест, где врожденная иммунная система и адаптивная иммунная система взаимодействуют.
Возникновение адаптивной, более сложной, иммунной системы происходит довольно поздно. Бурное развитие адаптивных реакций и адаптивного иммунитета происходит у хордовых животных, начиная с челюстноротых. Это связано с изменением антигенного окружения. У челюстноротых появляется челюсть, меняются гастрономические пристрастия, животные постепенно выходят на сушу, меняется окружающий их репертуар антигенов, возникает необходимость защитить организм от них.
Одновременно с этим идет развитие рецепторного аппарата клеток иммунной системы, тех молекул, которые призваны специфически распознавать окружающие антигены и запускать наиболее правильную реакцию.
Плюрипотентная стволовая клетка дает начало двум большим ветвям иммунных клеток: клетки лимфоидного ряда, к которым относятся Т- и В-лимфоциты, NK-клетки и дендритные клетки, и клетки миелоидного ряда (миелоидные клетки). Управляют выбором пути развития цитокины.
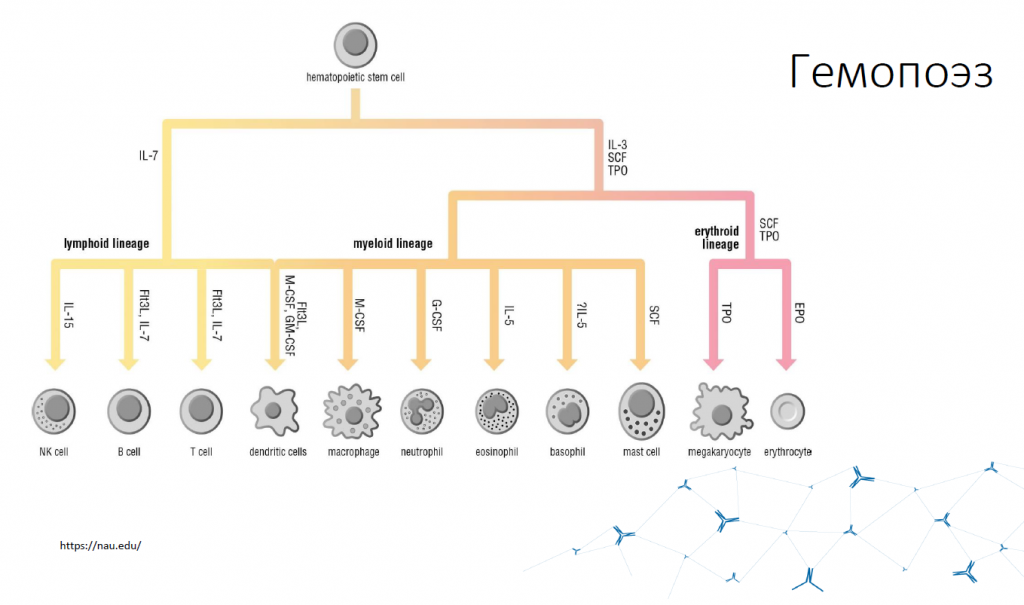
Иммунные механизмы, например, антигенное распознавание, обеспечиваются ограниченным количеством молекул, а вот связь всех клеточных и гуморальных факторов в единое целое осуществляется гораздо большим числом факторов. Это связано с тем, что иммунная система анатомически очень рассредоточена. Есть центральные органы иммунной системы, такие как костный мозг, тимус, есть периферические органы. И по всему организму разбросаны скопления иммунных клеток. Порядка 1000 генов участвуют в кодировании признаков, отвечающих за иммунную систему. Это иммуногеном. При этом порядка 200 генов непосредственно вовлечены в эффекторные функции, а остальные 800 собирают эти молекулы в единое целое.
Врожденный иммунитет — это первая иммунная реакция, которая происходит при попадании патогена в организм. Как правило, это быстрая и неспецифическая реакция. Врожденный иммунитет имеет клеточный и гуморальный компоненты. Клеточный компонент представлен фагоцитами (клетки, которые способны опознать, захватить и «переварить» антиген), NK-клетками (принадлежат к лимфоидному ряду). Гуморальный компонент представлен системой комплемента.
У врожденного иммунитета, как и у приобретенного, есть рецепторный аппарат. Но механизмы врожденного иммунитета закодированы в генах, а генов не очень много. Поэтому природа пошла по пути создания рецепторного аппарата, который распознает консервативные участки патогена. Эффекторным механизмом в случае врожденного иммунитета является развитие воспалительного ответа — выработка цитокинов.
Приобретенный иммунитет реагирует гораздо медленнее врожденного. Реакция более медленная, потому что специфическая. Так же, как и в врожденном иммунитете, в приобретенном есть гуморальный и клеточный компоненты. Гуморальный компонент представлен антителами (иммуноглобулинами), рецепторный — T-клеточными рецепторами и B-клеточными рецепторами. Встреча с патогеном в случае возникновения реакции приводит к развитию иммунологической памяти.
Такая сложная система, как иммунитет, требует огромного количества энергии. Природа пошла по пути максимальной эффективности, когда создавала иммунную память: она позволяет при повторной встрече с патогеном не развивать всю реакцию с самого начала.
Гамбургеры и хот-доги антигенпрезентации
Для того, чтобы T-клетки распознали антиген, тот должен быть определенным образом подготовлен (нарезан). В нативном виде T-клетка распознать антиген не может. Его подготовку осуществляют антигенпрезентирующие клетки.
С эффекторной функцией врожденного иммунитета связаны цитотоксические T-лимфоциты и хелперные T-лимфоциты. Они могут распознать антиген, только если те представлены на поверхности антигенпрезентирующей клетки в комплексе с ее собственной молекулой. Распознавание происходит в два этапа: сначала T-клетка распознает свою молекулу и только затем она распознает антиген.
Презентирующие молекулы называются MHC (major histocompatibility complex) — белки главного комплекса гистосовместимости. Разным клеткам презентируют антиген разные молекулы. Цитотоксической клетке представляет антиген MHC первого класса, хелперной клетке — MHC второго класса.
Лектор предложил запомнить следующую информацию с помощью «теории гамбургера» и «теории хот-дога». Если посмотреть на молекулу MHC, которая презентирует антиген, сверху, то антиген расположен в пептид-связывающей бороздке молекулы MHC первого класса целиком, как котлета в гамбургере. К такой молекуле применяются строгие условия соответствия, она должна быть определенной длины и содержать определенные якорные аминокислоты. В случае MHC второго класса антиген расположен в пептид-связывающей бороздке только частью. Значительные части антигенного пептида «свешиваются» за ее пределы, как сосиска в хот-доге.
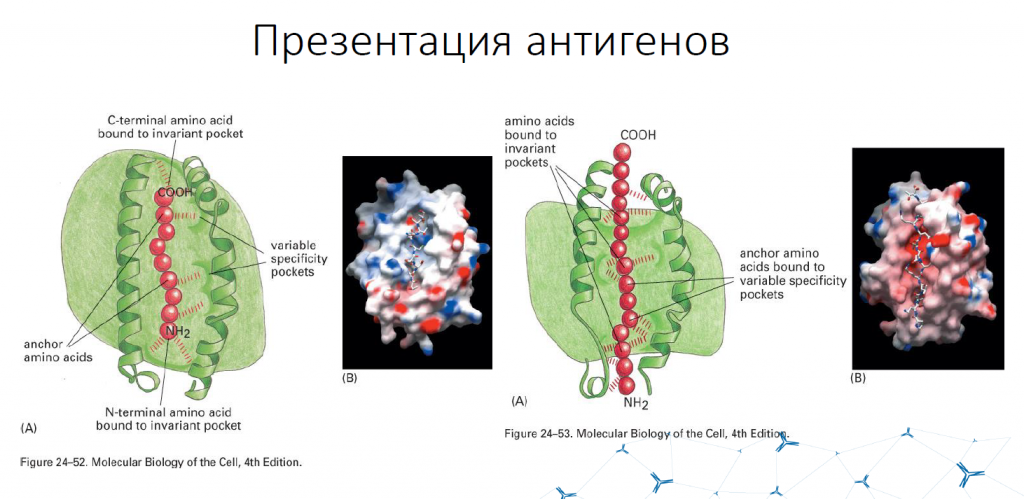
MHC первого класса презентируют все антигены, которые расположены внутри клетки. Если говорить об инфекционных агентах, то в основном это антигены вирусов. MHC второго класса принимают участие в презентации антигенов, которые приходят извне клетки, например, бактериальных токсинов. Но ведь извне могут поступать и собственные антигены — остатки разрушившихся клеток. В этом случае иммунная реакция не должна произойти. Поэтому функция распознавания частично делегируется следующему участнику развития иммунного ответа — T-хелперу (CD4+ T-клетке). T-хелпер помогает понять, нужно ли запускать иммунный ответ. Если все же нужно запустить иммунную реакцию, T-хелперы могут активировать два типа иммунного ответа — клеточный и гуморальный.
Активация T-клетки может происходить при взаимодействии с молекулой MHC второго класса (в ней участвует хелперная клетка) или при взаимодействии с молекулой MHC первого класса (здесь участвует цитотоксическая CD8+ T-клетка). Хелперная клетка может помогать цитотоксическому иммунному ответу: она вырабатывает цитокины, которые активируют цитотоксические клетки и направляют иммунный ответ по цитотоксическому пути.
CD4+ T-клетка, которая еще не встретилась ни с каким антигеном, называется «наивной» (Th0). Наивная клетка может превратится в Th1 (хелперную клетку 1), Th2, Th17 или регуляторную клетку (Treg). Каждая из этих клеток выполняет конкретную функцию. Th1 направляет иммунный ответ по клеточному пути, взаимодействуя с антигенными пептидами, которые находятся внутри клетки. Th2 направляет иммунный ответ по гуморальному пути и помогает бороться с внеклеточными патогенами. Th17 реагирует на внеклеточные бактерии и грибы. Treg помогают остановить иммунную реакцию.
Наиболее известная функция В-клеток — продукция антител, но B-клетка может выполнять функцию антигенпрезентирующей клетки, то есть захватывать антиген и презентовать его.
Антитела
Есть два пути активации B-клеток: T-независимый и T-зависимый.
При коронавирусной инфекции сначала делают тест на иммуноглобулины класса M. Их появление говорит об активации B-клетки по T-независимому пути — она приводит к формированию плазматических клеток, вырабатывающих иммуноглобулины класса M, обладающих широкой специфичностью к различным эпитопам антигена, и, как правило, не приводит к формированию иммунологической памяти. Эти плазматические клетки живут недолго.
С течением болезни, если хотят убедиться, что организм справляется с инфекцией, делают тест на иммуноглобулины класса G. Это очень специфичные иммуноглобулины. Они обладают нейтрализующей активностью, то есть препятствуют проникновению вируса в клетку. Выработка специфичных иммуноглобулинов требует T-клетки. Она должна распознать антиген, который будет презентировать B-клетка в контексте молекулы MHC второго класса. Это приведет к клональной экспансии и развитию долгоживущих плазматических клеток, производящих высокоспецифичные иммуноглобулины класса G, и к формированию иммунологической памяти. Клетки памяти могут жить очень долго. Например, клетки памяти к испанскому гриппу детектировались у переболевших практически всю жизнь.
Иммуноглобулины, или антитела — основные молекулы, выполняющие эффекторную функцию в В-клеточном иммунном ответе. Антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей. Помимо константных регионов тяжелых и легких цепей у них есть вариабельные регионы (и гипервариабельные фрагменты). Именно участками, сформированными из вариабельных регионов легких и тяжелых цепей, молекула антитела связывается с антигеном (паратоп с эпитопом).
У антител несколько эффекторных механизмов. Первый — это опсонизация. Для лучшего запоминания этого механизма лектор предложил представить жирную тефтельку. Если антиген — это жирная тефтелька, а мы пытаемся взять ее пальцами, она выскользнет. Точно так же фагоцитирующая клетка может захватить антиген, но делает это не слишком успешно. А вот если антиген провзаимодействовал с антителом, то процесс захвата происходит в десятки, сотни раз эффективнее, как будто мы нашу жирную тефтельку накололи на вилку. Это и есть опсонизация чужеродного агента.
Второй механизм — антителозависимая клеточная цитотоксичность. Если мишень слишком большая, чтобы клетка могла ее захватить, с антигеном на ее поверхности связывается антитело, с константным участком антитела взаимодействуют особые клетки (например, NK-клетки) и активируются. При активации включается цитотоксическая функция, клетка-мишень уничтожается.
Третий механизм — нейтрализация. Большинству вирусов, чтобы проникнуть внутрь клетки, нужно связаться с какой-то молекулой на ее поверхности (рецептором). Антитело может связаться с вирусом и воспрепятствовать взаимодействию вируса с рецептором.
Четвертый механизм — запуск системы комплемента. Это особо характерно для иммуноглобулинов класса M.
Нам необходимо огромное количество антигенраспознающих рецепторов на поверхности T- и B-клеток, чтобы они всегда были готовы провзаимодействовать с антигеном. Антигенов много, они очень вариабельны. Нужно каким-то образом в ограниченном пространстве генома обеспечить кодирование информации об огромном репертуаре этих антиген-распознающих молекул. Осуществляется это с помощью рекомбинации участков генов (V(D)J-рекомбинация).
Есть несколько механизмов, которые принимают роль в случайном комбинаторном формировании итоговой молекулы. Каждая из частей этих молекул закодирована несколькими сегментами генов. Случайный процесс комбинирования этих сегментов приводит к формированию уникальной молекулы. Вариантов B-клеточных рецепторов может быть 1012, вариантов T-клеточных рецепторов может быть 1017.
Коронавирус
Любому вирусологу интересно, какое звено иммунитета обеспечивает наилучшую защиту от вируса — клеточное или гуморальное. Такой вопрос возник и насчет коронавируса. Понимание глубоких механизмов иммунного ответа на вирусную инфекцию позволяет создать эффективные вакцины и терапевтические препараты.
Коронавирусная инфекция похожа на другие респираторные инфекции — за исключением одной особенности, которая связана с ненормальной активацией иммунной системы. Эта активация опосредована Th1 и Th17 — основными клетками, которые обеспечивают воспалительную реакцию. Th1 и Th17 вырабатывают цитокины и привлекают в легкие нейтрофилы (клетки врожденного иммунитета). Нейтрофилы вырабатывают еще больше цитокинов. Получается замкнутый круг: это цитокиновый шторм, который связан с отеком легких.
Чтобы выяснить, какой компонент является более значимым в борьбе с коронавирусом и защите от него — гуморальный или клеточный, в Институте иммунологии ФМБА России провели исследование, инициированное Департаментом здравоохранения Москвы. В нем приняли участие 5 тысяч человек. Их обследовали в течение 300 дней, оценивали способность их T-клеток отвечать на вирусный антиген, а также присутствие в их крови нейтрализующих вирус антител.
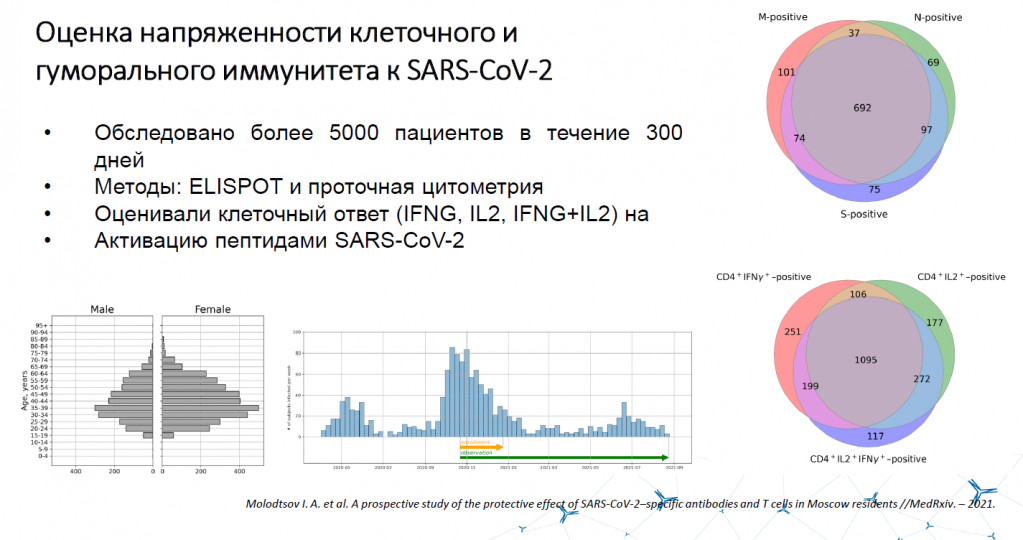
Люди делились на три большие категории: способные вырабатывать исключительно нейтрализующие антитела, способные вырабатывать исключительно T-клетки и способные вырабатывать и то, и то.
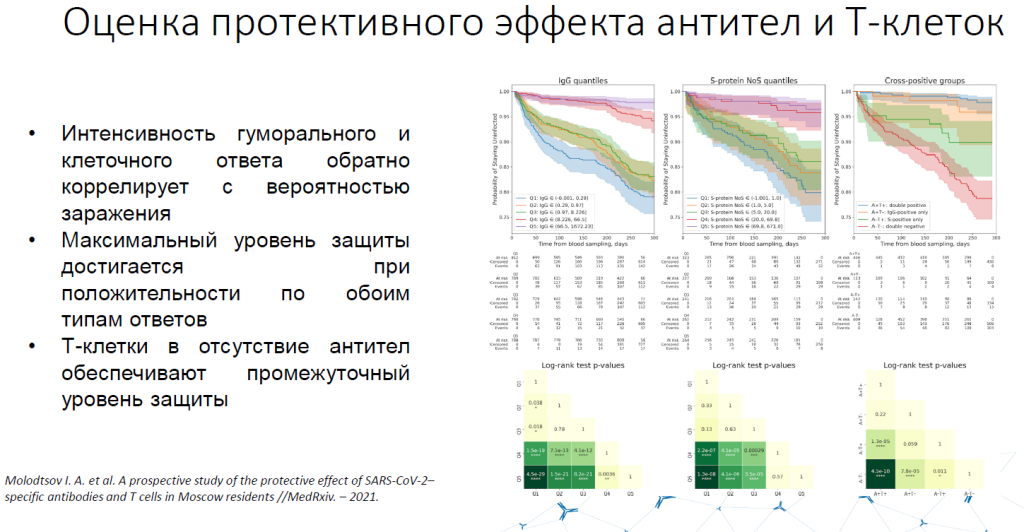
Защитная функция вируснейтрализующих иммуноглобулинов находилась в прямой зависимости от концентрации этих иммуноглобулинов. У людей с T-клетками ситуация другая. Связь с количеством T-клеток не так сильно видна, люди с малым и большим количеством вирус-специфических T-клеток защищены примерно одинаково. Однако сила защиты существенно меньше, чем в случае антителами. Наилучшей защитой обладают те, у кого были и T-клетки, и иммуноглобулины.
В исследование вошли и пациенты Института иммунологии с дефицитом иммунной функции, в том числе с первичными (наследуемыми) иммунодефицитами. Люди с T-клеточными иммунодефицитами, как правило, долго не живут. Поэтому в основном первичные иммунодефициты представлены B-клеточными иммунодефицитами. Исследователи посмотрели, как эти люди справляются с инфекцией без антител.
Оказалось, что в общей популяции иммунный ответ связан с выработкой CD4+ Т-лимфоциов. У людей с иммунодефицитами иммунная защита обеспечивается цитотоксическими CD8+ Т-лимфоцитами. Цитотоксические реакции проявляются лихорадкой и избыточным воспалением.
Казалось бы, организму людей с иммунодефицитами следуют всю энергию, обычно затрачиваемую на выработку антител, направить на расширение репертуара T-клеток. Но природа пошла по другому пути — по пути отбора тех клонов T-клеток, которые обладают T-клеточными рецепторами с широкой специфичностью. Иначе говоря, у таких людей мало клонов Т-клеток, но их рецепторы способны взаимодействовать с разными антигенами. Это может привести к распознаванию собственных антигенов. И действительно, частым осложнением таких заболеваний являются аутоиммунные патологии.
У здоровых людей клонов, обладающих специфичностью к коронавирусу, очень много. Частично они перекрываются. Но если взять двух людей с иммунодефицитами, то можно увидеть, что количество клонов, обеспечивающих защиту, значительно меньше, и это одни и те же клоны. В норме процесс выбора генов при формировании T- и B-клеточных рецепторов случайный. У людей с иммунодефицитом выбор генов не случайный, и неясно, чем он регулируется.
Во время пандемии возник вопрос, почему люди с иммунодефицитами, находящиеся в больнице, при соблюдении всех мер предосторожности раз в месяц подхватывают коронавирус. Ученые предположили, что причина повторяющейся инфекции — не новый вирус, а один и тот же вирус, сохраняющийся в организме. Иммунный ответ у таких людей опосредован CD8+ клетками, которые дают тяжелую цитотоксическую реакцию. Долго эта реакция поддерживаться не может, включаются компенсаторные механизмы.
Из образцов пациентов выделили коронавирус, секвенировали его геном и сравнили его с базой данных, построив филогенетическое дерево. Оказалось, что ближайший родственник этого коронавируса персистировал в российской популяции девять месяцев назад, когда они заразились в первый раз. По сравнению с ближайшим родственником у вируса, полученного от пациента, выявили 22 новые мутации, которые расположены не случайно, а в местах, которые презентируются цитотоксическим CD8+ лимфоцитам. В организме человека с иммунодефицитом у вируса нет «задачи» быстро реплицироваться и передаться новому хозяину. Нет гуморального звена иммунитета, и вирус не элиминируется из организма, а обитает в нем долгое время и получает возможность эволюционировать.
Трансплантация
Подавляющее большинство трансплантаций является аллогенными, то есть орган берут у другого человека, генетически не идентичного. При трансплантации донорского органа в организме человека появляется чужеродная ткань. Иммунные клетки начинают ее атаковать, что приводит к отторжению.
В другом случае может развиться реакция «трансплантат против хозяина». При некоторых заболеваниях человеку пересаживается костный мозг от здорового человека. Костный мозг — это активные иммунные клетки, а организм хозяина ослаблен и подготовлен так, чтобы он сразу не отторг донорский орган. В этих условиях иммунные клетки могут начать атаковать собственные клетки реципиента.
Молекулы MHC могут быть экспрессированы на донорской клетке. Если донорский орган плохо подготовлен, и в нем остались донорские антигенпрезентирующие клетки, эти клетки в контексте своей собственной молекулы MHC первого или второго класса презентируют T-клеткам реципиента донорские же антигены. Это прямой путь отторжения донорского органа, самый быстрый.
Во втором пути донорские клетки участвуют опосредованно. Донорские антигены захватываются антигенпрезентирующими клетками реципиента. Тут работают молекулы MHC второго класса, так как антигены внешние по отношению к клетке. Следовательно, будет запускаться гуморальный иммунный ответ, более долгий. Это более поздняя реакция отторжения.
Недавно был открыт третий путь — трогоцитоз. К нему способны, по всей видимости, разные клетки, но особенно — нейтрофилы. Трогоцитоз — необычный способ контакта двух клеток, когда антигенпрезентирующая клетка «откусывает» кусочек мембраны другой клетки вместе с представленными на ней молекулами, но не разрезает их, а в неизменном виде презентирует на собственной мембране. Можно сказать, что это полупрямой путь.
Святой Грааль для трансплантологов — возможность выработать толерантность к донорскому органу. Для оценки отторжения аллотрансплантата традиционно используется биопсия, но все чаще применяются также молекулярно-биологические методы. Определяется донорская внеклеточная ДНК при трансплантации органов и мониторинга химеризма после трансплантации гемопоэтических стволовых клеток.
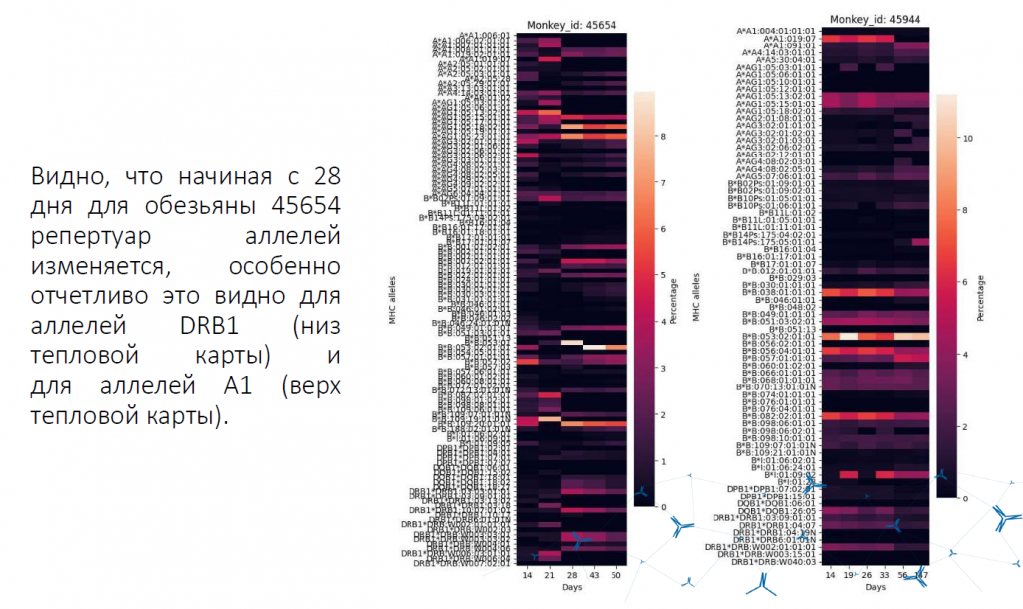
По этой тематике в Институте иммунологии ФМБА России проводится исследование на обезьянах. Коммерчески доступных наборов для определения молекул MHC обезьян не существует. Авторы работы попытались использовать человеческую систему. Молекулы первого класса достаточно сильно отличаются, молекулы второго класса более похожи на человеческие.
Организм обезьяны проанализировали на предмет возникновения клеток с донорским фенотипом. Очень четко видно, когда они появляются, сначала их немного. Максимального количества они достигают на 28–43 день, затем количество снижается. Таким образом можно подбирать условия назначения иммуносупрессивных препаратов и отслеживать этапы формирования толерантности (понимать, насколько хорошо подобрали терапию).
Онкопатологии
Иммунные клетки могут как способствовать, так и препятствовать развитию рака.
В соответствии с современной теорией иммунологического надзора, опухолевые клетки появляются на протяжении всей жизни. Но у молодого организма выше эффективность механизма удаления этих клеток. Удаление опухолевых клеток осуществляется в первую очередь иммунными клетками.
Взаимодействие опухоли и иммунной системы описывает теория «Трех E»: Elimination, когда эффективно работают иммунные механизмы, которые позволяют уничтожить любую опухолевую клетку; Equilibrium, когда иммунные механизмы в состоянии поддерживать некоторое равновесие, но эффективного удаления уже не происходит; Escape, когда опухолевая клетка научается уходить от действия иммунитета, развивается рак.
Прогноз развития опухоли можно делать, посмотрев на популяционный состав иммунных клеток, которые в эту опухоль инфильтрируют, и оценив, какие популяции превалируют. Самой «плохой» для прогноза является популяция Т-регуляторных клеток (Treg). Она подавляет развитие иммунной реакции. Самая «хорошая» клетка — цитотоксическая. Они выделяют гранзимы и перфорины, которые разрушают опухолевые клетки. Хелперы 1 связаны с противоопухолевой активностью, они вырабатывают интерферон гамма и направляют иммунный ответ по клеточному пути. Хелперы 2, 17, фоликулярные хелперы обладают как протуморогенными эффектами, так и противотуморогенными.
Посмотрев на состав иммунных клеток, можно узнать прогноз и посмотреть, меняется и что-нибудь при назначении терапии.
Среди B-клеток самая «плохая» — B-регуляторная клетка. Она вырабатывает в том числе TGF и интерлейкин 10 и останавливает иммунную реакцию. Вырабатывающие антитела клетки могут быть как «хорошими», так и «плохими». Антитела могут взаимодействовать с антигенами, облегчая фагоцитоз опухолевых клеток (за счет опсонизации). «Плохой» эффект связан с хроническим воспалением. На фоне хронического воспаления опухоль привлекает факторы роста и ангиогенеза. В этом процессе участвуют так называемые циркулирующие иммунокомплексы, «клубки» антител, которые оседают на тканях и провоцируют развитие хронического воспаления. Презентация антигенов через MHC второго класса способствует росту опухолевых клеток (вырабатывается интерлейкин 10).
Можно определить маркеры хорошего и плохого прогноза в соответствии с выработкой антител. В общем случае IgG — маркер хорошего прогноза, IgA и IgE — маркеры плохого прогноза.
РНК-секвенирование иммуноглобулинов при меланоме позволяет оценить уровень экспрессии тяжелых цепей иммуноглобулинов и клональность (поли- или моноклональный ответ). В целом, экспрессия иммуноглобулинов — маркер хорошего прогноза, большая клональность — тоже, еще лучше, когда они встречаются вместе. Но если иммуноглобулины разделить на группы, то лучше прогноз у тех, у кого много IgG и мало IgA.
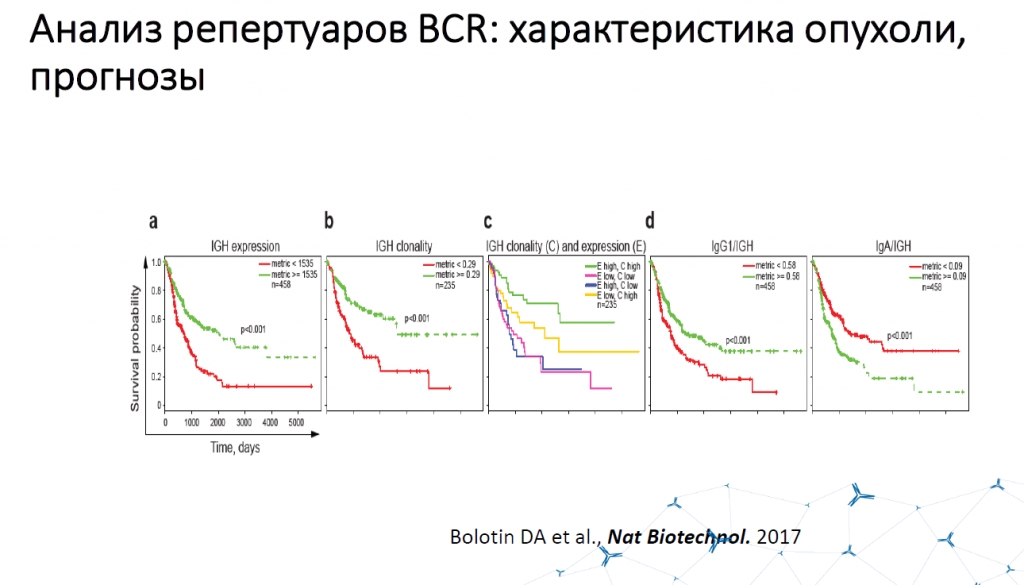 Различия в кривых выживаемости в зависимости от профиля экспрессии иммуноглобулинов
Различия в кривых выживаемости в зависимости от профиля экспрессии иммуноглобулинов
Терапия
Одним из самых эффективных способов терапии в настоящее время считаются моноклональные антитела.
Возможно несколько механизмов их действия. Например, это уменьшение количества провоспалительных цитокинов путем выработки антител, взаимодействующих с самими цитокинами или с рецепторами к этим цитокинам. Это блокировка иммунного ответа за счет «забивания» антителами T-клеточных рецепторов или активации цитотоксических механизмов. И это повышение числа регуляторных клеток.
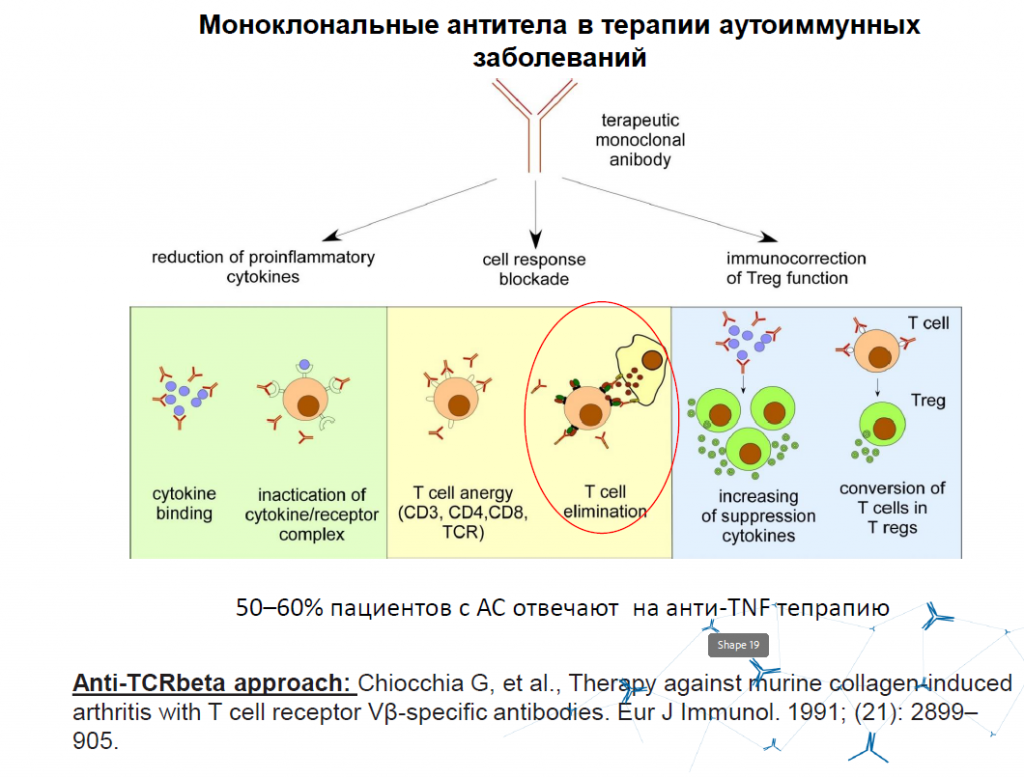
Используя эти механизмы, российские ученые разработали препарат для борьбы с анкилозирующим спондилитом. Это тяжелое аутоиммунное заболевание, которое связано с презентацией молекулами MHC особых антигенов, провоцирующей развитие артрита. В терминальной стадии происходит сращение костей позвоночника. Ученые вычленили те T-клетки, которые связаны с презентацией этих антигенов, и нашли способ их уничтожить.
Моноклональные антитела также позволяют бороться с опухолями, например при терапии чекпоинт-ингибиторами (ингибиторами контрольных точек иммунного ответа). На протяжении многих лет их используют при лечении рака.
На поверхности клеток есть молекулы, которые останавливают иммунный ответ. Опухолевая клетка начинает экспрессировать эти молекулы и не дает T-клеткам осуществлять свою функцию.
Как работают чекпоинт-ингибиторы? При иммунной реакции T-клеточный рецептор взаимодействует с молекулой MHC, несущей антиген, на антигенпрезентирующей клетке. В норме, если клетка таким образом демонстрирует фрагмент измененного опухолевого белка, она должна быть уничтожена. Но для этого должен пройти второй сигнал, который опосредован молекулой CD28, расположенной на T-клетке, и CD80/86 на антигенпрезентирующей клетке. Только в том случае, если эти молекулы провзаимодействовали, идет активация и запускается иммунная реакция.
Treg экспрессирует на поверхности молекулу CTLA-4, которая конкурирует с CD28 за CD80/86, не давая T-клетке активироваться. Происходит остановка иммунного ответа. Опухоль умеет делать так же. Но это можно остановить, заблокировав этот рецептор специфическим антителом. Это один из примеров ингибирования контрольной точки.
Белок программируемой клеточной смерти PD-1 экспрессируется на поверхности клеток, которые уже выполнили свою функцию. PD-1 связывается с лигандом на поверхности антигенпрезентирующей клетки, таким образом обеспечивается торможение иммунного ответа. Можно сделать антитело, специфичное либо к PD-1, либо к лиганду PD-L1, и это тоже «снимет тормоза» с иммунного ответа и возобновит его, если он когда-то уже был.
Генотерапия
В конце лектор подробнее остановился на методе РНК-интерференции. Он работает по механизму комплементарности. Антисмысловая цепь РНК связывается с той молекулой мРНК, которую нужно подавить. Для использования этого способа на практике нужно решить ряд проблем, таких как нецелевые эффекты, нестабильность РНК и связывание двухцепочечных РНК (структура, типичная для вирусов) с рецепторами врожденного иммунитета, что активирует иммунный ответ. И нужно еще доставить РНК внутрь клетки.
Институт иммунологии ФМБА России разработал препарат МИР-19 против коронавируса, в состав которого входит интерферирующая РНК. В его основе лежит уже существующая в институте технология получения дендримерных пептидов, которые использовали для исследования препаратов против бронхиальной астмы. Препарат прошел все этапы клинических испытаний и показал довольно высокую эффективность. Выздоровление происходило в среднем на два дня раньше при сравнении со стандартной терапией.
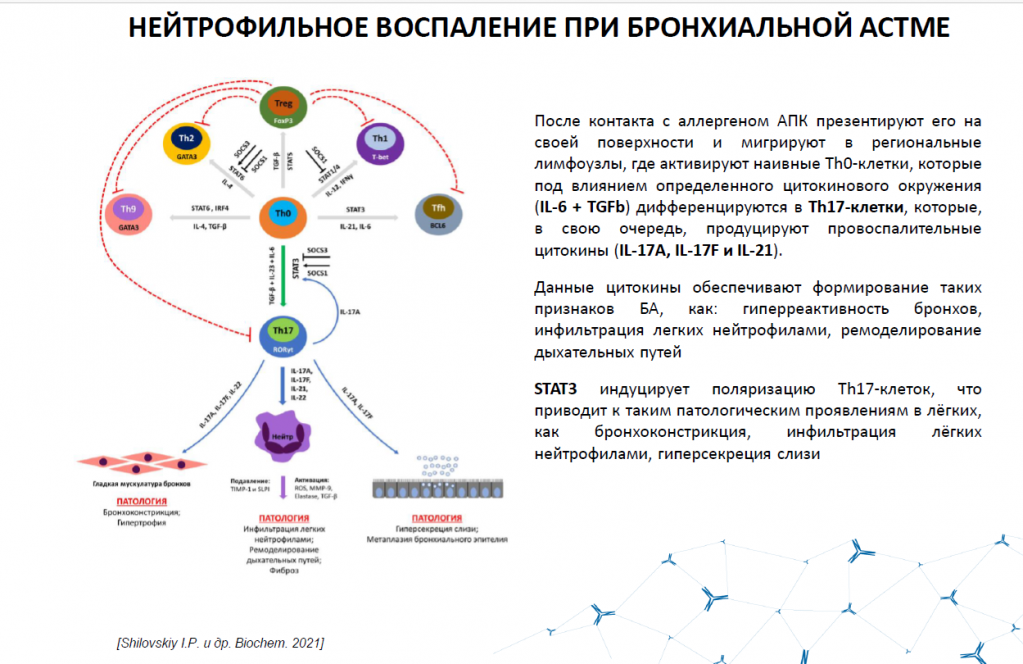
Что касается препарата против бронхиальной астмы на основе РНК-интерференции, он имеет прямое отношение к теме лекции — модулирует иммунный ответ. При бронхиальной астме после контакта с аллергеном антигенпрезентирующая клетка несет его в региональные лимфоузлы и там презентирует его наивным клеткам. При наличии в легких повышенной экспрессии интерлейкина 6 или TGFb, Th0 дифференцируются в Th17, которые продуцируют провоспалительные цитокины. Это приводит к формированию гиперреактивности, инфильтрации и ремоделирования дыхательных путей — ситуация, напоминающая цитокиновый шторм при коронавирусе. Клетки Th0 заставляет трансформироваться в Th17 фактор STAT3. У нас есть дендримерный пептид, отметил лектор, осталось сделать малую интерферирующую РНК, которая в комплексе с этим пептидом будет ингибировать дифференциацию Th0 в Th17. Это было сделано, и на мышиной модели бронхиальной астмы показали эффективность подхода.
Другие лекции «Метафазы»
Мария Марсова: «Каждый из нас — это огромная вселенная»
Полина Вишнякова: «Моноцит — аксолотль в мире клеток»
Павел Макаревич: регенерация — свойство организма, а не культуры клеток
Эволюция регенерации на «Метафазе»
«Метафаза» рассказала об индуцированных плюрипотентных стволовых клетках
В «Зарядье» состоялась первая лекция просветительского проекта «Метафаза»


 Меню
Меню





 Все темы
Все темы



 0
0







