Ольга Британова: как найти «плохие» Т-клетки среди «хороших»
Представляем заключительную лекцию в «иммунологическом» блоке проекта «Метафаза». Ольга Владимировна Британова (Институт биоорганической химии РАН) рассказала о том, как был пройден путь от лабораторного исследования до оригинального российского лекарства против болезни Бехтерева. Среди «белых кровяных клеток» определенного типа, век назад неразличимых для ученых и медиков, теперь можно обнаружить патогенный клон и устранить его.
Эту лекцию, как и предыдущие лекции блока, нужно было начать с краткого экскурса в иммунологию. Чтобы всем слушателям было понятно, откуда берутся патогенные клетки иммунной системы и как их можно уничтожить, необходимо напомнить, как устроен врожденный и приобретенный иммунитет.
Т-лимфоциты и их роль в иммунной системе
Мы живем в окружении патогенов, и от их постоянных атак нас защищает иммунная система. Первая линия защиты — клетки врожденного иммунитета, в том числе дендритные клетки, макрофаги, нейтрофилы, эозинофилы, базофилы, NK-клетки. Врожденный иммунитет обеспечивает быстрый неспецифический ответ, при этом клетки не сохраняют память о контакте с определенным антигеном (хотя некоторые NK-клетки, согласно последним данным, могут обладать способностью к запоминанию антигенов, и когда-нибудь мы узнаем, какие механизмы за этим стоят, отметила Ольга Британова).
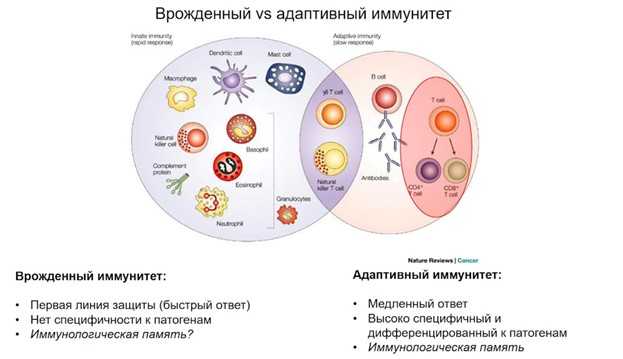
Вторая линия защиты — адаптивная иммунная система. В-клетки дают начало плазматическим В-клеткам — фабрикам антител. Клеточный адаптивный иммунитет — это прежде всего CD4+ T-клетки и CD8+T-клетки. Сейчас принято называть эти клетки по маркерным поверхностным белкам; первые из них также называют Т-хелперами, вторые Т-киллерами, или цитотоксические Т-клетки (хотя тут есть тонкости; как мы увидим далее, не все CD4+ T-клетки хелперные).
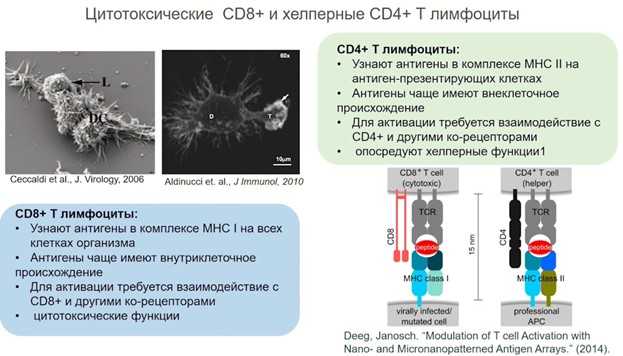
У Т-клеток есть рецепторы, узнающие антигены (Т-клеточные рецепторы, ТКР). В отличие от аналогичных рецепторов В-клеток, они способны узнавать их только в комплексе с рецепторами MHC I и MHC II (у человека рецепторы этого типа называются HLA). MHC I присутствуют на поверхности всех клеток, имеющих ядро. С их помощью клетки организма предъявляют CD8+T-клеткам свой «паспорт» — фрагменты белков, которые синтезируются в клетке. Если среди этих белков окажутся вирусные или измененные мутациями белки, Т-киллеры уничтожат презентирующие их клетки. Для этого они секретируют белки-перфорины, которые встраиваются в мембрану и образуют пору, а затем туда закачиваются гранзимы, вызывающие апоптоз. Т-клеточный иммунитет – важная составляющая системы защиты организма не только от вирусной или бактериальной инфекции, но и от собственных клеток, в которых произошли мутации.
Рецепторы MHC II присутствуют на «профессиональных» антигенпрезентирующих клетках (АПК), таких как макрофаги, В-лимфоциты, дендритные клетки и некоторые другие. Связанные с MHC II антигены представляются хелперным CD4+ T-клеткам (об их функциях далее будет рассказано детально). Как происходит взаимодействие дендритной клетки (DC) и Т-лимфоцита (L), можно видеть на микрофотографиях.
Гены, кодирующие MHC I и MHC II, представлены примерно 13 тысячами различных аллелей; все присутствующие в зале, скорее всего, имеют разные комбинации МНС, заметила Ольга Британова. Иначе говоря, для этих белков характерно огромное индивидуальное разнообразие, которое влияет не только на иммуносовместимость наших органов и тканей, но и на особенности индивидуального иммунного ответа.
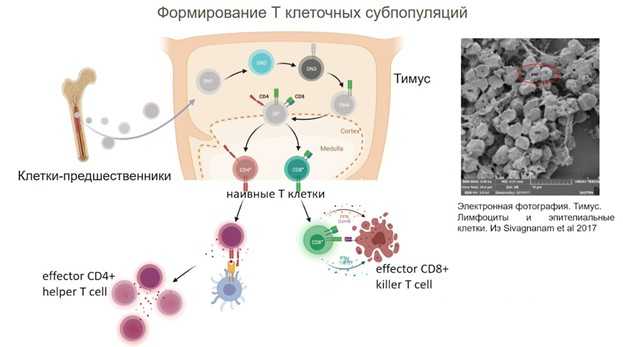
Незрелые Т-лимфоциты мигрируют из костного мозга в тимус, где в каждой клетке происходит сборка Т-клеточного рецептора, а также решается вопрос, в каком контексте данная клетка будет распознавать антиген — станет ли она CD4+ или CD8+T-клеткой. Каждая Т-клетка формирует уникальный антиген-распознающий рецептор. В результате из тимуса выходят наивные Т-лимфоциты — те, которые еще не взаимодействовали с антигеном.
 © Kasatskaya
© Kasatskaya
Важная часть созревания Т-лимфоцитов — уничтожение тех из них, которые имеют нефункциональные рецепторы и не могут связывать никакие антигены или связывают собственные нормальные антигены организма; 95% клеток в тимусе гибнет. Если же аутореактивные Т-лимфоциты останутся, это может привести к атаке иммунной системы на собственные такни и развитию аутоиммунных патологий.
Тимус — фабрика лимфоцитов, и с возрастом эта фабрика замедляет работу. Примерно к 30 годам тимус человека перестает производить новые наивные Т-клетки, и оставшуюся часть жизни мы обходимся приобретенным ранее запасом, который поддерживается за счет деления Т-клеток на периферии. В пожилом возрасте разнообразие Т-клеток иммунной системы снижается. а подверженность, вирусным заболеваниям растет.
Ольга Британова рассказала об изящном эксперименте, который был выполнен в середине 1980-х, «когда никакой техники не существовало» — не было массированного секвенирования, и любое секвенирование было намного более дорогим удовольствием, чем сейчас. Чтобы доказать, что аутореактивные клетки погибают в ходе развития организма, исследователи создали трансгенную мышь, все Т-клетки которой имели ТКР, узнающий определенный антиген на клетках самцов. У самок этой линии формировались нормальные Т-клетки, но у самцов практически исчезли CD4+ T и CD8+T-клетки — 90% клеток были CD4 и CD8 негативными, сохранились лишь Т-клетки с низкой экспрессией CD8+. При этом их предшественники в тимусе детектировались, но погибали.
Репертуар ТКР
Затем Ольга Британова напомнила, как происходит сборка гена TCR в ходе созревания Т-лимфоцита. TCR представляет собой гетеродимер из альфа- и бета цепей. Механизм сборки сходен с тем, что формирует гены иммуноглобулинов (антител). Помимо рекомбинации сегментов, создающих уникальную последовательность гена, существует фермент (terminal deoxynucleotidyl transferase (TdT)), который «откусывает» или добавляет нуклеотиды на стыке генных сегментов бета-цепи. В итоге формируется огромное множество разнообразных последовательностей; число вариантов оценивается в разных публикациях как 1019 или даже 1061; после элиминации, согласно современным представлениям, остается 109. 1000 000 000 — столько вариантов ТКР изначально есть у каждого человека.
Совокупность всех вариантов антиген-узнающих рецепторов Т-клеток индивида называется красивым термином «репертуар». При всем разнообразии Т-клеточных рецепторов у разных людей встречается некоторое количество идентичных последовательностей ТКР; это так называемые публичные клонотипы, которые формируются чаще всего.
Вероятность сборки того или иного ТКР может быть предсказана математическим моделированием, с учетом механизмов рекомбинации. Отсюда появляется возможность оценить, какой именно ТКР может быть вовлечен в иммунный ответ; на это может указывать повышенная частота встречаемости того или иного ТКР.
Лектор с коллегами изучили репертуары ТКР сотни людей, от младенцев до столетних долгожителей, и показали, как репертуары изменяются в течение жизни, многие клоны сохраняются годами, а некоторые — от рождения до старости. Как уже говорилось, доля наивных Т-клеток с возрастом у человека снижается, уменьшается и разнообразие ТКР. Если у новорожденных и детей есть обширное общее «ядро», то у взрослых людей накапливаются индивидуальные изменения, то есть репертуары взрослых людей менее сходны между собой, чем у детей. Индивидуальная история инфекционных болезней формирует индивидуальные репертуары.
Современные методы позволяют секвенировать последовательности генов ТКР для популяций и отдельных Т-клеток. Если мы видим, что одна последовательность представлена большим числом копий, это означает, что клон Т-лимфоцитов, несущих данный рецептор, размножился. Произошел контакт с антигеном, сформировалась иммунная память — множество клеток, готовых реагировать на данный антиген. Таким способом информация передается многочисленным потомкам клетки и сохраняется десятилетиями. Но и отдельные клетки могут быть долгоживущими.
Ольга Британова рассказала о красивой работе, выполненной в лаборатории Донны Фарбер в Колумбийском университете (Нью-Йорк): исследование Т-лимфоцитов в донорских органах примерно 60 человек разного возраста. В юном возрасте в крови наибольшее количество наивных клеток, они заходят в лимфоузлы, где могут встречаться с дендритными клетками, после чего наивная клетка становится эффекторной и перемещается туда, где требуется ее активность. Больше всего эффекторных клеток в барьерных органах, таких как легкие, кишечник, кожа (см. рис. 3 в обзоре Фарбер с коллегами).
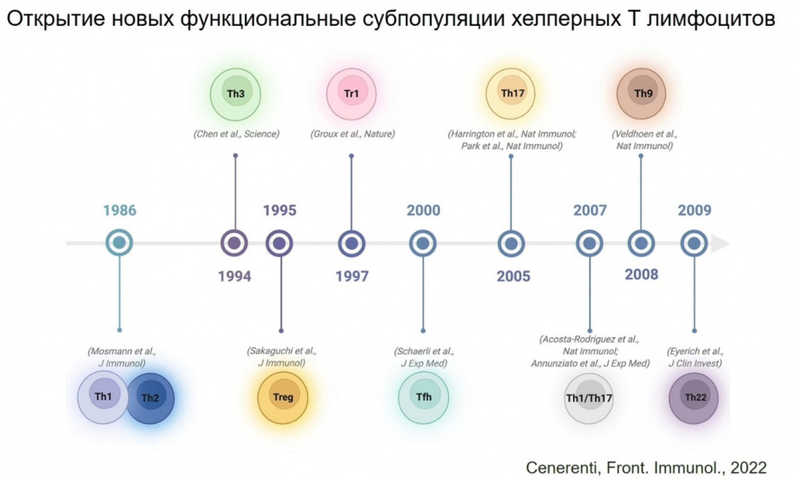
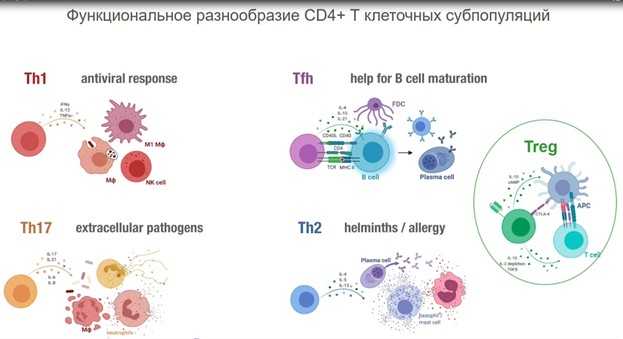
CD4+ Т-клетки функционально различны, среди них выделяют множество субпопуляций (и в последнее время благодаря новым возможностям исследования единичных клеток мы начинаем понимать, что это деление в каких-то случаях может быть и условным). Наивные Th0 клетки получают информацию от цитокинов о том, что происходит в организме, и поляризуются — приобретают специализацию. Th1-клетки отвечают за антивирусный и антибактериальный ответ, Th2 — за аллергические реакции и ответ при гельминтозах. Tfh помогают созревать В-клеткам. Th17 (названные так потому, что они вырабатывают интерлейкин 17) борются с внеклеточными патогенами, возможно, они также вовлечены в патогенез псориаза и ревматоидного артрита. Регуляторные Т-клетки Treg блокируют избыточное воспаление, модулируют иммунный ответ; интересно, что они могут происходить от аутореактивных Т-клеток, которые не погибли. Наконец, существуют цитотоксические CD4+ Т-клетки, которые, подобно CD8+ Т-лимфоцитам, уничтожают другие клетки (например, состарившиеся фибробласты).
На то, какой функционал приобретет Т-клетка, могут влиять и другие факторы — в частности, ТКР и его аффинность к антигену.
 © Kasatskaya
© Kasatskaya
У мышей, с нарушенной функцией гена IL-10, который продуцируется в том числе Treg и снижает воспаление, в кишечнике, где всегда много эффекторных клеток Th1 и много бактерий, развивается тяжелое воспаление. Иммунная система «сходит с ума» — дендритные клетки захватывают бактерии, Th1 идут в атаку. С другой стороны, бактерии клостридии заставляют регуляторные Т-клетки продуцировать IL-10 и благодаря этому избегают воспалительной реакции.
Как достичь баланса между субпопуляциями Т-клеток с разными функциями и что считать оптимумом — сложный вопрос. Нарушается этот баланс в самых разных ситуациях. Лектор напомнила о «цитокиновом шторме» при COVID-19: его пытаются контролировать с помощью антител против цитокинов, но это не устраняет причину, то есть не корректирует состав Т-клеток. Уничтожить патогенные клоны клеток иммунной системы, не затрагивая остальные, — подход, который может революционизировать лечение аутоиммунных заболеваний, а возможно, и других аномалий иммунного ответа (различные аллергии).
От фундаментальной науки к практике
Среди возможных медицинских применений анализа репертуара ТКР— оценка эффективности вакцин, идентификация биомаркеров болезней, диагностика и лечение аутоиммунных заболеваний, разработка персонализированных терапевтических подходов. В частности, наблюдение за динамикой репертуара может давать информацию о развитии болезни и успехе лечения.
Получение библиотеки ТКР для секвенирования включает в себя подготовку образцов в чистом помещении (чтобы образцы пациента не были контаминированы). Для анализа репертуаров ТКР необходимо специальное ПО и достаточные компьютерные мощности, так как это могут быть большие массивы данных. Сейчас существуют базы данных, в которые включены ТКР с известной специфичностью; из них можно узнать, находил ли ранее кто-то у других пациентов такую же последовательность. Один из способов подтверждение специфичности – это использование меченных комплексов антиген-MHC тетрамеров: Т-клетки инкубируются с мечеными тетрамеры МНС в комплексе с известным антигеном. Т-клетки, к которым прилипли комплексы антиген-MHC, собирают в отдельную пробирку с помощью клеточного сортера и далее последовательности таких ТКР можно расшифровать секвенированием.

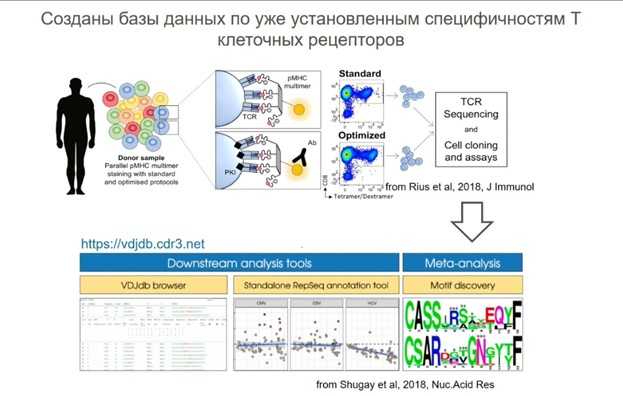
Более того, уже существуют методы, основанные на машинном обучении, которые позволяют предсказать по аминокислотной последовательности трехмерную структуру Т-клеточного рецептора. Использование среды для моделирования DeepAIRс помощью нейросети Alphafold2 позволяет построить 3D-структуру ТКР для прогнозирования его взаимодействия с комплексом антиген-MHC. В 2023 году вышла статья по предсказанию взаимодействий рецепторов с антигенами на основе силы контактов аминокислот. Статью российских ученых, принятую к публикации в Nature Computational Science, пока можно прочитать в виде препринта.
Несмотря на эти последние достижения, создание обобщающей модели для предсказания специфичности ТКР к определенным антигенам в контексте различных MHC-белков остается далеко идущей целью. В идеале, в будущем может быть такой подход: у пациента находят избыточно представленный клон Т-клеток, получают структуру его рецептора и узнают, какой именно антиген мог спровоцировать пролиферацию клона.
К заболеваниям, вызванным «плохими» Т-клетками, относится и диабет 1 типа: возможно, когда-нибудь удастся помочь и таким пациентам. Появляются биоинформатические подходы, которые позволяют установить, какие популяции Т-клеток вовлечены в аутоиммунную реакцию.
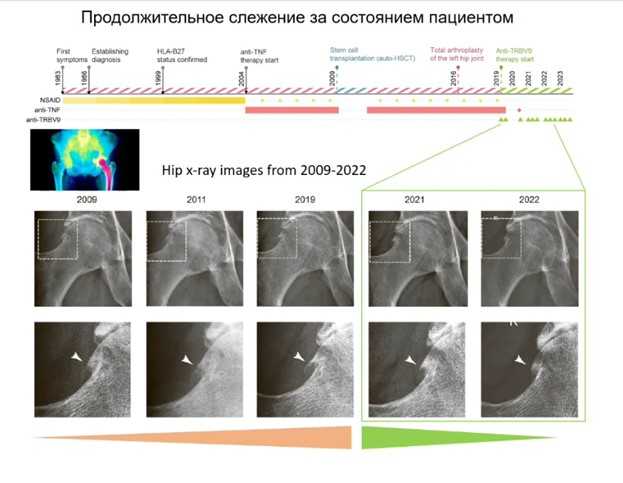
Наконец, лектор рассказала о том, как были найдены характерные особенности патогенных Т-клеток при болезни Бехтерева, которые позволили создать моноклональное антитело против этих клеток. Этот результат был представлен в широко известной публикации 2023 года, где Ольга Британова — первый автор (подробнее на PCR.NEWS). В статье описан случай длительной ремиссии у пациента в результате применения полученного антитела.
Болезнь Бехтерева (ББ) в различных популяциях встречается с частотой 0,1–1,3%, сопровождается воспалением, утратой подвижности суставов и позвоночника, может приводить к глубокой инвалидизации. Около полувека назад британские ученые обнаружили аллель МНС I, которая часто встречается у пациентов с ББ, — HLA-B27. Около 80% заболевших имеют этот аллель (это не значит, что все, у кого он есть, непременно заболеют; частота встречаемости болезни Бехтерева среди носителей HLA-B27 — около 5%). Поскольку в патогенез вовлечен рецептор МНС I, это значит, что «виноваты» CD8+Т-клетки.
Был выдвинут ряд гипотез, объясняющих, почему в организме больного возникает патогенный клон (серым цветом на слайде — те, что не подтвердились). Сейчас считается общепризнанным, что его размножение провоцирует антиген микроорганизма, а затем Т-клетки ошибочно узнают похожий на него собственный антиген.
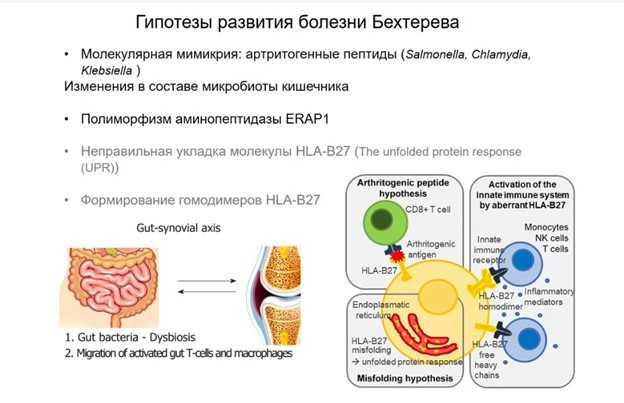
Сравнение Т-клеточных репертуаров пациентов с болезнью Бехтерева и здоровых людей выявило семейство Т-клеток, в состав которого входят аутореактивные клоны (подробнее на PCR.NEWS). У таких клеток в бета-цепи Т-клеточных рецепторов присутствовал характерный мотив в гипервариабельном участке и TRBV9. Таким образом, 50 лет спустя был установлен второй участник патогенного процесса.
Исследователи получили гуманизированное антитело против этого вариабельного сегмента ТКР. Антитела с цитотоксическими свойствами «облепляют» аутореактивные Т-клетки, и они погибают. Логично было предположить, что человек после этого начнет выздоравливать, и это предположение подтвердилось.
Прежде чем начинать клинические исследования, необходимо было убедиться, что антитело достаточно безопасно и не убивает (или убивает только в небольшом количестве) «хорошие» Т-клетки. На этом этапе исследователям повезло: оказалось, что антитело распознает соответствующий ТКР у макак, и это позволило провести доклинические исследования. С животными не происходило ничего плохого, а клоны-мишени из их крови исчезали.
Затем перешли к испытаниям на добровольце с историей болезни около 30 лет (подробности можно прочитать в статье). После нескольких инъекций моноклонального антитела у пациента улучшились показатели гибкости суставов и даже исчез остеофит в тазобедренном суставе, что подтверждено рентгенологически. В целом, качество жизни пациента повысилось.
В настоящее время Минздрав РФ уже зарегистрировал оригинальный отечественный таргетный препарат для лечения болезни Бехтерева. Препарату присвоили международное непатентованное наименование сенипрутуг; торговое наименование — Трибувиа.
Теперь пациенты с болезнью Бехтерева получат таргетный препарат, который позволит им вылечиться. «Нам пишут из-за границы, из разных стран, просят привезти им препарат, — рассказала Ольга Британова. — Надеемся, что он когда-нибудь будет доступен не только в России, но и в других странах».
Другие лекции «Метафазы»
Илья Кофиади и молекулярная кухня иммунных реакций
Мария Марсова: «Каждый из нас — это огромная вселенная»
Полина Вишнякова: «Моноцит — аксолотль в мире клеток»
Павел Макаревич: регенерация — свойство организма, а не культуры клеток
Эволюция регенерации на «Метафазе»
«Метафаза» рассказала об индуцированных плюрипотентных стволовых клетках
В «Зарядье» состоялась первая лекция просветительского проекта «Метафаза»


 Меню
Меню





 Все темы
Все темы



 0
0







