Петр Каменский: «Нужно ли смотреть на рибосомы митохондрий в микроскоп?»
Рибосомы впервые заметили в микроскоп именно в митохондриях и только потом обнаружили в цитоплазме эукариотической клетки и у бактерий. Но хотя митохондрии произошли от бактерий, их рибосомы не слишком похожи между собой. Какими методами сейчас изучают рибосомы и в каких случаях даже такой прекрасный метод структурного анализа, как криоэлектронная микроскопия, может ввести в заблуждение — рассказывает д.б.н. Петр Каменский.

Очередная лекция научно-просветительского проекта «Метафаза» PCR.NEWS и парка Зарядье прошла 27 марта. Петр Андреевич Каменский, доктор биологических наук, профессор кафедры молекулярной биологии биологического факультета МГУ имени М.В.Ломоносова в лекции «Как работают рибосомы в митохондриях и нужно ли смотреть на это в микроскоп» рассказал, чем отличаются миторибосомы от других рибосом и какими методами их изучают сейчас.
Митохондрии и их рибосомы: происхождение и строение
Рибосомы привлекали внимание исследователей с момента их обнаружения в начале XX века. Самое интересное, что впервые их заметили в микроскоп именно в митохондриях, а уже потом, спустя десяток лет, обнаружили что-то подобное и в цитоплазме эукариотической клетки, и у бактерий.
Рибосомы — это одни из самых сложно организованных на молекулярном уровне структур внутри клетки. Для их функционирования важно положение буквально каждого атома. Поэтому определение атомарной структуры рибосомы стало настоящим челленджем для ученых.
Митохондрии произошли от свободноживущих бактерий около миллиарда лет назад, что подтверждается сохранившимися у них бактериальными чертами, включая наличие собственного генома. Эти гены необходимо экспрессировать, и в митохондриях есть все необходимое для этого, включая рибосомы.
Схематично рибосому можно изобразить как кастрюльку с крышкой или грибочек. Она состоит из двух субъединиц: сверху обычно рисуют маленькую, а снизу большую. Каждая субъединица — это РНК-белковый комплекс. Рибосомные РНК очень длинные, и они крайне важны для работы рибосом. Рибосомы могут диссоциировать, то есть распадаться на отдельные субъединицы, а потом ассоциировать — снова собираться. В ходе трансляции рибосома пропускает сквозь себя молекулу матричной РНК и параллельно выпускает синтезируемый белок.
Как изучают структуру рибосом?
Есть два метода определения атомарной структуры: рентгеноструктурный анализ и криоэлектронная микроскопия — основной в настоящее время.
Для рентгеноструктурного анализа готовят чистый концентрированный раствор тех частиц, структуру которых хотят определить. Этот раствор кристаллизуют, фактически выращивают кристаллы. Потом эти кристаллы просвечивают рентгеновскими лучами и получают своего рода «отпечаток» нужной молекулы. Если получилось приготовить чистые кристаллы, их много, и есть хороший источник рентгеновского излучения, то можно достигнуть атомарного разрешения. Первые структуры рибосом (не митохондриальных, а бактериальных и других) были сделаны именно этим методом. За это в том числе была присуждена Нобелевская премия по химии 2009 года.
Криоэлектронная микроскопия появилась даже раньше, чем рентгеноструктурный анализ. Развитие этого метода шло гораздо медленнее, но в последние 10—15 лет криоэлектронная микроскопия обогнала рентгеноструктурный анализ и прочно занимает лидирующие позиции. Концентрированный чистый раствор изучаемого вещества очень быстро замораживают, а потом рассматривают в электронный микроскоп. Получают много миллионов или даже миллиардов изображений и анализируют с помощью супермощного компьютера со специальным программным обеспечением, которое накладывает эти изображения друг на друга, формируя трехмерное изображение структуры. И в этом случае, если исходных изображений было много, можно достигнуть атомарного разрешения.
Первые структурные изображения рибосом
В 1991 году вышла работа, первым автором которой был Иоахим Франк — он впоследствии стал крупным специалистом по структуре рибосом, правда, не митохондриальных, а в основном бактериальных. Авторы выполнили трехмерную реконструкцию 70S рибосомы кишечной палочки методом криоэлектронной микроскопии. Приборная база тогда еще не позволяла получать изображений с атомарным разрешением.
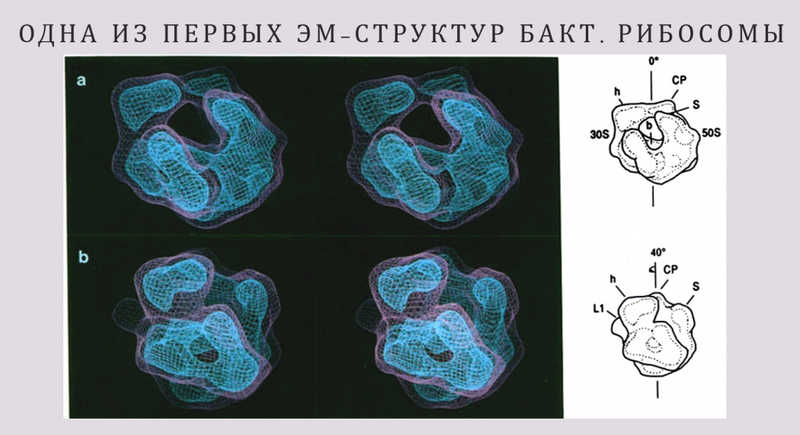
Исследователи смогли что-то смоделировать, но структура нарисована фактически от руки, с разрешением 40 ангстрем. Они изобразили малую 30S субъединицу, большую 50S субъединицу, однако никаких серьезных выводов, кроме того, что, криоэлектронная микроскопия в принципе позволяет разглядеть рибосомы, сделать было нельзя.
Докладчик сравнил это изображение с работой, которая вышла в 2023 году. Там тоже была получена структура бактериальной рибосомы методом криоэлектронной микроскопии, но разрешение уже 1,5 ангстрема — очень высокое. Можно разглядеть атом магния, координированный с шестью молекулами воды, и атом калия.

В 2003 году была опубликована первая структура митохондриальной рибосомы (миторибосомы), выделенной из клеток быка, с разрешением около 12–14 ангстрем. Она существенно отличалась от бактериальных рибосом: абсолютно другая морфология, обратное соотношение белка и РНК — в два раза больше белков, чем РНК, а в бактериальных наоборот. Кроме того, межсубъединичные контакты в митохондриальных рибосомах обеспечивает не РНК, как в бактериальных и эукариотических, а белки. Эта работа произвела революцию в умах исследователей. Стало понятно, что, во-первых, можно в принципе смотреть на структуру митохондриальных рибосом, а во-вторых, они совсем не такие, как бактериальные.
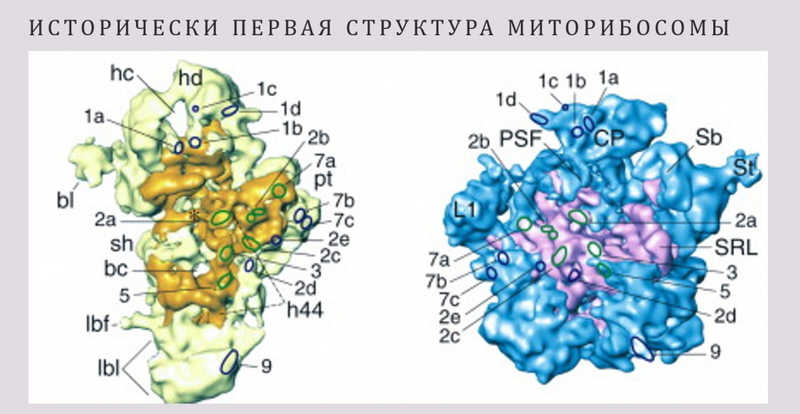
Революция в изучении митохондриальных рибосом: 2014 год
Прорыв наступил в 2014 году, когда несколько исследовательских групп одновременно опубликовали структуры миторибосом с высоким разрешением. В самой первой работе оно достигло около 5 ангстрем, и исследователям удалось получить структуру только отдельно взятой большой субъединицы. Это позволило увидеть мельчайшие детали, такие как альфа-спирали, и уточнить пространственную организацию комплекса.
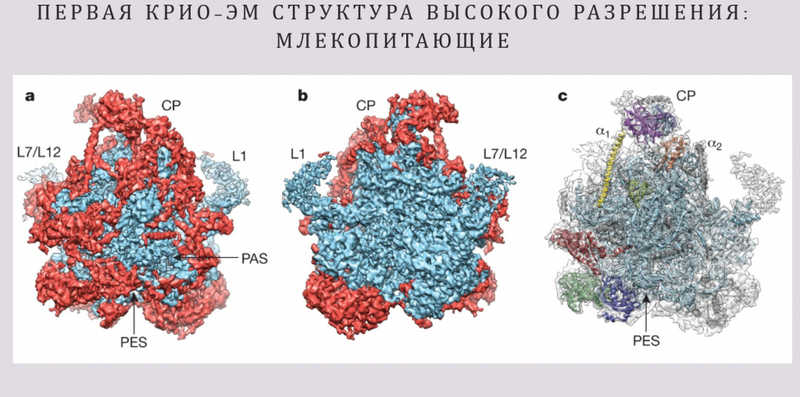
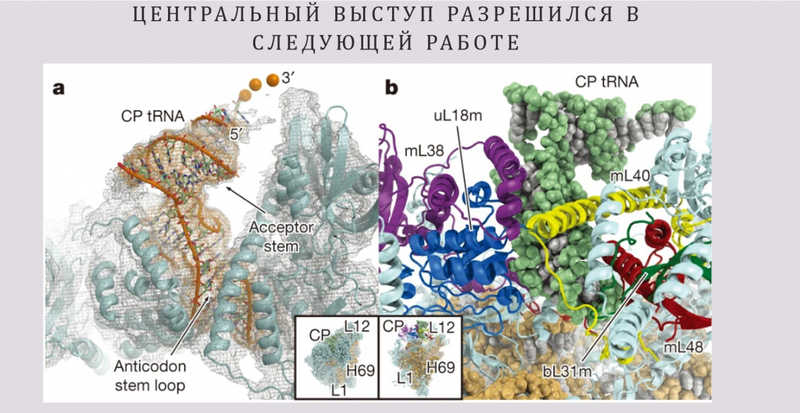
В этой статье рассматривался так называемый центральный выступ, или центральный протуберанец большой субъединицы. Это консервативная часть структуры рибосомы, она есть во всех рибосомах, в том числе и в митохондриальных. Любопытно, что у обычных эукариотических рибосом в цитоплазме этот выступ формирует специальная 5S рибосомная РНК —так называемая третья рРНК, потому что две другие рРНК формируют большую и малую субъединицы. Эта рРНК не очень большая, обычно она имеет размер около 120 нуклеотидов.
В данной работе структура центрального выступа была определена не очень хорошо (такое бывает, когда отдельные подвижные части большой структуры плохо разрешаются), но было понятно, что там присутствует РНК. Петр Каменский обратил на это особое внимание, потому что вопрос о наличии 5S РНК в митохондриальных рибосомах давно стоял перед научным сообществом. Теоретически она должна была там быть, но митохондриальный геном кодирует только две большие рРНК, формирующие субъединицы, и не кодирует 5S рРНК. Она есть в ядерном геноме, присутствует в цитоплазме, но как она попадает внутрь митохондрии? В некоторых лабораториях было экспериментально показано, что 5S РНК импортируется в митохондрии. Как раз такие исследования проводились там, где докладчик учился в аспирантуре. В других лабораториях, напротив, утверждали, что она не импортируется.
Этот вопрос был решен в следующей статье той же научной группы, которая также вышла в 2014 году, через месяц после первой. В этот раз удалось лучше разрешить структуру центрального выступа, и оказалось, что 5S рРНК в нем нет. Вместо нее присутствует транспортная РНК (тРНК), что стало большой неожиданностью.
Далее докладчик рассказал про канал в рибосоме, через который из нее выходит синтезируемый полипептид. Выход этого канала выстлан белками, уникальными для митохондриальных рибосом; их гомологов нет в других рибосомах. На основании анализа структуры можно предположить, что эти белки нужны для того, чтобы синтезируемые белки сразу интегрировались во внутреннюю мембрану митохондрий.
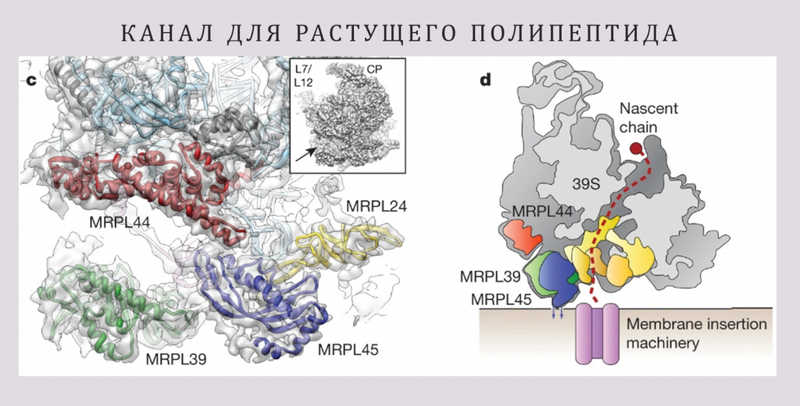
Митохондриальные геномы малы, они кодируют всего около десятка белков. Почти все они являются коровыми (центральными) компонентами митохондриальных комплексов дыхательной цепи. Поскольку эти белки должны быть встроены в мембрану, они гидрофобны. Поэтому митохондриальная рибосома должна быть прикреплена к мембране и выпускать белки прямо в нее. Иначе гидрофобные белки оказались бы в митохондриальном матриксе — водной среде, где потеряли бы структуру, и их последующая интеграция в мембрану стала бы невозможной.
Далее Петр Андреевич перешел к работе, опубликованной в том же 2014 году, но уже другой лабораторией. Первый автор, Алексей Амунтс, на тот момент работал в лаборатории Венкатрамана Рамакришнана, одного из лауреатов Нобелевской премии 2009 года. Руками Алексея Амунтса была сделана структура большой субъединицы миторибосом дрожжей, а сейчас он ведущий исследователь структуры миторибосом в мире. Он активно коллаборирует с российскими учеными, в том числе с группой Петра Каменского, и около года назад у них вышла совместная статья.
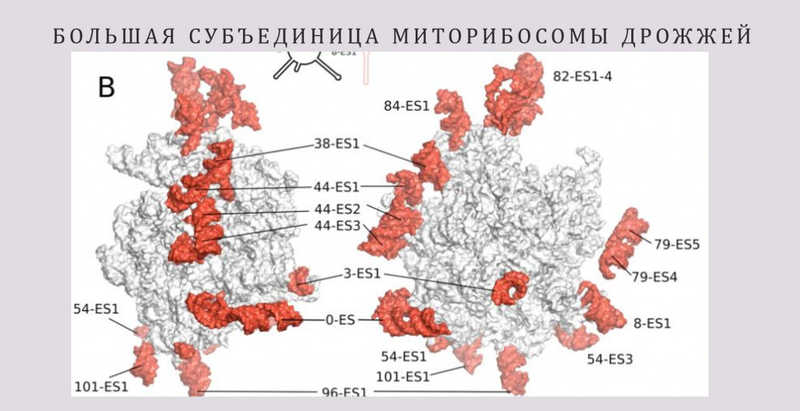
В статье Алексея Амунтса с коллегами 2014 года удалось решить структуру только большой субъединицы миторибосомы дрожжей. Разрешение получилось очень хорошее — 3,2 ангстрема — на мировом уровне того времени. У дрожжей оказалось еще больше уникальных белков в миторибосоме, чем у млекопитающих. Но самое удивительное, что в структуре их центрального выступа находится не 5S рРНК и не тРНК, а митохондриальные белки. Если у млекопитающих произошла замена специальной 5S рРНК в центральном выступе на неспециальную тРНК, то дрожжи в ходе эволюции пошли еще дальше — «решили», что у них это будут белки.
Как митохондриальная рибосома садится на мРНК
В следующем, 2015 году уже появилась информация о митохондриальных моносомах млекопитающих. Моносома — это рибосома в ассоциированном виде, то есть состоящая из двух субъединиц. До этого все структуры относились только к большой субъединице. Удалось создать детальную карту всех межсубъединичных контактов. Из предыдущих структур уже было видно, что они не такие, как у бактерий или в цитоплазме эукариот.
На этой структуре удалось разглядеть не только выход канала полипептида, но и вход в него. Он тоже оказался окружен специфическими для митохондрий белками, и это весьма интересно. Дело в том, что вход мРНК в рибосому — это самая первая стадия трансляции, которая называется инициацией. На этой стадии мРНК занимает правильную позицию в рибосоме. Туда приходят тРНК, начинают собираться факторы трансляции. После этого рибосома пошагово движется по мРНК (или протягивает мРНК сквозь себя). Очень важно, чтобы мРНК правильно встала в рибосому, в противном случае трансляция просто не пойдет.
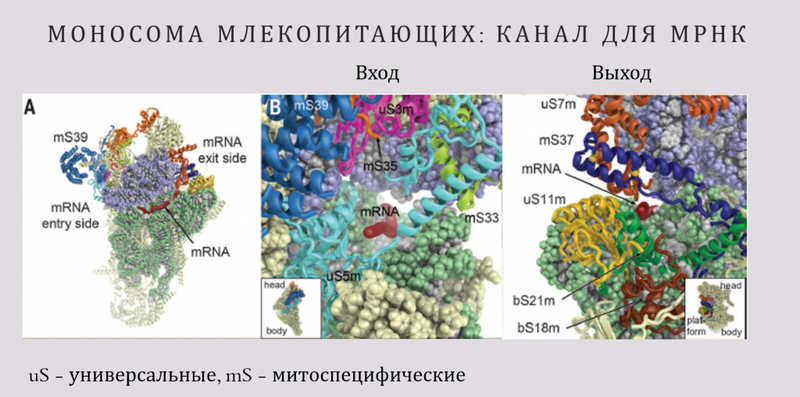
Было совершенно непонятно, как мРНК встает в рибосому. Допустим, у бактерий есть специальный механизм инициации трансляции. У любой бактериальной мРНК имеются длинные 5'-нетранслируемые области, которые не подвергаются трансляции. Там находятся различные элементы распознавания для рибосом. Они садятся именно туда, и там происходит сборка инициаторного комплекса из рибосомы, тРНК и факторов инициации. У мРНК дрожжей тоже есть длинные 5'-нетранслируемые области. А у млекопитающих в митохондриях их просто нет. Максимальная длина 5'-нетранслируемой области какой-либо митохондриальной мРНК млекопитающих — два нуклеотида.
Казалось бы, рибосоме просто некуда сесть. Что можно предположить? Видимо, она сразу садится на стартовый кодон. Но чтобы так происходило, нужно что-то очень особенное. В частности, нужны эти самые специфические митохондриальные белки на входе мРНК в рибосому. Вероятно, это они помогают ей правильно расположиться.
Как рибосомы связываются с мембраной митохондрий
Докладчик рассказал о статье 2021 года из лаборатории Алексея Амунтса. Белок OXA1L играет ключевую роль в ассоциации митохондриальной рибосомы с внутренней мембраной митохондрий. Он не является рибосомным белком, но тесно связан с рибосомами, взаимодействуя с большой субъединицей во время трансляции. Сам OXA1L заякорен во внутренней мембране, именно он обеспечивает прикрепление митохондриальной рибосомы к мембране, чтобы синтезируемые белки могли встроиться в нее.
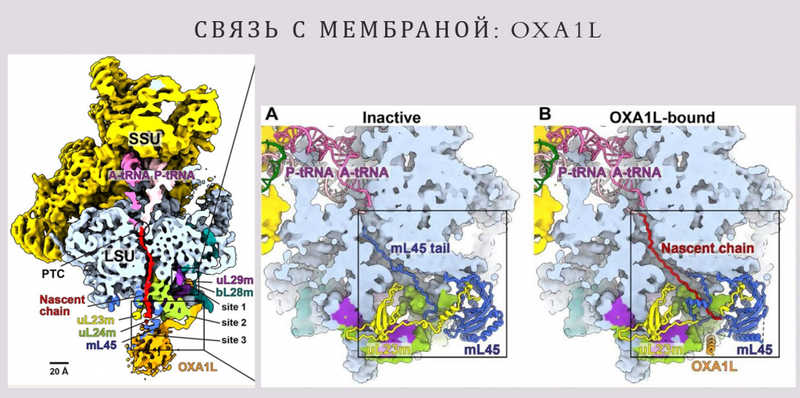
Важную роль в этом процессе играет белок ML45. Он действует как «крышка», закрывающая выходной канал рибосомы, если нет взаимодействия с OXA1L. В этом случае рибосома не связана с мембраной, и растущий полипептид может попасть в митохондриальный матрикс, где его нормальная функция нарушится, а сам белок может деградировать. При связывании OXA1L с рибосомой происходит конформационная перестройка ML45. Он открывает канал и позволяет новосинтезируемому белку попасть в мембрану.
Можно ли доверять результатам структурных исследований
Следующая часть доклада была посвящена тому, что не всегда стоит безоговорочно доверять результатам структурных исследований. Петр Андреевич остановился на инициации трансляции — это основной предмет его интереса в последние 12–13 лет.
Этот процесс различается у бактерий и в митохондриях. У бактерий есть три белковых фактора инициации (IF1, IF2 и IF3), не являющиеся рибосомными белками. Готовый инициаторный комплекс включает два фактора инициации и инициаторную тРНК. После установки инициаторной тРНК на стартовый кодон факторы покидают рибосому, и начинается элонгация.
У млекопитающих инициация в митохондриях происходит иначе. Например, IF1 отсутствует, так как он встроился в MTIF2, образуя единый белок, который совмещает функции IF1 и IF2. Эти данные получены из структурных исследований, которые с 2018 года изучают не только рибосомы, но и их комплексы с факторами инициации.
Однако такие исследования имеют ограничения. Обычно рибосомы выделяют из клеток, а затем к ним добавляют очищенные белки — MTIF2 и MTIF3 (митохондриальные факторы инициации). В пробирке они образуют тройственный комплекс с чистой инициаторной тРНК, но это может быть артефактом — нет никаких гарантий, что в клетке происходит то же самое, что в пробирке.
В работе, опубликованной в 2020 году, сделан вывод, что MTIF2 и MTIF3 абсолютно необходимы для митохондриальной трансляции. Однако исследования, которые изучают этот процесс не только структурно, но и функционально, показали, что это не так. В одном из них Петр Каменский с коллегами создали нокаутные клеточные линии млекопитающих, полностью лишенные белка MTIF3, и с помощью вестерн-блоттинга подтвердили его отсутствие. Затем исследовали митохондриальную трансляцию и обнаружили, что она продолжается почти так же, как в клетках дикого типа. Единственным эффектом, который они нашли, стало снижение уровня белка ATP6.
Что интересного про синтез ATP6?
Среди всех митохондриальных мРНК млекопитающих две являются бицистронными — содержат 2 матричных РНК, из них синтезируются по 2 белка. Например, мРНК ATP8/ATP6. Эффект отсутствия MTIF3 был направлен только на белок ATP6, у которого фактически есть нетранслируемая область — рамка считывания ATP8.
Исследования другой лаборатории в работе 2024 года показали, что, во-первых, все митохондриальные мРНК человека образуют много шпилек. На мРНК ATP8/ATP6 в месте перекрывания рамок считывания как раз присутствует шпилька. Во-вторых, авторы статьи выдвинули гипотезу, почему MTIF3 нужен только для синтеза АТР6.
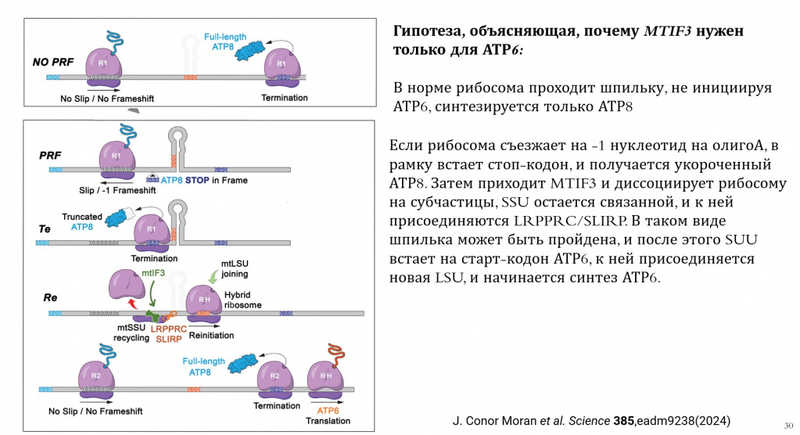
В норме рибосома проходит шпильку, не инициируя продукцию АТР6, синтезируется только АТР8. Но на мРНК есть так называемая скользкая последовательность, на которой рибосома может съехать по рамке считывания на 1–2 нуклеотида. Если она съехала на один нуклеотид назад, тогда в рамку встает стоп-кодон, и получается укороченный АТР8. Затем, согласно выдвинутой гипотезе, приходит MTIF3 и диссоциирует рибосому на субъединицы. Большая субъединица уходит, а малая остается связанной. В таком состоянии она может преодолеть шпильку. После шпильки располагается старт-кодон АТР6, на котором происходит повторная инициация трансляции. Приходит новая большая субъединица, и начинается синтез АТР6. Это напоминает механизмы трансляции у бактерий, где рибосома на бицистронных матрицах может проходить стоп-кодон и начинать синтез нового белка без диссоциации.
Важен ли для митохондриальной трансляции фактор SLIRP?
Последняя часть лекции была посвящена трансляционному фактору SLIRP. Белки LRPPRC и SLIRP являются трансляционными факторами в митохондриях млекопитающих. Они не входят в состав миторибосом, а лишь помогают. Их точная роль оставалась неясной, пока структурные исследования с очищенными белками не показали, что они связываются на входе мРНК в рибосому. Возникло предположение, что они важны для всей митохондриальной трансляции, так как расплетают вторичные структуры мРНК перед ее поступлением в рибосому. Однако структурные данные, полученные in vitro, требуют проверки.
Исследователи из лаборатории Петра Каменского сосредоточились на SLIRP и провели похожий эксперимент с нокаутной клеточной линией. По структурным данным в клетках без SLIRP трансляция митохондриальных белков не происходила бы. Но результаты эксперимента показали, что трансляция сохраняется, а митохондрии остаются функциональными. В клетках без SLIRP ослаблен синтез отдельных белков, в том числе субъединиц IV комплекса дыхательной цепи — цитохром-с-оксидазы. Таким образом, SLIRP не является универсальным фактором трансляции, а участвует в регуляции синтеза лишь некоторых митохондриальных мРНК.
Дополнительный эксперимент по градиентному центрифугированию также выявил расхождение между структурными и биохимическими данными. Ожидалось, что SLIRP связывается с целыми рибосомами, но он присутствовал только в составе малых субъединиц.
Таким образом, структурные исследования миторибосом — мощный инструмент, но только когда анализируется то, что выделено из клетки. Когда же в систему добавляются дополнительные белки или РНК, то результаты могут не иметь много общего с действительностью, подвел итог докладчик.
Белок MTIF3 по структурным данным казался универсальным фактором инициации митохондриальной трансляции. Но по биохимическим данным он оказался специфическим фактором для одной-единственной мРНК. Точнее, для ее фрагмента — двухцистронного участка ATP8/ATP6.
Белок SLIRP, согласно структурным данным ассоциированный с целыми рибосомами, должен был участвовать в трансляции всех мРНК. По биохимическим данным он оказался специфическим фактором трансляции лишь нескольких митохондриальных мРНК, кодирующих компоненты цитохром-с-оксидазного комплекса. Он действует на только уровне инициации трансляции, поскольку связан с малыми субъединицами миторибосом, которые как раз и отвечают за этот процесс.

Другие лекции блока «Клетка»
Гелина Копеина: «Без клеточной гибели терапия рака не сработает»
Виктор Татарский: «Все, что я вам рассказал, — это немножко ложь или сильное упрощение»
Мария Ломакина: «Миграционно пластичные опухолевые клетки могут всё»


 Меню
Меню





 Все темы
Все темы




 0
0






