Разбор амилоидных агрегатов
Одна из самых цитируемых статей по болезни Альцгеймера подвергнута критике: утверждают, что в ней есть признаки фальсификации данных. Что теперь будет с «бета-амилоидной» теорией болезни, она действительно под угрозой из-за одной этой работы? Есть ли тут связь с неудачами новых препаратов против болезни Альцгеймера? Как выглядит поддельный вестерн-блот и как в свободное время разоблачить фабрику по производству статей?
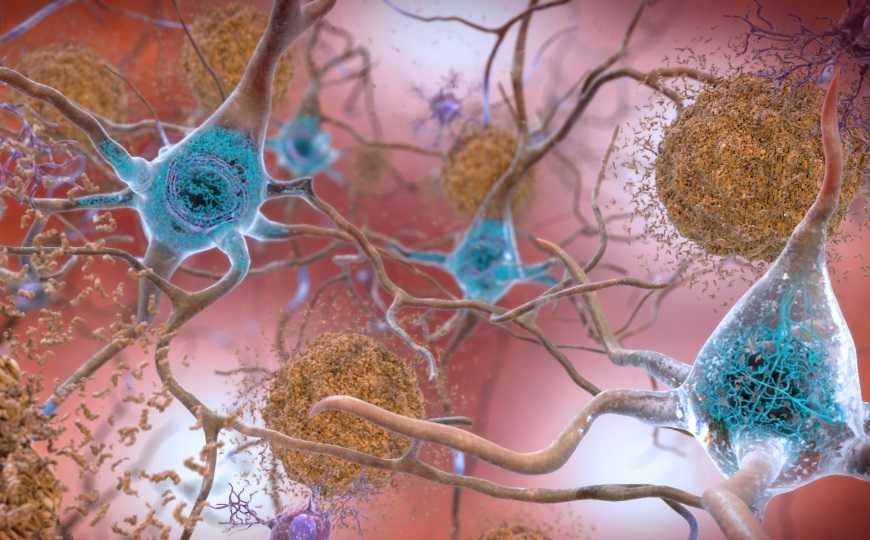
Бета-амилоидные бляшки и тау-белок в представлении художника. В мозге, пораженном болезнью Альцгеймера, молекулы бета-амилоида (светло-коричневый) образуют бляшки между нейронами, а клубки тау (синий) формируются внутри нейронов. Эти процессы связаны между собой, однако в патогенезе участвуют и другие факторы.
Credit:
National Institute on Aging, NIH | flickr.com
Что за история с фальсифицированными данными?
В конце июля 2022 года журнал Science опубликовал статью, которая рассказывает о расследовании Мэтью Шрэга, нейробиолога из университета Вандербильта. Он получил заказ на проверку экспериментальных данных по препарату под названием «симуфилам» от компании Cassava Sciences. Клиенты Шрэга, тоже биологи, владели акциями компании и заподозрили ее в фальсификации данных. Они решили подать в суд на Cassava Sciences c требованием финансовой компенсации.
Шрэг действительно нашел методологические и фактические нарушения, однако расследование завело его дальше, чем предполагалось. Ученый обнаружил цепочку возможных манипуляций с научными данными в работах Сильвена Лесне. Одна из статей, опубликованная в Nature, была процитирована более 2000 раз.
А как работает этот симуфилам?
Действующее вещество симуфилама — это маленькая органическая молекула под названием PTI-125. Она взаимодействует с филамином А и препятствует его патологическим конформационным перестройкам. Ученые предполагают, что это должно улучшить состояние пациентов. Измененный филамин А участвует в патогенных сигнальных каскадах, приводящих к нейровоспалению. Перестройки в филамине А, в свою очередь, вызваны амилоидом β, который считается основным фактором развития болезни Альцгеймера.
Эта болезнь была впервые описана в начале XIX века немецким врачом Алоисом Альцгеймером. Он изучал мозг женщины по имени Августа Детер, которая умерла после продолжительной деменции и потери памяти. На посмертных окрашенных препаратах врач обнаружил многочисленные белковые бляшки и клубки в нейронах.
То есть причина болезни с самого начала была известна?
Не совсем. Болезнь Альцгеймера до сих пор остается большой нерешенной проблемой биологии и медицины.
Через 80 лет после открытия Алоиса Альцгеймера ученые выделили основной компонент бляшек и назвали его амилоидом β (Aβ). К 1990-м это открытие развили до гипотезы амилоидного каскада, согласно которой агрегация белка Aβ приводит ко всем известным патологиям в организме при болезни Альцгеймера. В том числе к изменению конформации других белков, например филамина А.
Тем не менее существуют и альтернативные гипотезы. Например, тау-гипотеза гласит, что основной проблемой в болезни Альцгеймера является белок тау, который после фосфорилирования формирует нейрофибриллярные клубки в аксонах нервных клеток. Также ученые ищут причины болезни Альцгеймера в воспалительных реакциях, метаболизме глюкозы и окислительном стрессе нейронов. Каждое из объяснений позволяет фармацевтическим компаниям находить терапевтические мишени.
С конца ХХ века гипотеза амилоидного каскада считается основной. Это очень беспокоит часть научного сообщества, которая полагает важным рассматривать разные варианты возникновения болезни. Совсем недавно, четыре года назад, была найдена связь между болезнью Альцгеймера и инфекциями бактериальной и вирусной природы.
Кто такой Мэтью Шрэг?
Мэтью Шрэг, который провел расследование против Cassava Sciences, — практикующий врач в университете Вандербильта (США). Он специализируется на пересечении сосудистых и когнитивных заболеваний, в частности, изучает патологические изменения кровеносной системы во время болезни Альцгеймера. По мнению самого Шрэга, причина этой болезни может крыться в нарушениях работы сосудов.
Мэтью Шрэг также известен своей критикой другого препарата против болезни Альцгеймера — адуканумаба (Адухелма) от компании Biogen. Когда FDA одобрило Адухелм, это вызвало огромный резонанс среди врачей и сотрудников фармкомпаний. Шрэг считал, что решение FDA дестабилизирует равновесие между различными гипотезами о природе болезни Альцгеймера.
И что же выяснил Мэтью Шрэг?
Расследование привело его на сайт PubPeer. Это ресурс, где каждый пользователь может анонимно рассказать о подозрительных результатах научной статьи.
Трое ученых — Брэндон Стелл, Джордж Смит, Ричард Смит — основали PubPeer в 2012 году. Они стремились сделать науку как можно более открытой для критики. В основном ресурс существует на добровольные пожертвования пользователей, однако в 2016 году PubPeer получил $415 000 от фонда Лауры и Джона Арнольд. Этот американский фонд финансирует социальные и научные инициативы. Некоторые пользователи PubPeer раскрывают целые фабрики по производству статей.
Шрэг искал на этом сайте доказательства фальсификации, совершенной Cassava Sciences, однако по запросу «болезнь Альцгеймера» нашел кое-что более интересное.
Он обнаружил запись о статье 2016 года из Journal of Neuroscience. Ее авторы демонстрировали, что агрегаты Aβ становятся причиной фосфорилирования белка тау, то есть статья подтверждала гипотезу амилоидного каскада. Пользователь PubPeer заявлял, что результаты вестерн-блота были обработаны в фотошопе.
Благодаря собственному мини-расследованию Шрэг нашел похожие следы фотошопа в одном из самых цитируемых исследований болезни Альцгеймера XXI века. Это статья из Nature, опубликованная в 2006 году. Первым автором статьи указан Сильвен Лесне, а его руководителем была Карен Эш. Лесне также был одним из авторов статьи 2016 года.
Кто такие Карен Эш и Сильвен Лесне?
Карен Эш — известный нейробиолог, работала в группе нобелевского лауреата Стэнли Прузинера, специалиста по прионам. В середине 1990-х годов Эш вывела трансгенную мышь, клетки которой производят человеческий Aβ. Белок образовывал бляшки в мозге животных, а а сами мыши демонстрировали все симптомы болезни Альцгеймера.
Сильвен Лесне сейчас возглавляет программу PhD в университете Миннесоты и продолжает заниматься исследованиями. В этом году он получил грант от Национальных институтов здравоохранения США (NIH) на пять лет. В 2009 году, через три года после публикации в Nature, Лесне создал свою лабораторию, которая также финансировалась из бюджета NIH.
Почему эта статья важна для фарминдустрии?
Накопление амилоидных агрегатов — самая очевидная особенность болезни Альцгеймера, и поэтому ингибирование этого процесса считается наиболее перспективной терапевтической стратегией.
Однако к началу XXI века гипотеза амилоидного каскада начала угасать. Научное сообщество всерьез обдумывало отказ от этой идеи, но в 2006 году, спустя 100 лет после открытия болезни Альцгеймера, в Nature вышла статья Лесне с соавторами.
По словам нобелевского лауреата Томаса Зюдхофа, результаты Лесне вдохновили сторонников гипотезы амилоидного каскада и помогли им справиться с растущими сомнениями. Сейчас гипотеза амилоидного каскада занимает доминирующую позицию в научной среде. В этом году NIH потратила около 1,6 млрд долларов на исследования, в которых упоминаются амилоиды. Это более половины от всего бюджета на исследование болезни Альцгеймера. Однако сотни препаратов, нацеленных на амилоид, так и не продемонстрировали эффективности в клинических испытаниях.
В этой статье действительно была фальсификация данных?
Фотографии вызывают обеспокоенность. На них было обнаружено множество резких прямых линий — возможных свидетельств, что некоторые полосы были скопированы из другого изображения. Положение полос на вестерн-блоте соответствует молекулярному весу белка, поэтому такие вставки снижают доверие к результатам.
После публикации замечаний Эш предоставила сырые данные, которые были отправлены в журнал. На них никаких резких линий не видно. Эш настаивала, что найденные признаки редактирования изображений являются цифровым артефактом. Однако в ее данных один из экспертов нашел примеры других манипуляций. На исходных графиках присутствовали многочисленные дупликации, которые были подтверждены математическим попиксельным анализом полос. Более того, повторяющиеся детали были обнаружены также на мембране вдали от белковых полос. Всю историю обсуждения графиков с примерами можно прочитать тут.
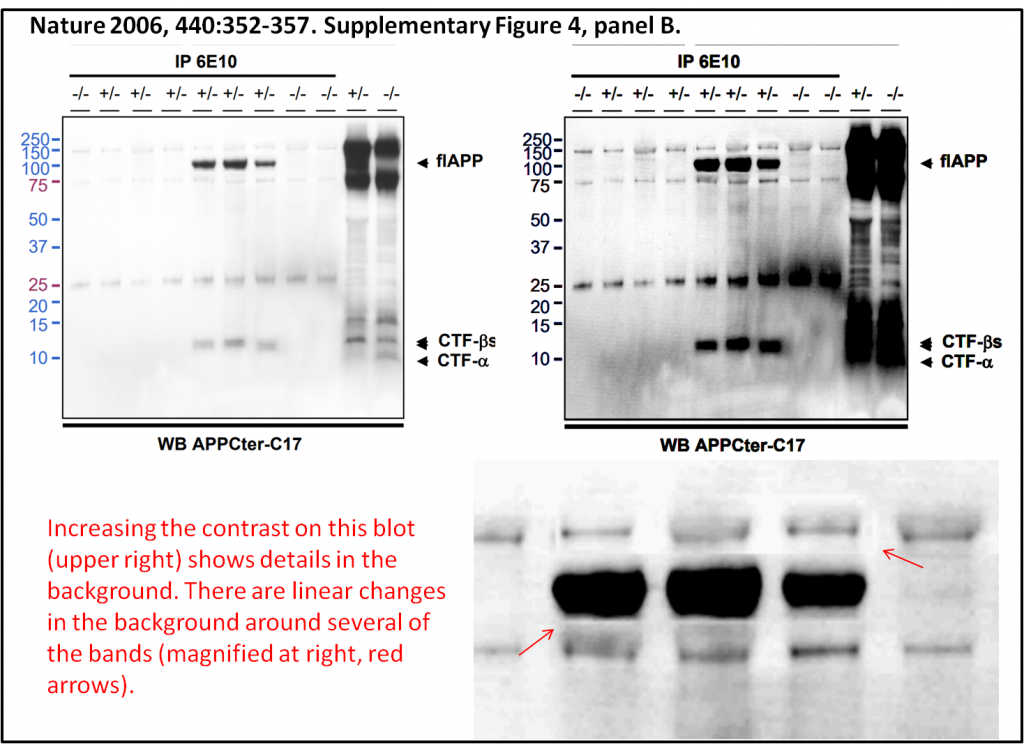 Сомнительный блот. Слева — рисунок из статьи (Supplementary Figure 4b), справа — он же с увеличенной контрастностью. Внизу — подозрительный участок крупно, стрелками показаны резкие линии, похожие на признаки редактирования изображения. Credit: PubPeer
Сомнительный блот. Слева — рисунок из статьи (Supplementary Figure 4b), справа — он же с увеличенной контрастностью. Внизу — подозрительный участок крупно, стрелками показаны резкие линии, похожие на признаки редактирования изображения. Credit: PubPeer
Как это повлияет на гипотезу амилоидного каскада?
Сейчас наверняка можно говорить лишь о последствиях для работ Лесне и Эш, ведь в их публикациях были найдены возможные фальсификации.
Aβ образует агрегаты различного размера. В своей работе 2006 года Лесне и Эш утверждают, что они выделили токсичную форму белка, которая ответственная за патогенез при болезни Альцгеймера — додекамер Aβ *56. Эти результаты были серьезным доказательством в пользу гипотезы амилоидного каскада, так как авторы смогли уточнить, какие агрегаты амилоида вызывает болезнь.
Часть ученых считает, что подтверждение намеренной подтасовки данных не повлияет на все научное направление в целом. По их мнению, работа Лесне была весомым, но не единственным доказательством гипотезы амилоидного каскада. Например, известно, что мутации в Aβ снижают заболеваемость болезнью Альцгеймера.
А симуфилам действительно не работает? Как это скажется на индустрии?
Экспертная оценка выявила многочисленные методологические нарушения и несостыковки в лабораторных исследованиях. В основном истцы обратили внимание на многочисленные подозрительно похожие белковые полосы на вестерн-блоте. Они присутствовали как на одном и том же рисунке, так и на разных. В некоторых случаях полосы были точным зеркальным отображением друг друга. Также на некоторых вестерн-блотах эксперты заметили полосы, вокруг которых мембрана светлее, чем на остальном рисунке. Светлые зоны имели прямоугольную форму. Кроме этих замечаний, истцы отметили несоответствия в расчетах.
Полный список замечаний можно найти тут, однако Элизабет Бик, одна из экспертов, проверяющих результаты расследования Шрэга, собрала все замечания к графикам статей в своем блоге.
Все три работы, посвященные симуфиламу, были выполнены в лаборатории Хоу-Ян Вана (Hoau-Yan Wang) в Городском университете Нью-Йорка. Элизабет Бик обнаружила сомнительные графики еще в пяти статьях этой группы. Самая ранняя из этих работ опубликована в 2008 году в PLoS ONE, а самая поздняя — в 2014-м в том же журнале.
Сначала FDA отклонил петицию о манипуляциях с данными, однако месяц назад правительство США начало расследование по поводу возможных фальсификаций в результатах эксперимента.
Скандал по поводу симуфилама может привести к репутационным потерям для препаратов против амилоида и перераспределению финансирования. Интересно, что год назад в медицинском сообществе активно обсуждалось неудача другого препарата, придуманного в контексте гипотезы амилоидного каскада, — Адухелма.
А что за история с Адухелмом?
Адухелм — терапевтичеcкое антитело, которые было нацелено на агрегаты Aβ. Предполагалось, что таким образом препарат замедлит рост белковой фибриллы и нивелирует патологии болезни. Он был разработан компанией Biogen. В прошлом году Адухелм стал первым препаратом, таргетирующим агрегаты Aβ, который был одобрен FDA.
Это решение вызвало много дискуссий, потому что Адухелм оказался также первым препаратом для лечения болезни Альцгеймера, одобренным по ускоренной процедуре. В клинических испытаниях Адухелм не показал эффективности. (Подробнее о непростой истории Адухелма читайте на PCR.NEWS, в итогах 2021 года.)
Почему же его допустили на рынок, если все было так плохо?
Грубо говоря, потому что принципиально он работал — количество агрегатов действительно уменьшалось, однако состояние пациентов не улучшилось. Такой вид одобрения часто используется для противоопухолевых препаратов — в этом случае комиссия смотрит на уменьшение опухоли, а не на состояние пациентов.
Решение FDA побудило другие фармацевтические компании (например, Eli Lilly с препаратом под названием «донанемаб») податься на одобрение по ускоренной процедуре. А в научной среде началось обсуждение: как сильно все это повлияет на лидерство гипотезы амилоидного каскада?
Однако через некоторое время Biogen решила свернуть кампанию по продвижению препарата и объявила о смене генерального директора.
А другие лекарства от болезни Альцгеймера? Есть что-нибудь на стадии КИ?
По данным NIH, сейчас в мире существует 38 препаратов, для которых начаты клинические исследования. Их механизмы действия весьма разнообразны. Например, в США идут исследования антивирусной терапии болезни Альцгеймера. Также в США проводят испытание монтелукаста — антилейкотриенового противовоспалительного препарата, который используется для профилактики бронхиальной астмы. Появляются и новые потенциальные лекарства. В августе компания Merck объявила о коллаборации с частной компанией Cerevance. Они намереваются проверить на пациентах с болезнью Альцгеймера малую молекулу CVN424, которая уже показала эффективность против болезни Паркинсона.
Если говорить о гипотезе амилоидного каскада, то исследователи продолжают попытки остановить образование новых молекул Aβ. Этот белок не синтезируется в процессе трансляции, он формируется путем двухэтапного ферментативного расщепления белка-предшественника (AAP). В этом процессе участвуют β- и γ-секретазы. С 2010-х годов фармкомпании пытаются разработать эффективный ингибитор этих ферментов. В этом году Biogen доложил на конференции об эффективности такого препарата — терапевтического антитела, получившего название «леканемаб». Препарат нацелен на β-секретазу. Опубликовать результаты исследования компания планирует этой осенью.
Что еще можно почитать о болезни Альцгеймера и фальсификациях
Рассуждения Дерека Лоу, медицинского химика, работающего в области доклинических исследований. Он излагает свое личное мнение по поводу последствий, которые может вызвать ситуация со статьями Лесне
Пересказ скандала вокруг Cassava Science от The New York Times


 Меню
Меню





 Все темы
Все темы




 0
0