Итоги-2021
Традиционный подарок читателям от редакции: самые обсуждаемые темы года. Победное шествие мРНК-вакцин и белкового фолдинга, редактирование человека и красного морского леща, громкие судебные процессы и многое другое.

COVID-19
К сожалению, COVID-19 остался темой года. К счастью, мы знаем, как контролировать пандемию, пусть не везде еще получилось. В большинстве стран проводится массовая вакцинация, и частота нежелательных последствий коронавирусной инфекции обратно пропорциональна доле вакцинированных. Осложнения от вакцин оказались крайне редкими, тревоги по поводу «недостаточно проверенных препаратов» не сбылись.
Но появились новые варианты, вызывающие опасения или требующие наблюдения, — альфа, бета, гамма, дельта, другие, которых мы уже не помним, и наконец, омикрон. Обозначения штаммов греческими буквами ВОЗ ввела в июне 2021 года. Омикрон — штамм с рекордным числом мутаций, который уклоняется от иммунного ответа и быстро распространяется. Даже если доля тяжелых случаев будет снижена из-за свойств вируса и (или) хотя бы частичной иммунной защиты переболевших и вакцинированных, большое число зараженных может увеличить нагрузку на здравоохранение. Но эта история показала преимущество современных методов мониторинга, прежде всего секвенирования. Если от первой информации о новом штамме до начала роста в других странах проходит хотя бы две недели, этого недостаточно, чтобы привить население обновленными вакцинами, но достаточно, чтобы начать срочную ревакцинацию вакцинами существующими, как сделала Великобритания.
Омикрон, как ранее дельта, стремится вытеснить все другие варианты вируса. Но это снижает вероятность того, что нам придется бороться одновременно с двумя штаммами.
Появились таблетки против коронавируса. Паксловид, продукт компании Pfizer, в десять раз снизил риски госпитализации или смертей, связанных с COVID-19. Молнупиравир, препарат Merck и Ridgeback Biotherapeutics, уступает ему в эффективности: сначала компании сообщили, что он снижает риск госпитализации или смерти среди пациентов с высоким риском на 50%, но более поздний анализ показал снижение всего на 30%.
 Credit: 123rf.com
Credit: 123rf.com
Бум мРНК-вакцин
Как выяснилось благодаря коронавирусу, мРНК вакцины работают. Вместо белка-антигена или его гена в вирусном векторе можно вводить в организм матричную РНК в липидных наночастицах, и всё получается: антиген вырабатывается в организме, развивается полноценный иммунный ответ. Компания Moderna объявила о воодушевляющих результатах фазы 1 клинических исследований четырехвалентной вакцины против гриппа (mRNA-1010). А вакцина против респираторно-синцитиального вируса дошла до фазы 2/3. В планах компании комбинированная вакцина против коронавируса и гриппа и даже панреспираторная (коронавирус-грипп-РСВ).
На животных испытали и более интересные варианты, например мРНК-вакцину против укуса клеща. Клещи — переносчики бактерий и вирусов, и если вызвать иммунный ответ на укус, то можно защититься от многих опасных инфекций. В состав вакцины вошли мРНК 19 белков, содержащихся в слюне клещей. На вакцинированных морских свинках клещи медленнее набирали массу и быстрее отваливались, а аероятность заражения возбудителем болезни Лайма значительно снизилась. В другой работе на мышах протестировали мРНК-вакцину от малярии. Эффективность достигла 88%. Для сравнения, эффективность самой удачной из имеющихся противомалярийнывх вакцин RTS,S/AS01 — не более 30–40%.
Среди соавторов статей про вакцины от малярии и клеща — Дрю Вайсман из Университета Пенсильвании. Работа Вайсмана и его коллеги Каталин Карико, опубликованная в 2005 году, помогла создать мРНК-вакцины против коронавируса: именно они предложили модифицировать мРНК, чтобы уменьшить ее разрушение в организме. Вайсман и Карико в последние два года уже получили множество научных наград, возможно, их список пополнит и Нобелевская премия.
ВИЧ
И снова мРНК-вакцины. Национальный институт аллергии и инфекционных заболеваний США совместно с компанией Moderna и другими научными центрами создал вакцину против трех подтипов ВИЧ — A, B и С. Она включает мРНК белков Env и Gag, которые при экспрессии в клетке формируют вирусоподобные частицы. У вакцинированных макак риск заражения химерным вирусом иммунодефицита обезьян-человека снизился на 79%.
А очередная аденовирусная вакцина против ВИЧ потерпела фиаско. В конце августа компания Johnson & Johnson обнародовала неудовлетворительные результаты фазы 2b клинических испытаний вакцины Imbokodo (HVTN 705/HPX2008). Ее эффективность составила всего 25,2%. В феврале прошлого года были остановлены испытания еще одной вакцины против ВИЧ — HVTN 702. Однако J&J продолжает фазу КИ Mosaico, где тестируется другая схема иммунизации.
Зато в Конго обнаружили необычно большую долю потенциальных элитных ВИЧ-контроллеров — людей с антителами к ВИЧ, не получающих антиретровирусной терапии, у которых при этом вируса в крови нет. Таких людей среди конголезских ВИЧ-инфицированных оказалось 2,7–4,3%, тогда как во всем мире — 0,1–2,5%. Если удастся понять, в чем причина, это может проложить путь к новым методам лечения и профилактики ВИЧ.
 Исследование образцов ВИЧ-инфицированных. Credit: Пресс-релиз компании Abbott
Исследование образцов ВИЧ-инфицированных. Credit: Пресс-релиз компании Abbott
Генная терапия: не так быстро
Компания Bluebird Bio ведет клинические испытания и программы по внедрению в клинику препаратов для генной терапии, основанных на лентивирусных векторах. Терапия проводится ex vivo: отбирают гемопоэтические стволовые клетки пациента, редактируют и пересаживают пациенту обратно. В 2019 году PCR.NEWS включил терапию Bluebird Bio в список препаратов года.
В целом терапия работает хорошо, однако в 2021 году возникли сомнения в ее безопасности: у пациентов, принимавших участие в испытаниях препаратов против серповидноклеточной анемии и церебральной адренолейкодистрофии, развились тяжелые гематологические заболевания. Из-за этого приостановили клинические испытания препаратов LentiGlobin BB305 и Lenti-D. В первом случае компания привела доказательства отсутствия связи заболевания с препаратом, испытания возобновились. Во втором случае возможное воздействие терапевтического вектора не исключается.
В декабре клинические испытания LentiGlobin BB305 приостановили снова, на этот раз частично, из-за персистентной анемии у подростка, получившего терапию.
CRISPR-терапия
В декабре 2020 года были опубликованы результаты клинических испытаний, в которых участвовали пациентка с серповидноклеточной анемией и пациентка с бета-талассемией. Геномы их клеток редактировали ex vivo с помощью CRISPR. В обоих случаях состояние женщин значительно улучшилось. КИ спонсировали компании CRISPR Therapeutics и Vertex Pharmaceuticals.
В том же году американская компания Intellia Therapeutics запустила клинические испытания терапии наследственного транстиретинового амилоидоза с полинейропатией; препарат NTLA-2001, также на основе CRISPR, вводился уже in vivo. В 2021 году опубликовали предварительные результаты фазы 1. В исследовании приняли участие две группы по три пациента в каждой; они получали инъекцию препарата в дозировке 0,1 мг/кг или 0,3 мг/кг. Через месяц у первой группы пациентов уровень патогенного белка в плазме снизился в среднем на 52%, во второй группе — на 87%. Серьезных побочных эффектов не наблюдалось.
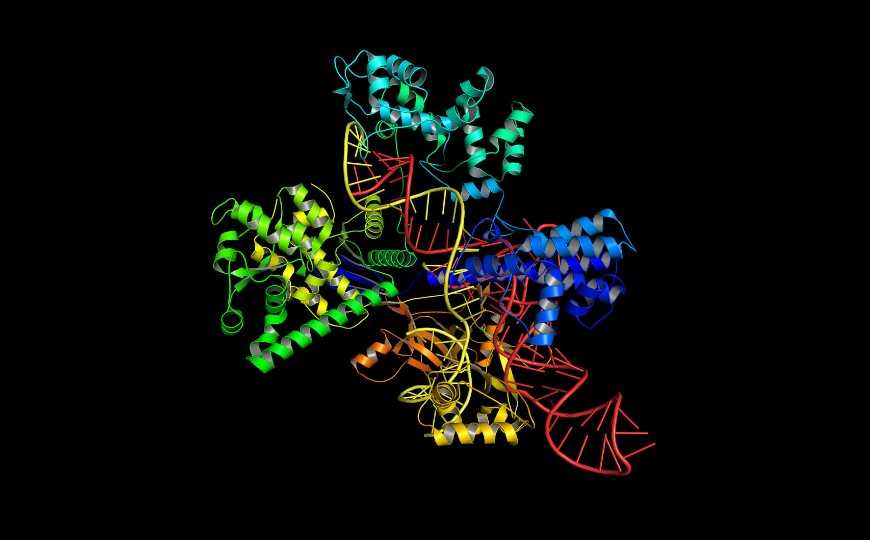 Система CRISPR-Cas9. Credit: 123rf.com
Система CRISPR-Cas9. Credit: 123rf.com
Лекарство от болезни Альцгеймера: всё сложно
Летом в США был зарегистрирован первый в мире препарат против болезни Альцгеймера, нацеленный на амилоидные бляшки. Препарат адуканумаб (торговое название Aduhelm), разработан компанией Biogen и представляет собой человеческое моноклональное антитело против бета-амилоидов. По мнению независимой консультативной группы, компания-производитель получила недостаточно данных, чтобы делать вывод о его эффективности. После регистрации адуканумаба три члена консультативной группы уволились, а процедурой регистрации заинтересовались органы власти. Тем не менее в июне врачи предвидели большой спрос на препарат, и в декабре Biogen объявил о снижении цены на него.
Регистрация адуканумаба подстегнула других разработчиков. Осенью заявку на одобрение своего моноклонального антитела против болезни Альцгеймера подала компания Eli Lilly, которая изначально не собиралась этого делать в 2021 году.
Предсказание структуры белков
В прошлом году алгоритм AlphaFold, разработанный стартапом DeepMind, решил проблему с полувековой историей: как эффективно предсказывать третичную структуру белка по его первичной структуре. В 2021 AlphaFold научился предсказывать структуру мультисубъединичных белковых комплексов. Новую модель назвали AlphaFold-Multimer и картировали с ее помощью 4 333 белковых комплекса. Точность модели при предсказании структуры гомомерных составила примерно 69% — на сегодня это отличный результат.
Прежнюю версию AlphaFold в комбинации с алгоритмом RoseTTAFold, разработанным командой из США под руководством Дэвида Бейкера, использовали для предсказания структуры эукариотических белковых комплексов. После анализа 8,3 млн. пар дрожжевых белков программы идентифицировали 1 505 вероятных белок-белковых взаимодействий.
Новые достижения структурной биологии сразу же начали применять для исследования белков SARS-CoV-2.
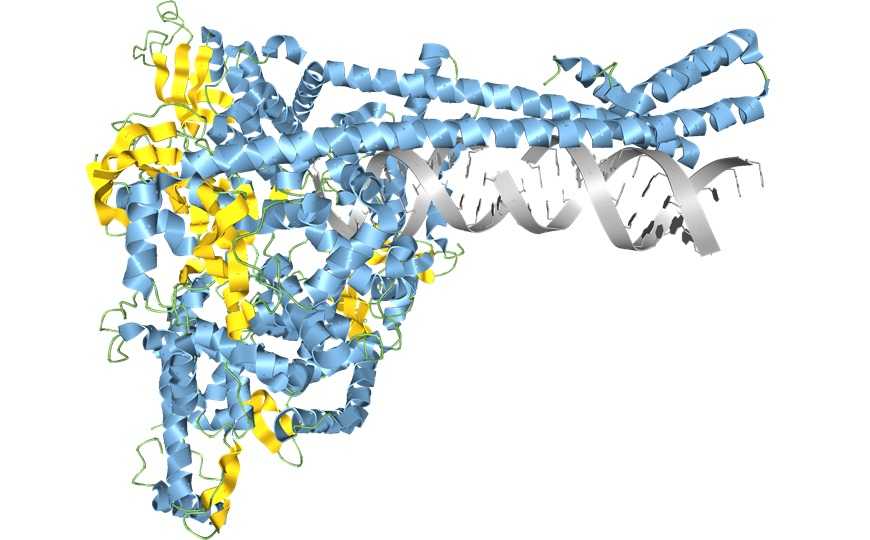 Модель РНК-синтезирующего комплекса SARS-CoV-2, построенная с помощью программы Aquaria. Credit: Garvan Institute of Medical Research |
Пресс-релиз | CC BY
Модель РНК-синтезирующего комплекса SARS-CoV-2, построенная с помощью программы Aquaria. Credit: Garvan Institute of Medical Research |
Пресс-релиз | CC BY
Расширение генетического кода
Молекулярные биологи создают все новые системы ортогональной трансляции белков, то есть такой, которая отличается от канонической, с 64 триплетными кодонами. Ученые из США получили набор тРНК с квадруплетными антикодонами (из четырех нуклеотидов, а не из трех) на основе тРНК Escherichia coli. Квадруплетные кодоны способны кодировать до 255 уникальных аминокислот. Ожидается, что это позволит получать белки, более тонко подстроенные под исследовательские и прикладные задачи. А британские ученые применили ортогональную трансляцию в живой клетке — заставили кишечную палочку синтезировать белок, содержащий сразу четыре неканонические аминокислоты. Это первый пример использования in vivo генетического кода с 68 кодонами, в том числе квадруплетныыми.
Синтетические клетки и биороботы
Стала ближе давняя мечта человечества о конструировании живой клетки с нуля. Пять лет назад в Институте Крейга Вентера получили синтетические клетки JCVI-syn3.0 на основе бактерий Mycoplasma mycoides, обладающие минимальным геномом (473 гена). Однако у этих клеток были проблемы с неравномерным делением. В этом году исследователи из Института Крейга Вентера и коллабораторы выявили семь генов, которые восстанавливают нормальное деление и морфологию синтетических клеток.
Роботостроение в наше время достигло небывалых высот. Но что насчет биороботов? В прошлом году американские исследователи сообщили о создании роботов из живых клеток. Точнее, ксеноботов: авторы сделали их из плюрипотентных стволовых клеток эмбрионов шпорцевых лягушек Xenopus laevis — отсюда и название. В этом году ксеноботы научились воспроизводить сами себя.
Если заставить отдельные клетки-предшественники эпидермиса лягушки контактировать в физрастворе, то через несколько дней они образуют сфероид из эпидермиса, покрытого реснитчатым эпителием. Благодаря ресничкам он может перемещаться. Если же поместить несколько ксеноботов в раствор со свободными стволовыми клетками, то, совершая хаотичные движения, биороботы соберут одиночные клетки в комки, из которых сформируются точно такие же организмы. С помощью искусственного интеллекта ученые создали ксенобота с формой, идеальной для саморепликации. Это оказалась форма Пакмана из одноименной видеоигры. Авторы надеются, что подобных биороботов можно будет использовать для решения задач регенеративной медицины, разработки лекарств и т.д.
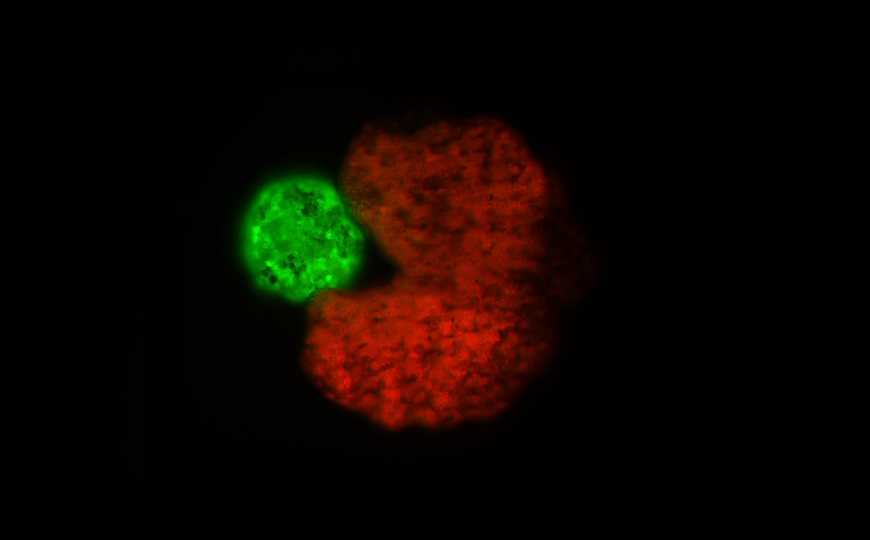 Организм-предшественник (красный) собирает стволовые клетки в агрегат (зеленый). Credit: Douglas Blackiston and Sam Kriegman |
Пресс-релиз
Организм-предшественник (красный) собирает стволовые клетки в агрегат (зеленый). Credit: Douglas Blackiston and Sam Kriegman |
Пресс-релиз
Модели эмбрионов
Для изучения раннего развития человека нужны эмбрионы, но эксперименты на человеческих эмбрионах сопряжены с моральными и правовыми проблемами. В этом году было предложено несколько этически приемлемых решений.
Ученые из США и Великобритании разработали протокол для создания подобных эмбрионам структур из плюрипотентных стволовых клеток человека. Они обладают некоторыми чертами эмбрионов с третьего по девятый-десятый день развития, экспрессируют многие характерные для этой стадии гены. Сразу две группы получили бластоиды — трехмерные структуры, напоминающие бластоцисты — из эмбриональных и индуцированных плюрипотентных стволовых клеток человека. При культивировании на плашках бластоиды имитировали процессы, происходящие во время имплантации.
Эмбрионы будут нужны и для выращивания донорских органов и тканей в теле животных. Исследователи из Китая и США сделали химерные эмбрионы из плюрипотентных стволовых клеток человека и шестидневных эмбрионов макаки-крабоеда и выращивали их ex vivo до 20 дней. Скорость развития химерных зародышей была намного ниже, чем нормальных эмбрионов обезьян. Тем не менее клетки человека в них дифференцировались в различные типы эмбриональных клеток.
Чтобы исследовать более поздние стадии развития эмбриона, подходят только зародыши животных. Тут уже проблема состоит в том, чтобы поддержать жизнь эмбриона вне матки как можно дольше. Ученые из Израиля создали систему, которая позволяет выращивать мышиные зародыши ex utero до образования задних лапок.
Редактирование геномов
Великобритания упрощает регуляцию исследований по созданию генетически отредактированных сельхозкультур. (При редактировании, в отличие от генной модификации, в геном не вставляются участки ДНК других видов.) Процедура будет больше похожа на регуляцию новых сортов, полученных методами традиционной селекции. Исследователям больше не нужно будет получать лицензию для полевых испытаний, достаточно будет уведомить Департамент окружающей среды, продовольствия и сельского хозяйства.
В Японии началась продажа томата с отредактированным геномом, который содержит в пять раз больше гамма-аминомасляной кислоты (ГАМК), чем обычные сорта. Он был разработан компанией Sanatech Seed из Токио. Это первый в Японии продукт с отредактированным геномом, который попал на стол потребителю. А вторым стал красный морской лещ, у которого на 50% увеличена мышечная масса за счет сайленсинга гена миостатина.
Обсуждается возможность редактирования генома кур для предотвращения эпидемий. Помимо убытков для птицеводства, есть опасность перехода вирусов от домашних птиц к человеку: пандемия COVID-19 заставила относиться серьезно к такой перспективе.
А биоэтики призывают не забывать о благополучии животных и опасаются, что вместо улучшения условий содержания скота и птицы будут «улучшать» самих животных, чтобы повысить толерантность к плохим условиям.
Судебные процессы
В октябре 2021 года семья Генриетты Лакс подала в суд на компанию Thermo Fisher Scientific за массовое производство и продажу клеток HeLa. Линия HeLa происходит от клеток рака шейки матки, взятых около 70 лет назад у Генриетты Лакс врачом госпиталя Джонса Хопкинса без согласия пациентки. Бен Крамп, адвокат семьи Лакс, заявляет, что это пример нарушения прав чернокожих граждан США. Он обвиняет компанию Thermo Fisher Scientific в присвоении генетического материала госпожи Лакс для собственной финансовой выгоды без оплаты, разрешения или одобрения со стороны семьи. Эксплуатацию Генриетты Лакс признала ВОЗ и присудила ей посмертно награду за вклад в науку.
В этом году разрешилось другое громкое дело — Illumina против китайской компании BGI в США. Спор о нарушении патентных прав разгорелся вокруг химии для секвенирования StandardMPS и CoolMPS, разработанной BGI. В сентябре федеральный суд США постановил, что химия для секвенирования StandardMPS и CoolMPS нарушает несколько патентов Illumina. Была объявлена сумма компенсации: BGI должна выплатить Illumina $8 млн. Эксперты считают, что выигранное дело укрепит позиции Illumina на рынке США. Но один из патентов Illumina был признан недействительным, и это, возможно, позволит BGI начать продажи химии CoolMPS в США к августу 2022 года.
Древняя ДНК из почвы
В Институте эволюционной антропологии Макса Планка разработали методы анализа ядерной ДНК человека из образцов, которые намного проще найти, чем кости и зубы древних людей, — из почвы. Международная команда ученых секвенировала ДНК из грунта знаменитых «неандертальских» пещер, включая Денисову на Алтае. Работа о митохондриальной ДНК (мтДНК) неандертальцев и денисовцев из отложений эпохи плейстоцена была опубликована еще в 2017 году. Однако ядерная ДНК содержит гораздо больше информации. Самое удивительное, что ДНК из почвы может быть индивидуальной, а не только характеризовать популяцию. Ядерная ДНК из образцов Денисовой пещеры (как мы помним, там нашли косточку дочери неандерталки и денисовца) принадлежала или неандертальцам, или денисовцам, смешанных образцов не нашли.
Затем исследователи древней ДНК порадовали еще одной работой, целиком посвященной мтДНК людей и животных из почвы Денисовой пещеры. Теперь известно, что денисовцы жили там с 250 тысяч до 60 тысяч лет назад и стали первыми мастерами орудий в этой местности, а неандертальцы — от 200 тысяч до 40 тысяч лет назад, причем некоторое время пещеру занимали только они — денисовцы исчезли, потом вернулись. Первые современные люди пришли туда намного позднее, когда последние денисовцы и неандертальцы уже сходили со сцены.
 Сбор образцов отложений в Главной камере Денисовой пещеры. Credit: Richard G. Roberts |
Пресс-релиз
Сбор образцов отложений в Главной камере Денисовой пещеры. Credit: Richard G. Roberts |
Пресс-релиз


 Меню
Меню





 Все темы
Все темы




 0
0








