Нобелевская премия за пси-опыты с иммунной системой
Нобелевский комитет объявил о присуждении премии по физиологии или медицине 2023 года Каталин Карико и Дрю Вайсману «за открытия, касающиеся модификаций нуклеозидных оснований, которые позволили разработать эффективные мРНК-вакцины против COVID-19». Речь идет прежде всего о превращении уридина в составе РНК в псевдоуридин (ψ): эта модификация повышает стабильность мРНК и экспрессию белка, который она кодирует.
«Как выяснилось благодаря коронавирусу, мРНК-вакцины работают. Вместо белка-антигена или его гена в вирусном векторе можно вводить в организм матричную РНК в липидных наночастицах, и всё получается: антиген вырабатывается в организме, развивается полноценный иммунный ответ (…) Работа [Дрю] Вайсмана и его коллеги Каталин Карико, опубликованная в 2005 году, помогла создать мРНК-вакцины против коронавируса: именно они предложили модифицировать мРНК, чтобы уменьшить ее разрушение в организме. Вайсман и Карико в последние два года уже получили множество научных наград, возможно, их список пополнит и Нобелевская премия», — написали мы, подводя итоги 2021 года в медицине и биологии. Однако мы не ожидали, что это произойдет так скоро.
Вакцинация формирует иммунный ответ на возбудитель и защищает организм от инфекции при встрече с этим патогеном или обеспечивает более легкое протекание болезни. Вакцины на основе убитых или ослабленных патогенов имеют долгую историю, достаточно вспомнить борьбу человечества с оспой. Методы современной молекулярной биологии и биотехнологии позволили получать в промышленных количествах отдельные вирусные белки; такие белки содержат, например, вакцины против вируса гепатита В и вируса папилломы человека. В последние десятилетия появились вакцины на основе вирусных векторов — специально сконструированных безвредных вирусов, содержащих в своем геноме гены белков патогена-мишени. Этот метод используется в вакцинах против вируса Эбола; еще один пример — российская вакцина против COVID-19 «Спутник V». Вектор проникает в клетку, и она начинает вырабатывать вирусный белок, стимулирующий иммунный ответ.
Производство цельновирионных и векторных вакцин требует промышленного культивирования клеток. Это дорогостоящий процесс, и по техническим и регуляторным причинам его сложно запустить быстро. Технология вакцин, независимая от клеточной культуры, выглядела привлекательной целью, и одним из основных направлений представлялись вакцины на основе матричной РНК (мРНК) — молекул РНК, которые используются в качестве матриц для производства белка.
Методы продукции мРНК вне клеток (in vitro транскрипции) появились еще в 1980-е годы. Однако транскрибируемая in vitro РНК была нестабильной в организме и вызывала воспалительные реакции — так же как бактериальная и митохондриальная мРНК. Это ограничивало энтузиазм разработчиков вакцин; многие считали более жизнеспособной альтернативой ДНК-вакцины.
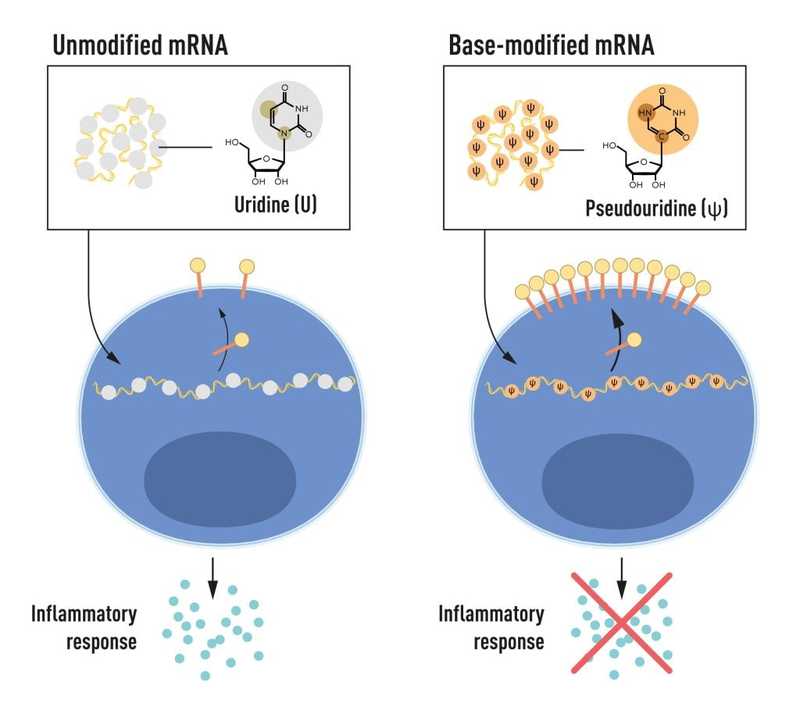
Биохимик венгерского происхождения Каталин Карико родилась в 1955 году в городе Сольноке, получила PhD в Сегедском университете. В 1989 году она начала работать в Пенсильванском университете, где ее коллегой стал иммунолог Дрю Вайсман. Его интересовали дендритные клетки, которые играют важную роль в реакции на вакцины. Вдвоем они начали исследовать взаимодействия различных типов РНК с иммунной системой. Карико и Вайсман заметили, что дендритные клетки реагируют на мРНК, транскрибируемую in vitro, как на молекулу патогена, — активируются и высвобождают медиаторы воспаления. При этом собственные мРНК организма такой реакции, естественно, не вызывают.
РНК содержит четыре основания — A, U, G и C, соответствующие A, T, G и C в ДНК. Азотистые основания в РНК из клеток млекопитающих часто химически модифицируются, тогда как в системе для транскрипции in vitro такая модификация не проводится. Карико и Вайсман создали варианты мРНК, по-разному модифицированные, и «предложили» их дендритным клеткам. Оказалось, что если немодифицированная РНК взаимодействует с Толл-подобными рецепторами дендритных клеток, то включение в ее состав модифицированных нуклеозидов — метилированных m5C, m6A, m5U или изомера уридина s2U (псевдоуридина, или ψ) — снижает активность рецепторов. Эти результаты были опубликованы в 2005 году — за пятнадцать лет до COVID-19.
Карико и Вайсман понимали, что это может стать огромным шагом к терапевтическому использованию РНК. В публикациях 2008 и 2010 гг. они показали, что замена уридинов на псевдоуридины в мРНК увеличивает не только ее стабильность, но и продукцию белка. (Немодифицированная мРНК охотнее взаимодействует с РНК-зависимой протеинкиназой PKR, которая фосфорилирует фактор инициации трансляции 2-альфа (eIF-2α) и в конечном итоге снижает эффективность трансляции.) Модификации РНК дают и другие преимущества.
 Credit: Нобелевский комитет по физиологии и медицине | Mattias Karlén
Credit: Нобелевский комитет по физиологии и медицине | Mattias Karlén
Интерес к технологии мРНК начал возрастать, и в 2010 году уже несколько компаний работали над вакцинами. Среди ранних разработок были вакцины против вируса Зика и коронавируса MERS-CoV. А во время пандемии COVID-19 с рекордной скоростью были созданы две мРНК-вакцины, содержащие псевдоуридин (точнее, N-метилпсевдоуридин — псевдоуридин с дополнительной СН3-группой). (Вспоминаем, как основные вакцины проходили этап за этапом.)
Инновационные продукты принадлежали компаниям Moderna и Pfizer (разработка компании BioNTech RNA Pharmaceuticals, в которой Каталин Карико занимала должности вице-президента, а затем старшего вице-президента). мРНК в составе вакцин кодировали поверхностный S-белок SARS-CoV-2. Для доставки использовали липидные наночастицы (и эта технология теперь становится предметом судебных споров). Защитный эффект против «уханьского» штамма, по результатам клинических исследований, составлял около 95%, и обе вакцины были одобрены еще в декабре 2020 года.
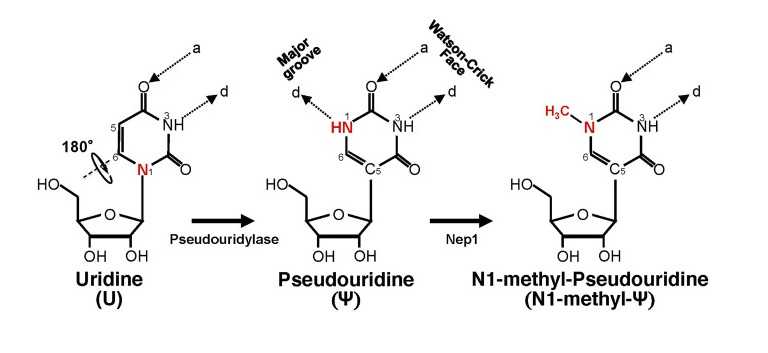 Изомеризация U в псевдоуридин Ψ и дополнительное метилирование псевдоуридина по N1 (N-метилпсевдоуридин). Credit: Front Cell Dev Biol. 2021; 9: 789427. DOI:
10.3389/fcell.2021.789427 | CC BY
Изомеризация U в псевдоуридин Ψ и дополнительное метилирование псевдоуридина по N1 (N-метилпсевдоуридин). Credit: Front Cell Dev Biol. 2021; 9: 789427. DOI:
10.3389/fcell.2021.789427 | CC BY
Действительно, модификации РНК были одним из ключевых факторов успеха: вакцина компании CureVac, содержащая немодифицированную РНК, потерпела крах (подробнее на PCR.NEWS).
Пандемия показала, насколько важны быстрая разработка вакцин к новому патогену и возможность легко изменять их состав с появлением новых штаммов. Сейчас исследуются вакцины на основе мРНК против ВПЧ, вирусов гриппа, ВИЧ, малярии, болезни Лайма и других инфекционных заболеваний. Возможно, появятся мРНК-вакцины, вызывающие иммунный ответ против опухолей, а также мРНК-препараты для доставки терапевтических белков.
В общей сложности во всем мире было введено более 13 миллиардов доз различных вакцин против COVID-19. Вакцины спасли миллионы жизней и предотвратили тяжелые заболевания у многих других людей, позволили отказаться от жестких карантинных мер. Преодолению крупнейшего кризиса в области здравоохранения последних десятилетий во многом способствовали нобелиаты 2023 года, которые верили в мРНК-вакцины, когда не верил еще никто.
Источник
Press release. NobelPrize.org. Nobel Prize Outreach AB 2023. Mon. 2 Oct 2023.


 Меню
Меню





 Все темы
Все темы




 0
0







