Итоги-2024. Ленакапавир против ВИЧ и Нобелевская премия за структуры белков
Подводим итоги года, вспоминаем наши самые интересные публикации. Картирование человека на клеточном уровне, лекарство, которое вводится раз в полгода и надежно защищает от ВИЧ-инфекции, клеточная терапия солидных опухолей, коммуникация органоидов мозга, новая органелла эукариот, изучение космических туристов, а также мпокс в Африке и высокопатогенный птичий грипп в США.

Клеточная карта человеческого тела
«Google Maps человеческого тела», периодическая таблица клеток или клеточная Википедия — такие метафоры используют, говоря о клеточном атласе человеческого тела. Его черновик — первый масштабный результат восьмилетней работы консорциума Human Cell Atlas. Проект зародился в 2016 году; тогда в него вступили около 130 ученых, сейчас их более 3 600.
В журналах Nature Portfolio опубликована подборка статей, посвященных трем ключевым задачам консорциума — картированию тканей взрослого человека (как в норме, так и при различных патологиях), созданию атласа развивающегося организма и разработке новых инструментов анализа. Их авторы опирались на различные омиксные технологии, в первую очередь на транскриптомику единичных клеток.
Исследовательские группы, работавшие над атласами отдельных тканей и органов, продемонстрировали некоторые возможные применения своих разработок. С их помощью охарактеризовали старение скелетных мышц, исследовали, как развивается пренатальная кожа, показали отличия нейральных органоидов от эмбрионального мозга и установили, что тимус формируется у плода уже на 12-й неделе.
На сегодняшний день участники консорциума собрали три атласа — легких, нервной системы и глаз. Еще 15 атласов находятся в разработке и дополняются, по завершении всех 18 ученые планируют свести их в единую сеть.
Исследователи, работающие над проектом, подчеркивают: чтобы внести как можно больший вклад в понимание того, как развивается и работает человеческое тело, клеточный атлас должен быть открытым ресурсом.
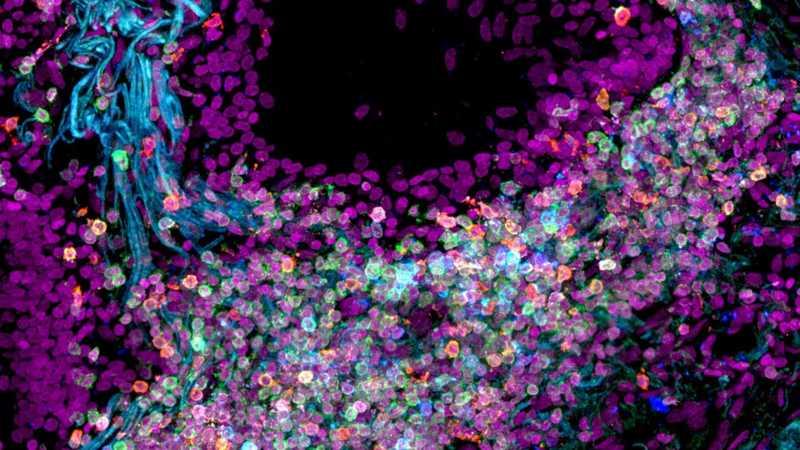 Ткань легких человека. Credit Nathan Richoz, University of Cambridge
Ткань легких человека. Credit Nathan Richoz, University of Cambridge
Нобелевские премии
Уходящий год богат достижениями вычислительной науки. Нобелевская премия за компьютерный дизайн и предсказание структуры белков — по химии, за машинное обучение и нейронные сети — по физике… И многие биологические или медицинские исследования без этих разработок были бы если не невозможны, то, по крайней мере, сильно затруднены.
Конечно, применение машинного обучения не ограничивается только биомедицинской сферой. Однако оно легло в основу того же предсказания структуры белковых молекул — и вот между Нобелями этого года по химии и физике вырисовывается тесная связь.
Джон Хопфилд и Джеффри Хинтон — лауреаты премии этого года по физике — получили награду «за основополагающие открытия и изобретения, обеспечивающие машинное обучение с помощью искусственных нейронных сетей».
Зачастую «искусственный интеллект» обозначает машинное обучение с применением искусственных нейронных сетей — аналоги нейронов мозга, которым и были вдохновлены эти структуры, представлены в них узлами разного веса. Одну из таких нейронных сетей, способную хранить и воссоздавать паттерны, изобрел в 1982 году Джон Хопфилд. «Физика — это точка зрения», — так выразился нобелевский лауреат, говоря о вдохновении, которое нашел в физических моделях и взаимодействии множества их компонентов, формирующем работу целой системы.
Опираясь на изобретение Хопфилда, Джеффри Хинтон создал машину Больцмана, принцип работы которой лег в различные классификаторы изображений и их элементов (сейчас они находят огромное применение в медицинской диагностике). Однако Хинтон выражает куда меньше энтузиазма по поводу бурного развития ИИ. Хотя он и признает, что нейронные сети зачастую моделируют человеческую интуицию, а не только взвешенные решения — и это один из способов повысить производительность, — он опасается, что слишком стремительный прогресс будет сопряжен с целым рядом рисков для человечества.
Фундаментальные достижения в разработке ИИ послужили более «биологическому» направлению, за которое Нобелевскую премию вручили уже по химии. Здесь приз разделили за два взаимодополняющих открытия — предсказание 3D-структуры белков по первичной последовательности и, наоборот, de novo конструирование белковых молекул с заданными свойствами.
AlphaFold — ИИ, созданный под руководством Демиса Хассабиса (сооснователь DeepMind), и вторая его версия, разработанная уже при участии Джона Джампера, — показали выдающиеся результаты в предсказании структуры белка на конкурсе CASP. Теперь эти модели (а также более позднюю версию AlphaFold 3, представленную в этом году), применяют для самых разных биологических задач — от анализа эволюции вирусов и их взаимодействия с хозяевами до изучения механизмов транскрипции, связанных с онкогенезом.
Дэвид Бейкер предложил в своей лекции целый ряд практических применений сконструированных «с нуля» белков — нейтрализация змеиных токсинов, регуляция иммунитета в ту или другую сторону, разработка терапевтических антител... Синтетические белки в перспективе способны как активировать работу иммунной системы, например, для борьбы с онкозаболеваниями, так и подавить чрезмерную активацию, свойственную аутоиммунным заболеваниям. Впрочем, вопрос потенциальной иммуногенности синтетических белков требует более тщательного изучения. А есть еще немедицинские применения — различные сенсоры, переключатели для биоэлектроники и даже искусственный фотосинтез.
 Дэвид Бейкер. Скриншот канала Нобелевского комитета
Дэвид Бейкер. Скриншот канала Нобелевского комитета
А Нобелевская премия по физиологии или медицине присуждена за открытие микроРНК. Виктор Эмброс и Гэри Равкан опубликовали в 1993 году статью, посвященную «странной» на тот момент РНК нематоды C. elegans, которая не кодировала белок, но влияла на активность другого гена. Сначала этот необычный регуляторный механизм привлек мало внимания, поскольку многие сочли его очередной особенностью беспозвоночного организма. Однако семь лет спустя, в 2000 году, небольшая некодирующая РНК была найдена уже в человеческих клетках и оказалась крайне консервативной. Сейчас очевидно, что посттранскрипционная регуляция генов с помощью микроРНК — это один из ключевых клеточных механизмов, необходимый и в норме, и при реакции на инфекцию или другую патологию. Нарушения его работы связаны с рядом заболеваний человека, включая рак.
Сочетание достижений, признанных в этом году Нобелевским комитетом, подтверждает слова Хассабиса о том, что ключом к их успеху стала мультидисциплинарность (тесная связь разных уровней познания: биологического, химического и т. д.).
 Демис Хассабис. Скриншот канала Нобелевского комитета
Демис Хассабис. Скриншот канала Нобелевского комитета
Ленакапавир
«Прорывом года» называют препарат против ВИЧ-инфекции Сунленка (ленакапавир) американской компании Gilead Sciences. После проникновения в цитоплазму вирусный геном и ферменты защищены конусообразным капсидом. Ленакапавир делает связи между молекулами капсидного белка сверхстабильными, но именно повышенная жесткость способствует его разрушению. Он также препятствует проникновению капсида в ядро и препятствует сборке вирионов. Это первый препарат против ВИЧ, который блокирует его репликацию, воздействуя на капсид.
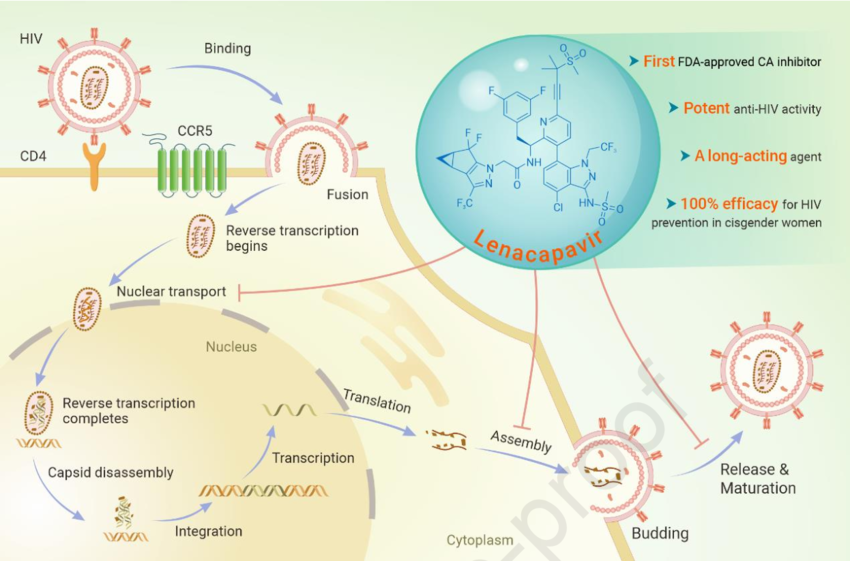 Credit: The Innovation. 2024. DOI:
10.1016/j.xinn.2024.100683 | OA
Credit: The Innovation. 2024. DOI:
10.1016/j.xinn.2024.100683 | OA
Важная особенность ленакапавира — пролонгированное действие; его нужно вводить подкожно лишь два раза в год (есть также пероральная форма). В 2023 году он был одобрен FDA для лечения ВИЧ с множественной лекарственной устойчивостью; через год после начала лечения у 83% пациентов вирусная нагрузка была ниже определяемого уровня. В 2022 году его одобрили регуляторы Евросоюза и Канады.
В этом году ленакапавир показал блестящие результаты как средство доконтактной профилактики (защиты неинфицированных людей от инфекции). В одном клиническом исследовании (КИ) он продемонстрировал 100%-ную эффективность, в другом — эффективность, близкую к 100%.
Стоимость ленакапавира высока (первый год лечения — 42 тысячи долларов, затем 39 тысяч долларов), а патент Gilead останется действительным еще почти 20 лет. В мае эксперты, ученые и знаменитости обратились в открытом письме к генеральному директору Gilead с просьбой позволить другим компаниям производить непатентованные версии: «Сейчас мир с ужасом и стыдом вспоминает, что потребовалось 10 лет и 12 миллионов жизней, прежде чем непатентованные версии антиретровирусных препаратов стали доступны во всем мире».
В октябре Gilead Sciences разрешила шести производителям лекарств из Азии и Северной Африки продавать дженерики ленакапавира для профилактики ВИЧ в 120 странах без выплат отчислений правообладателю. Продажи должны начаться с 2027 года. Однако разрешение не касается продаж в Бразилии, России, Колумбии, Мексике и Китае, на долю которых приходится около 20% новых случае заражения.
Терапевтическое редактирование РНК
Wave Life Sciences (США) сообщила об успешном терапевтическом редактировании РНК при дефиците альфа-1-антитрипсина (AAT). Этот белок защищает ткани от чрезмерной воспалительной реакции. У людей с дефицитом AAT легкие теряют эластичность, в печени, где вырабатывается АТТ, накапливается дефектная форма белка и развивается цирроз. Без лечения заболевание может быть смертельным.
Препарат WVE-006 от Wave Life Sciences вводится подкожно и содержит олигонуклеотид, комплементарный участку мРНК АТТ, в котором есть мутацию почти у 95% пациентов с тяжелыми формами болезни. Олигонуклеотид конъюгирован с N-ацетилгалактозамином (GalNAc), обеспечивающим доставку в клетки печени. Проникнув в клетку, он взаимодействует с мРНК, и в ней за счет естественных механизмов происходит замена аденозина на инозин (A-I). В ходе трансляции инозин в мРНК «считывается» рибосомой как гуанозин, и синтезируется нормальный белок.
Препарат получили два пациента с двумя дефектными копиями гена ATT. У обоих через 15 дней после одной дозы доля нормальной формы ААТ в крови превысила 60%.
Wave испытывает различные методы воздействия на мРНК — редактирование, управление сплайсингом, РНК-интерференцию, сайленсинг с помощью антисмысловых (антисенс) олигонуклеотидов. Среди разработок Wave, дошедших до КИ, помимо терапии дефицита ААТ, — препараты для лечения миодистрофии Дюшенна (WVE-N531, управление сплайсингом) и болезни Гентингтона (WVE-003, аллель-селективный сайленсинг). Препарат WVE-007 для терапии ожирения на основе РНК-интерференции находится на доклинической стадии.
На октябрь 2024 года одобрены шесть препаратов различных производителей на основе коротких интерферирующих РНК и 18 препаратов на основе антисмысловых (антисенс) олигонуклеотидов. В числе лидеров по разработке препаратов на основе РНК-интерференции — Alnylam Pharmaceuticals. Пример антисмысловой терапии — нусинерсен (Спинраза) для лечения СМА.
 Credit:
flickr.com | NIH
Credit:
flickr.com | NIH
Клеточная терапия
CAR T-терапия, нацеленная на клетки крови, уже не новость, но в этом году был ряд сообщений о клеточной терапии солидных (твердых) опухолей. В августе 2024 года получил ускоренное одобрение FDA препарат Тецелра компании Adaptimmune для лечения метастатической или неоперабельной синовиальной саркомы. Это первая новая терапия по данному показанию более чем за десять лет, первая на рынке терапия солидной опухоли с помощью генноинженерных клеток и первая терапия, использующая клетки с модифицированными Т-клеточными рецепторами (TCR). В феврале был одобрен препарат Амтагви от Iovance Biotherapeutics для терапии прогрессирующей меланомы, который содержит инфильтрирующие опухоль лимфоциты (TIL). Эти лимфоциты не модифицированы, и их получают из ткани опухоли пациента, а не из крови. Проводятся испытания TIL и против других солидных опухолей, например, метастатического колоректального рака.
AbelZeta Pharma (Китай) и AstraZeneca в июне представили на конгрессе Американского общества клинической онкологии (ASCO) CAR Т-клеточную терапию поздних стадий рака печени — C-CAR031, которая вызвала ответ у 50% больных.
Вот еще несколько интересных работ 2024 года. Созданы CAR Т-клетки, которые дистанционно «включаются» и «выключаются» с помощью малых молекул; исследователи научились управлять образованием CAR Т-клеток памяти в организме пациента; нашли способы увеличения периода активности CAR Т-клеток и их противораковой эффективности, а также новые подходы к CAR T-терапии солидных опухолей. Для повышения активности CAR T-клетки предложили «подзаряжать» митохондриями.
CAR T-клетки очищали организм мышей от сенесцентных клеток и продлевали их жизнь. Были созданы мезенхимальные стромальные клетки с CAR, CD19-специфичные CAR NK-клетки. Вышла статья о синтетических рецепторах SNIPR, которые могут контролировать активность CAR T-клеток и уменьшать побочные эффекты (один из авторов — нобелевский лауреат Дэвид Бейкер).
Исследуется риск вторичных новообразований, связанных с CAR T-терапией (к сожалению, он есть).
CAR T-терапия развивается и в России. Минздрав РФ выдал НМИЦ гематологии разрешение на проведение фазы 1-2 КИ первого отечественного клеточного генотерапевтического препарата Утжефра (гемагенлеклейцел) для терапии онкогематологических заболеваний, в том числе В-клеточных новообразований крови. Кроме того, Правительство РФ утвердило перечень из 18 федеральных научных институтов, которые будут производить препараты для CAR T-терапии.
Триумфы и проблемы семаглутида
В 2024 году выявили еще несколько преимуществ семаглутида — агониста рецепторов глюкагоноподобного пептида 1 (GLP-R1A), применяемого для лечения диабета и ожирения, но завершается год на тревожной ноте.
Анализ медицинских данных показал, что семаглутид в 2–3 раза снижает вероятность передозировки опиоидами. Риск неблагоприятных почечных исходов (диализ, трансплантация, смерть от почечных или сердечно-сосудистых причин) у принимавших препарат пациентов снизился на 24%, а риск тяжелых заболеваний печени при диабете — на 49%. Также прием препаратов этой группы ассоциирован со сниженным риском онкозаболеваний, связанных с ожирением (кроме рака почки). Семаглутид позволяет добиться долговременного снижения веса (четыре года по результатам одного исследования) Идет разработка формы препарата, которую можно будет вводить раз в месяц.
Стали появляться данные о том, что прием семаглутида может вызывать суицидальные мысли, однако сведения не подтвердились в другом исследовании. Но другое осложнение, по-видимому, подтверждается.
Сначала ученые из США показали в небольшом исследовании, что семаглутид ассоциирован с повышением риска NAION — состояния, когда кровь перестает поступать к оптическому нерву, что приводит к необратимой потере зрения. Потом эти выводы подтвердили исследователи из Дании и Норвегии. Среди людей с диабетом, принимавших семаглутид, риск NAION был выше почти в три раза по сравнению с принимавшими другие препараты от диабета. Так, в Дании среднегодовое число случаев NAION увеличилось с 67,6 до 148,0 после появления на рынке Оземпика в 2018 году. И да, NAION остается редким состоянием (единичные случаи на 10 000 человеко-лет), но этот риск все же необходимо учитывать.
Вспышка мпокс (оспы обезьян) в Африке
Оспа обезьян (ВОЗ рекомендует называть ее «мпокс», чтобы не стигматизировать больных и не вносить путаницы: наиболее частые хозяева вируса — грызуны и другие мелкие млекопитающие) впервые диагностирована у человека в 1970 году. Но в последнее десятилетие число случаев растет из-за глобализации и снижения популяционного иммунитета против натуральной оспы, защищающего от мпокс, а также, возможно, из-за появления новых штаммов.
В 2022–2023 гг. вспышка мпокс охватила весь мир. В июне 2022 года ВОЗ объявила ее чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение. В 2023 году новая вспышка началась в Демократической Республике Конго (ДРК), распространилась на другие страны Африки, и 14 августа 2024 года ВОЗ снова объявила чрезвычайную ситуацию. Отмечены случаи за пределами Африки, в том числе в Швеции, США, Канаде.
Вирус оспы обезьян (MPXV) включает три клады — I, IIa и IIb. Вспышка 2022 года была вызвана штаммами клады IIb, в 2024 году распространяется клада I, вызывающая более тяжелое заболевание. С 1 января по 8 сентября 2024 года в Африке было зарегистрировано 25 093 случая (хотя не все из них подтверждены лабораторно) и 723 летальных исхода, или почти 3%. Большая часть случаев была зарегистрировано в ДРК (21 835 предполагаемых случаев, 717 смертей).
Противовирусный препарат тековиримат, на который возлагали большие надежды, не сократил продолжительность симптомов среди пациентов, зараженных штаммами клады I, и не снизил смертность. Противооспенная вакцина MVA-BN защищает от мпокс, однако даже тех, кто был вакцинирован в 2022 году, сейчас необходимо ревакцинировать. Moderna и BioNTech разрабатывают мРНК-вакцины против мпокс, они уже вошли в КИ.
Подробно на русском языке о диагностике, лечении и профилактике мпокс можно почитать здесь.
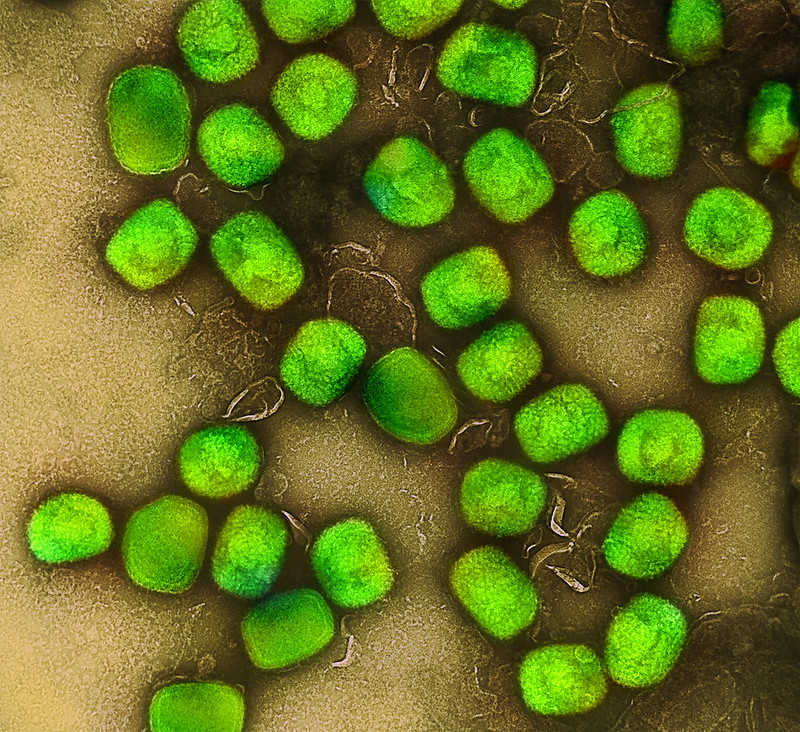 Вирус мпокс. Credit: flickr.com | NIAID
Вирус мпокс. Credit: flickr.com | NIAID
Вирус H5N1 у коров и людей
H5N1 (также высокопатогенный птичий грипп) — серотип вируса гриппа A/goose/Guangdong/1/1996 — в 2024 году продолжает привлекать внимание специалистов и администраторов здравоохранения. В марте вирус H5N1 (кладу 2.3.4.4b) впервые выявили у молочных коров на фермах Канзаса и Техаса (США). Уже 1 апреля от коров заразился первый человек, в мае — второй и третий. Тогда же вирус инфицировал альпак, находившихся в контакте с зараженной птицей.
В настоящий момент зарегистрировано более 60 случаев заражения человека в США, в том числе один серьезный случай в Луизиане, приведший к госпитализации. В Калифорнии объявлено чрезвычайное положение, что поможет проводить тестирование и другие меры по сдерживанию распространения инфекции.
В 2024 году были инфицированы южные глупыши, чернобровые альбатросы, бурые поморники, доминиканские чайки, а также два вида млекопитающих — южный морской слон и кергеленский морской котик — на островах Южной Георгии и Фолклендских островах (Антарктика).
Ученые многое узнали об H5N1. Так, заражение может происходить через непастеризованное молоко. Вероятно, работники фермы заражаются при доении, по крайней мере, вирус способен сохраняться в течение трех часов в каплях молока на рабочих металлических и пластиковых поверхностях в доильных залах. В экспериментах на мышах и хорьках было показано, что H5N1 поражает глаза, молочные железы и другие органы и в ограниченных масштабах может распространяться воздушно-капельным путем.
Вирус из мазка, полученного от зараженного человека (A/Texas/37/2024, или huTX37-H5N1), оказался родственным вирусам, выделенным от коров, однако в его геноме была обнаружена мутация в гене белка PB2, приводящая к замене аминокислоты, — PB2-E627K. Это хорошо известный маркер адаптации вируса гриппа к млекопитающим. Замена, в частности, увеличивает активность вирусной полимеразы в человеческих клетках. Этот вирус не только может реплицироваться в клетках дыхательных путей человека, но и летален для мышей и хорьков. Зафиксирована респираторная передача вируса у хорьков, которой не происходило в экспериментах с выделенными от коров штаммами.
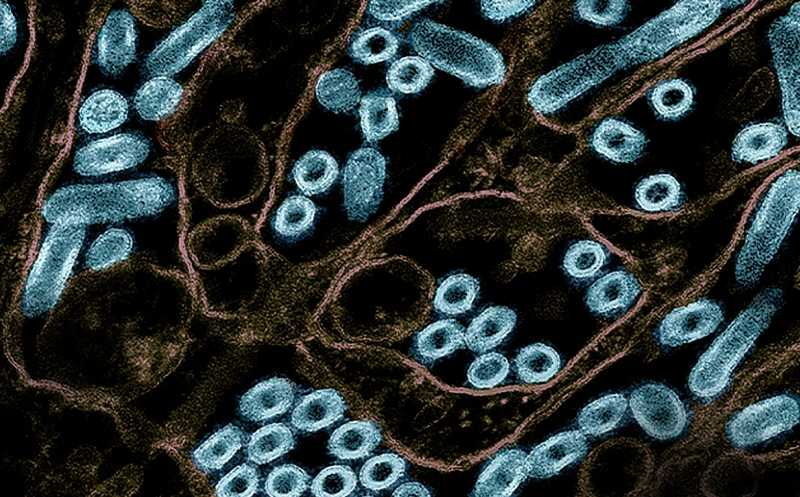 Частицы вируса птичьего гриппа A H5N1, выращенные в эпителиальных клетках почек собак (MDCK). Credit: CDC | NIAID | Пресс-релиз
Частицы вируса птичьего гриппа A H5N1, выращенные в эпителиальных клетках почек собак (MDCK). Credit: CDC | NIAID | Пресс-релиз
Бионические протезы: чувствительность и точность
Современные бионические протезы ног на роботизированном управлении имитируют естественное передвижение. Однако, чтобы они обладали такой же тонкой координацией, как нога человека, они должны управляться не внешними контроллерами, а нервной системой самого пациента. Это, в свою очередь, затруднено тем, что значительная часть мышц и нервов, в частности, афферентных волокон, утрачена.
Компенсировать отсутствие периферических нервов можно с помощью электрической стимуляции — как имплантированными, так и поверхностными электродами. Оба этих варианта применили создатели протезов ног.
Один из подходов заключался в создании протеза нижней конечности с «чувствительной» подошвой — конструкция, снабженная датчиками давления, передавала сигнал в нервную систему пациента. Чтобы сделать передаваемые ощущения реалистичными, перед разработкой протеза авторы смоделировали пространственно-временную динамику сигналов. В итоге правдоподобные тактильные ощущения помогли трем пациентам с такими протезами координировать движения и лучше маневрировать, а также снижали лишнюю умственную нагрузку во время ходьбы.
В другом клиническом исследовании бионические протезы ног совмещали с нервно-мышечным интерфейсом между оставшимися мышцами. Пациентам, у которых нога была ампутирована ниже колена, механически соединяли мышцы — агонисты и антагонисты. Их попеременное натяжение при ходьбе считывали с помощью электромиографии, а полученные сигналы подавали на вход контроллеру нейропротеза. Электромиографические сигналы от икроножной и большеберцовой мышц восстановили естественную проприоцепцию и тем самым повысили симметричность движений (здоровую ногу сравнивали с протезом). Пациенты с такими протезами ходили быстрее и управляли точными движениями лучше, чем носители протезов с заранее программируемым контроллером.
 Нейропротез, реагирующий на сигналы от соединенных мышц. Credit: Nature Medicine. 2024. DOI: 10.1038/s41591-024-02994-9 | CC BY 4.0
Нейропротез, реагирующий на сигналы от соединенных мышц. Credit: Nature Medicine. 2024. DOI: 10.1038/s41591-024-02994-9 | CC BY 4.0
«Эволюция» органоида мозга как экспериментальной модели
Что можно сделать с органоидом мозга? На этот вопрос появились новые ответы.
По аналогии с развивающимся мозгом, который они моделируют, органоиды постепенно усложняются со временем. К примеру, исследователи из США ускорили созревание астроцитов, чтобы включить их в кортикальный органоид и сделать его структуру более приближенной к настоящему кортексу.
Не ушла от внимания ученых и нейропластичность — два органоида, соединенные пучком аксонов, начинают координировать свою активность. Кроме того, нейроны в них созревают лучше и демонстрируют кратковременную потенциацию (хотя к долговременной, как выяснилось, они пока не способны).
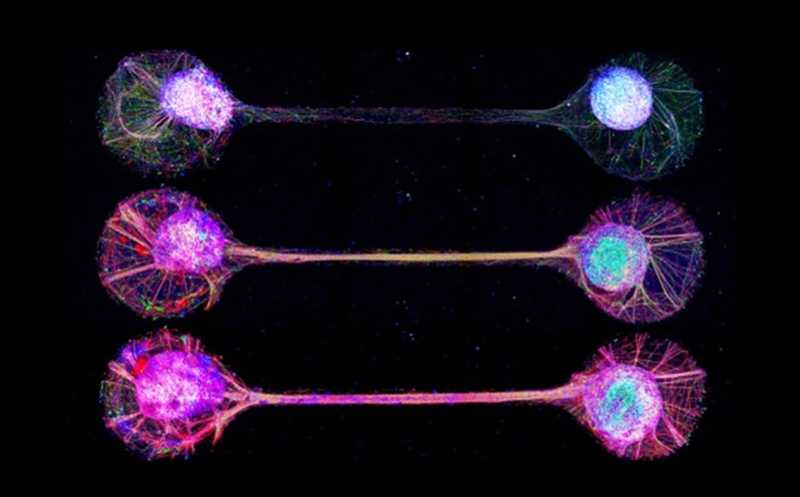 Органоиды мозга, соединенные пучками аксонов. Credit: Institute of Industrial Science, The University of Tokyo
Органоиды мозга, соединенные пучками аксонов. Credit: Institute of Industrial Science, The University of Tokyo
Еще вариант усложнения структуры нейрального органоида — формирование нервной трубки — позволил смоделировать раннее развитие ЦНС. Выращенный на микрофлюидном чипе органоид соответствовал эмбриональному зачатку ЦНС на транскриптомном и клеточном уровне, обеспечивая возможность детально исследовать на нем ранний нейрогенез.
Химероиды — это органоиды мозга, клетки для выращивания которых были получены от разных людей. Такая необычная модель позволяет проводить опыты на материале нескольких доноров сразу, снижая тем самым погрешность эксперимента. Кроме того, она наглядно демонстрирует, как межиндивидуальные генетические различия меняют ответ на то или иное воздействие.
Наконец, на органоиды мозга обратили внимание биоэтики. В начале года они опубликовали статью, в которой рассуждают о возможности формирования у органоидов сознания. (Здесь, конечно, следует начать с вопроса «что такое сознание?», однако и ему авторы публикации уделили внимание.) Хотя пока специалисты убеждены, что сознание в органоиде зародиться не может, они оговариваются: «по крайней мере, на данном этапе». Они предлагают в дальнейшем устанавливать те же границы этичности, что и для экспериментов на животных, если у органоидов все же будет обнаружен сопоставимый уровень проявлений сознания.
Новая органелла эукариот — нитропласт
Считалось, что способность фиксировать атмосферный азот характерна только для прокариот. Но в апреле 2024 года вышла работа, авторы которой нашли органеллу, фиксирующую азот — нитропласт — у одноклеточной водоросли Braarudosphaera bigelowii. Нитропласт, как и митохондрии или хлоропласты, образовался в результате эндосимбиоза.
 Клетка Braarudosphaera bigelowii в «панцире» из 12 известковых пластинок. Credit: Wikimedia CC 4.0
Клетка Braarudosphaera bigelowii в «панцире» из 12 известковых пластинок. Credit: Wikimedia CC 4.0
Водоросли, внутри которых присутствуют азотфиксирующие эндосимбионты, были известны и ранее. Но только в этом году было показано, что азотфиксирующая цианобактерия Candidatus Atelocyanobacterium thalassa, или UCYN-A, достаточно тесно связана с B. bigelowii, чтобы считаться органеллой, а не просто симбионтом. UCYN-A всегда находится в задней части клетки своего хозяина между двумя хлоропластами. Она неспособна к фотосинтезу, поскольку утратила необходимые гены, зато имеет полный набор генов nif, необходимых для фиксации азота. В целом геном UCYN-A значительно короче такового у свободноживущих цианобактерий
Атмосферный азот, фиксируемый UCYN-A, передается B. bigelowii, которая, в свою очередь, фиксирует CO2 и обеспечивает UCYN-A необходимыми метаболитами. На одну клетку B. bigelowii приходится только одна UCYN-A, деление органеллы и хозяина скоординированы. UCYN-A занимает 8,6% объема водоросли. Митохондриальная сеть окутывает ее почти полностью, отделяя от ядра, и, возможно, снабжает АТФ для фиксации азота.
UCYN-A содержат 1804 различных белка, из которых большая часть закодирована в геноме B. bigelowii. Так, у UCYN-A нет генов, необходимых для биосинтеза многих аминокислот, нуклеотидов, витаминов и кофакторов. Более того, некоторые из импортируемых белков предназначены для нейтрализации активных форм кислорода и азота, которые часто появляются при азотфиксации.
Космическая биология
В 2021 году состоялась первая гражданская космическая миссия Inspiration4: четыре человека, не являвшиеся представителями государственных агентств, пробыли три дня на околоземной орбите на борту корабля Crew Dragon компании SpaceX. Данные, собранные в ходе миссии, легли в основу Space Omics and Medical Atlas (SOMA). Ученые исследовали геномы, микробиомы, транскриптомы и протеомы космических путешественников. По результатам работы в 2024 году вышло более 40 статей в журналах группы Nature.
До этого момента изучалось только состояние относительно молодых и здоровых людей, прошедших специальную подготовку перед полетом. К тому же Crew Dragon вышел на орбиту на высоте 585 км, — выше, чем МКС, то есть его команда подвергалась более интенсивному действию космической радиации.
У космических туристов были обнаружены неблагоприятные признаки, аналогичные тем, что наблюдаются у профессиональных астронавтов: стрессовые изменения хроматина моноцитов и транскриптома иммунных клеток, ассоциированное с повышенным риском рака удлинение теломер. Микрогравитация слабее действовала на зрение женщин, а их моноциты быстрее восстанавливались. Но риски сердечно-сосудистых и онкологических заболеваний у них были выше. Впрочем, данных о влиянии космических перелетов на здоровье женщин до сих пор мало.
На МКС тоже продолжаются исследования. Одно из самых интересных показало, что у астронавтов повышен риск образования камней в почках. Ранее уже было известно, что через год после возвращения из космоса риск появления камней у астронавтов повышается в 2–7 раз. В работе 2024 года анализировали клинические данные 66 астронавтов, которые пробыли на МКС до 180 дней. Во время полета у них увеличилось выделение кальция, оксалата, фосфата и мочевой кислоты с мочой, а общий объем мочи снизился — это повышает риск образования камней. Авторы разобрали молекулярные механизмы, которые могут лежать в основе этих изменений. Симуляция воздействия космического излучения позволила предположить, что почки астронавтов могут не выдержать путешествия на Марс и обратно. Эту проблему придется решить перед планированием дальних пилотируемых миссий.
Исследование на органоидах сердца, находящихся на МКС в течение 30 дней, показало, что сердечная мышца стала хуже сокращаться, у органоидов развилась аритмия. Работа митохондрий нарушилась, в кардиомиоцитах зафиксировали окислительный стресс и воспаление. А нейроны органоидов мозга в космосе созревали намного быстрее, чем на Земле.


 Меню
Меню





 Все темы
Все темы
 Credit: Nature. 2024. DOI:
Credit: Nature. 2024. DOI:




 0
0







