Итоги-2022. Древняя ДНК и генная терапия
Вспоминаем главные события 2022 года в биологии и медицине: Нобелевская премия Сванте Паабо, новые (и очень дорогостоящие) препараты для генной терапии, новые вакцины, эболавирус в Уганде, оспа обезьян. А еще партеногенетическая мышь и бактерия сантиметровой длины.

Нобелевская премия
Нобелевскую премию по физиологии или медицине 2022 года получил Сванте Паабо «за его открытия, касающиеся геномов вымерших гоминин и эволюции человека». Паабо с коллегами разработал технологии выделения и секвенирования ДНК из образцов, возраст которых исчисляется десятками тысяч лет. В 1997 году они сообщили о прочтении митохондриальной ДНК неандертальца. Первый миллион нуклеотидов ядерного генома неандертальца был прочтен в 2006 году, а в 2010 году Сванте Паабо и его сотрудники опубликовали первую полную последовательность. Наряду с секвенированием по Сэнгеру они использовали одну из ранних технологий высокопроизводительного секвенирования — пиросеквенирование от компании 454 Life Sciences, которую позднее купила Roche. В том же 2010 году вышла статья о третьем виде человека — денисовце. А в 2018 году был прочитан геном Денни, дочери неандерталки и денисовца. Следы гибридизации с неандертальцами и денисовцами найдены и в геномах людей современного типа.
 Credit: 123rf.com
Credit: 123rf.com
В этом году эксперимент на мышах с «неандертальскими» аллелями показал, что у неандертальцев могла быть хуже развита новая кора мозга, чем у нас. Исследование геномов 13 неандертальцев из пещер Чагырской и Окладникова на Алтае подтвердило, что они жили небольшими группами, а женщины могли переходить из одной группы в другую. Митохондриальный и частично ядерный геном неандертальца из Мезмайской пещеры на Северном Кавказе секвенировали ученые из Научно-технологического университета «Сириус» и Института общей генетики РАН.
Древняя и историческая ДНК
Сванте Паабо открыл новое направление в молекулярной биологии — анализ древней ДНК людей и животных, из костей, зубов и даже из грунта пещер.Работа о реконструкции экосистемы древней Гренландии по ДНК из осадочных пород замечательна в нескольких отношениях. Секвенирована самая древняя ДНК — возрастом более двух миллионов лет, и это смесь ДНК разных животных и растений. В относительно теплой древней Гренландии росли деревья, жили мастодонты, зайцы, лемминги, северные олени, водоплавающие птицы. Авторы другой работы выдвинули убедительную гипотезу по поводу того, почему мамонт покрыт шерстью.
Работ по древней ДНК исторического периода, как обычно, было много. Монахи-августинцы из Кембриджа XIII–XVI вв. заражались кишечными паразитами чаще простых горожан, хотя гигиенические условия в монастырях были лучше. Геном кишечной палочки четырехвековой давности получили из мумии итальянского дворянина. Европейцы эпохи Меровингов болели оспой и проказой, но оспа того времени, возможно, была менее заразной. Локусы в геномах европейцев, повышающие шанс пережить чуму на 40%, в то же время способствуют иммунным заболеваниям. Чуму изучали и на Крите, и возле озера Иссык-Куль. Популяционные генетики исследовали ДНК женщины эпохи плейстоцена, древних жителей Уоллесии, неолитического населения Месопотамии, мумий железного века из Южной Сибири, евреев средневековой Европы.
 Погребальные маски женской и мужской мумий из могильника Оглахты/ Credit:
PREPRINT | CC BY 4.0
Погребальные маски женской и мужской мумий из могильника Оглахты/ Credit:
PREPRINT | CC BY 4.0
Трансплантология
Год 2022 начался новостью о пересадке человеку сердца свиньи с генными модификациями. Операцию выполнили сотрудники Школы медицины Университета Мэриленда. Через два месяца пациент все же умер, тем не менее результат можно считать прорывным — например, «малышка Фэй», девочка с неизлечимым заболеванием, которой в 1984 году пересадили сердце бабуина в надежде дождаться донорского сердца, прожила всего 21 день. ГМ-свиней предоставила Revivicor, спинаут шотландской компании PPL Therapeutics, той самой, которая участвовала в создании овечки Долли. В 2012 году Revivicor была приобретена компанией United Therapeutics. В конце 2020 года свиней GalSafe от Revivicor одобрило FDA в качестве источника гипоаллергенного мяса и биомедицинских продуктов. Ткани таких свиней не содержат аллергенного углевода альфа-гал. С ними тоже проводят эксперименты по трансплантации, однако сердце для январского пациента, а также почки, которые пересадили человеку с диагностированной смертью мозга в экспериментальных целях, получили от другой линии свиней, у которых изменены не один, а десять генов. Эти модификации снизили вероятность отторжения и других нежелательных явлений.
Как говорят пессимисты, «ксенотрансплантация — дело ближайшего будущего и всегда будет делом ближайшего будущего». Но в этом году были и другие хорошие новости по трансплантологии. Более года прожил человек, которому пересадили печень, три дня жившую вне организма. В органах свиньи перезапустили клеточные процессы с помощью инновационной системы искусственного кровообращения. СМИ сильнее всего впечатлил оживший мозг свиньи, но, скорее всего, эта система поможет сохранять другие органы, более востребованные для пересадки.
Омикрон: конец пандемии?
После явления омикрона осенью-зимой 2021-2022 гг. заболеваемость COVID-19 и смертность хотя и не сходят на нет, но и не поднимаются до пугающих величин.
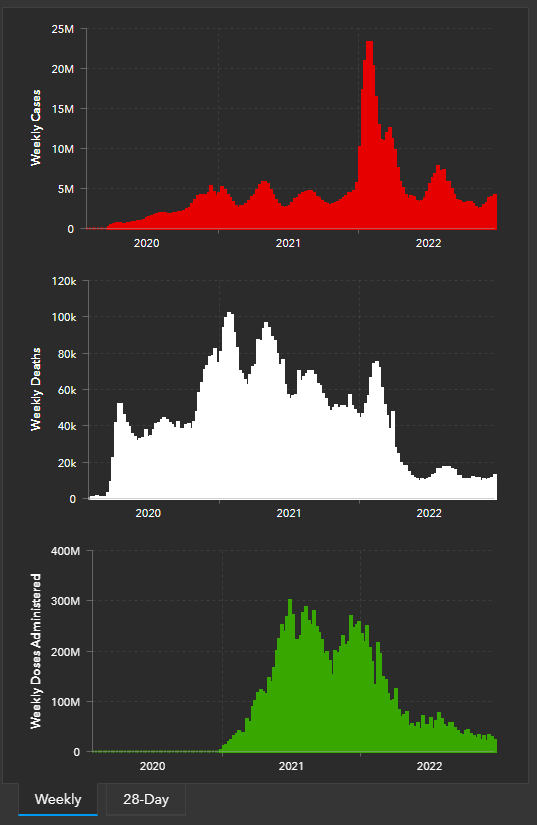 COVID-19 в мире. 23.12.1022. Сверху вниз: заболеваемость, смертность, вакцинация.
COVID-19 Dashboard
COVID-19 в мире. 23.12.1022. Сверху вниз: заболеваемость, смертность, вакцинация.
COVID-19 Dashboard
Небольшой летний подъем совпал по времени с распространением «Кентавра» — сублинии омикрона, которая ускользала от иммунитета еще лучше, чем исходные варианты. Потом появились и другие сублинии, но ничего ужасного не произошло, если не считать того, что упала эффективность моноклональных антител. Зато в этом году у нас есть специфические лекарства — молнупиравир и нирматрелвир (Паксловид), существуют их российские аналоги. Возможно, появятся и другие. Получили разрешения бивалентные вакцины, нацеленные на омикрон. Запатентована российская бивалентная вакцина. Специалисты полагают, что COVID-19 готов занять свое скромное место в структуре сезонных респираторных заболеваний, но регулярная (раз в полгода — год) вакцинация необходима для контроля инфекции. Что бы ни говорили конспирологи о «прививке омикроном», вакцина в шприце защищает надежнее. Конечно, наблюдение за новыми вариантами SARS-CoV-2 надо продолжать: никто не гарантирует, что более опасный вирус не появится.
Новые вакцины
Успех вакцин против COVID-19 открыл дорогу мРНК-вакцинам против других инфекций. Американская компания Moderna совместно с некоммерческой исследовательской организацией IAVI (International AIDS Vaccine Initiative) запустила клинические испытания мРНК-вакцины от ВИЧ в США и Африке (IAVI G002 и IAVI G003). Вакцина содержит мРНК, которая кодирует фрагмент поверхностного белка ВИЧ gp120; он способен собираться в 60-меры под названием eOD-GT8, которые стимулируют выработку предшественников широконейтрализующих антител (ШНАт) против разных штаммов ВИЧ. Сам по себе этот антиген не может защитить от ВИЧ. Предполагается, что он станет частью многоступенчатой схемы вакцинации.
Успешно прошла фаза 2b клинических испытаний мРНК-вакцины от рака — еще одной разработки Moderna. Персонализированный препарат mRNA-4157/V940, кодирующий неоантигены опухоли, в комбинации с «Китрудой» (пембролизумаб) снижал риск рецидива меланомы и смерти на 44% по сравнению с одной «Китрудой».
Наконец, весной Moderna объявила о разработке комбинированных мРНК-вакцин mRNA-1230 и mRNA-1287. Первая нацелена на SARS-CoV-2, вирус гриппа и респираторно-синцитиальный вирус (РСВ), вторая — на эндемичные «простудные» коронавирусы человека. Препарат mRNA-1230 сейчас проходит фазу 1 клинических испытаний.
 Credit: 123rf.com
Credit: 123rf.com
Созданием мРНК-вакцин занимаются и другие компании. Так, Arcturus Therapeutics в апреле обнародовал результаты испытаний самокопирующейся мРНК-вакцины против COVID-19, которые прошли во Вьетнаме. Эффективность препарата против тяжелой инфекции и смерти составила 95%.
Прорывом года по версии Science стали вакцины против РСВ от фармгигантов GSK и Pfizer. Обе вакцины содержат рекомбинантные гликопротеины F вируса в конформации до слияния, обе показали высокую эффективность против тяжелой инфекции у пожилых людей. Вакцина Pfizer, помимо этого, защитила от тяжелого заболевания нижние дыхательные пути младенцев, рожденных у привитых матерей.
Оспа обезьян
Едва мы научились контролировать COVID-19, весной 2022 года произошла вспышка оспы обезьян. Она началась в Великобритании и быстро распространилась на другие регионы. Оспа обезьян — редкое зоонозное заболевание, которое вызывается вирусом, принадлежащим к роду Orthopoxvirus, как и вирус натуральной оспы. Заболевание эндемично в некоторых странах Центральной и Западной Африки, однако в этом году зарегистрирована во множестве неэндемичных стран, включая Россию. В июле ВОЗ объявила оспу обезьян глобальной чрезвычайной ситуацией.
Вышло множество статей с описаниями клиники и предположениями о причинах необычно быстрого распространения инфекции. В США и Европе началась иммунизация медработников и групп риска вакциной от натуральной оспы, было разрешено использование тековиримата для лечения (препарат одобрен как лекарство от натуральной оспы; во время вспышки начались клинические испытания тековиримата против оспы обезьян), появились диагностические тесты.
По данным ВОЗ за ноябрь, число новых случаев оспы обезьян постепенно снижается. На 21 декабря количество случаев инфекции в мире составило 82 999.
 Вирус оспы обезьян. Credit: NIAID |
flickr.com
Вирус оспы обезьян. Credit: NIAID |
flickr.com
Эболавирус в Уганде
20 сентября 2022 года Министерство здравоохранения Уганды и ВОЗ объявили о вспышке вируса Эболы в Уганде. Она оказалась крупнейшей в этой стране с начала 2000-х — 5 декабря сообщалось о 142 случаях заражения и о 55 смертях. В Уганде распространяется эболавирус Судан (SEBOV, или SUDV), а не эболавирусом Заир (ZEBOV), который был причиной вспышек 2013–2016 гг. Терапия и вакцинация против SEBOV еще проходят клинические испытания.
 Credit: 123rf.com
Credit: 123rf.com
Однако есть и хорошие новости: 25 октября Merck заявил, что у него есть до 100 000 замороженных доз экспериментальной вакцины против SEBOV. Вакцина была произведена еще в 2015–2016 году, сразу после успехов вакцины против ZEBOV. На людях она не тестировалась и с тех пор хранилась в замороженном виде. Компания надеется до конца года предоставить около 50 000 доз организации IAVI, которая будет выступать в роли разработчика и регулирующего спонсора. Это одна из трех кандидатных вакцин, которые планируют направить в Уганду.
Антитела и генная терапия против болезни Альцгеймера
В 2021 году компания Biogen зарегистрировала адуканумаб — первый в мире препарат от этого заболевания. В этом году мы увидели его провал. Biogen не выходит из игры: хорошие результаты в клинических испытаниях показал другой препарат компании — леканемаб. Общепринятым объяснением механизма развития болезни Альцгеймера считается гипотеза амилоидного каскада. Оба препарата от Biogen содержат моноклональные антитела к бета-амилоиду, но к разным его формам: адуканумаб нацелен на амилоидные бляшки, леканемаб — на растворимые протофибриллы. За день до публикации результатов клинических испытаний леканемаба в СМИ появились сообщения, что он, возможно, стал причиной смерти двух пациентов. Разработчики считают, что ни одна из смертей не связана с препаратом.
 Credit: 123rf.com
Credit: 123rf.com
Над антителом к бета-амилоидным агрегатом также работала компания Roche, однако клинические испытания ее продукта обернулись крахом. Пока леканемаб остается самым перспективным препаратом этого класса. Заявка в FDA на его ускоренное одобрение была подана летом, решение по ней ожидается 6 января 2023 года.
Компания Lexeo Therapeutics сделала ставку на другой подход. В декабре она представила результаты первой фазы клинических испытаний генной терапии болезни Альцгеймера. Пациентам — носителям аллеля риска APOE4 в гомозиготе вводится аденоассоциированный вектор, кодирующий «защитный» вариант E2 аполипопротеина E. Результаты достаточно хороши для того, чтобы перевести терапию в следующую фазу испытаний.
Генная терапия: еще больше, еще дороже
«Золгенсма», одобренный в 2019 году генотерапевтический препарат против спинальной мышечной атрофии, носил титул самого дорогого лекарства в мире — $2,1 млн за дозу. В этом году рекорд «Золгенсмы» был побит трижды. Летом компания Bluebird Bio зарегистрировала в США препарат для генной терапии бета-талассемии стоимостью $2,8 млн, в сентябре получил одобрение препарат этой же компании против ранней активной церебральной адренолейкодистрофии за $3 млн, а в ноябре первое место по цене заняла нидерландская компания uniQure — ее продукт для генной терапии гемофилии B стоит $3,5 млн.
 Credit:123rf.com
Credit:123rf.com
Технология Bluebird Bio предполагает трансдукцию собственных гемопоэтических клеток пациента ex vivo лентивирусным вектором и возвращение отредактированных клеток в организм. Вектор кодирует функциональный ген, поломка которого у пациента привела к заболеванию. Препарат uniQure работает по-другому: аденоассоциированный вектор доставляет рабочую копию гена в клетки печени.
Иной принцип лежит в основе терапии рака мочевого пузыря, одобренной в США в середине декабря. Препарат Adstiladrin компании Ferring Pharmaceuticals представляет собой нереплицирующийся аденовирусный вектор, несущий ген интерферона альфа-2b. Он предназначен для пациентов с мышечно-неинвазивным раком мочевого пузыря, не отвечающим на стандартную терапию. Вектор вводится в мочевой пузырь, попадает в клетки его стенок и стимулирует противоопухолевый иммунитет.
В 2022 году появились сообщения об успешных клинических испытаниях генных терапий синдрома Вискотта-Олдрича, дистрофического буллезного эпидермолиза, гемофилии А. Активно развивается CRISPR-терапия, направленная не на компенсацию экспрессии мутантного гена, а на «исправление» последнего прямо в организме. Так, на людях тестируют CRISPR-терапии ангионевротического отека и врожденного амавроза Лебера 10 типа.
«Золгенсма» в этом году привлекла внимание общественности сообщением о смерти двух детей. Позже стало известно о снижении продаж препарата, но производитель, компания Novartis, не связывает это со смертельными случаями.
Болезнь Гентингтона: идеи есть...
Привлекательная мишень для генной терапии — болезнь Гентингтона, неизлечимое нейродегенеративное заболевание. Но блестящих успехов пока нет. В 2021 году Roche объявила об остановке фазы 3 клинических испытаний препарата от болезни Гентингтона на основе антисмысловых олигонуклеотидов из-за низкой эффективности и побочных эффектов. То же самое произошло с препаратами от Wave Therapeutics. Побочные эффекты могут быть ассоциированы с неселективным снижением экспрессии нормальной копии гена гентингтина. Впрочем, еще идут клинические испытания вирусного вектора, который доставляет в мозг микроРНК, снижающую уровень гентингтина, от компании uniQure.
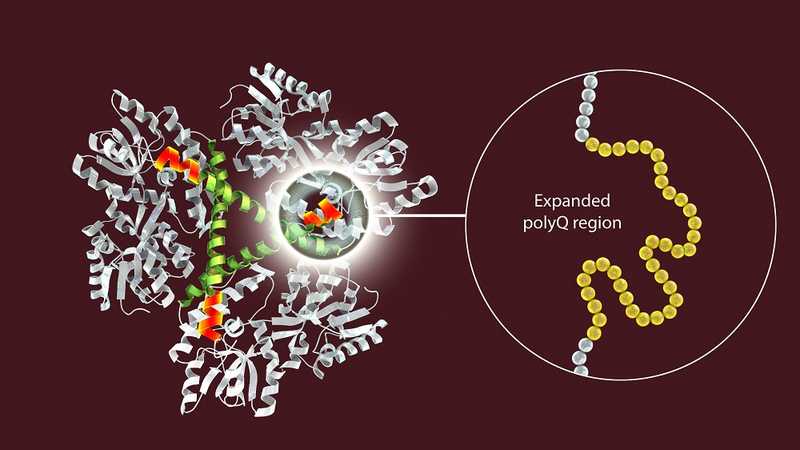 Причина болезни Гентингтона — экспансия CAG-повторов в первом экзоне гена HTT, который кодирует белок гентингтин. Credit: 123rf.com
Причина болезни Гентингтона — экспансия CAG-повторов в первом экзоне гена HTT, который кодирует белок гентингтин. Credit: 123rf.com
На мышиной модели болезни Гентингтона испытана CRISPR-терапия, которая таргетирует только мутантный аллель гена, кодирующего гентингтин, но не аллель дикого типа (большинство пациентов гетерозиготны, то есть имеют и нормальный ген). Препарат на основе CRISPR-Cas13d улучшал координацию движений животных, ослаблял атрофию полосатого тела мозга и уменьшал агрегаты мутантного гентингтина. Улучшения наблюдались на протяжении восьми месяцев после введения вектора в мозг.
Другая исследовательская группа разработала оптимизированную архитектуру малых интерферирующих РНК (миРНК), также нацеленных на мутантную копию гена гентингтина. Терапию опробовали на мышах, у которых одна копия гена была своя, а вторая — мутантная человеческая. Через месяц после инъекции миРНК мышиный гентингтин остался на прежнем уровне, а количество мутантного человеческого белка снизилось более чем на 85%
Эволюция редактирования ДНК: праймирование, интегразы и PASTE
Ученые постоянно улучшают CRISPR-технологии. Праймированное редактирование было разработано, чтобы избавиться от необходимости разрезать две нити ДНК одновременно. Но остается проблема небольшой длины вносимого фрагмента. Чтобы решить ее, исследователи из США скомбинировали CRISPR с интегразой — ферментом, который встраивает геном фага в ДНК бактерии. С помощью праймированного редактирования система CRISPR-Cas9 вносит в геном сайт, узнаваемый сериновой интегразой бактериофага (аttB), а затем уже интеграза встраивает в геном длинный участок ДНК. Систему назвали PASTE — Programmable Addition via Site-specific Targeting Elements. С ее помощью авторы вставили 13 последовательностей ДНК длиной от 779 до 36 тысяч пар оснований в различные типы клеток, а также отредактировали клетки печени гуманизированных мышей in vivo. Кроме того, они проанализировали бактериальные геномы и метагеномы и обнаружили 25 614 новых интеграз и их сайтов интеграции. Нам кажется, что у этой технологии большое будущее.
Что еще нас удивило в 2022 году
Научные открытия не обязаны переворачивать мир, чтобы поражать воображение. Например, ученые из Китая использовали CRISPR-систему, чтобы переписать метилирование ДНК в семи контрольных областях импринтинга неоплодотворенной яйцеклетки мыши. Из такой яйцеклетки развился нормальный эмбрион, который имплантировали самке мыши. Рожденная партеногенетически самка забеременела и родила мышат.
 Credit: Yanchang Wei | PNAS, 2022, DOI: 10.1073/pnas.2115248119 | CC BY-NC-ND 4.0
Credit: Yanchang Wei | PNAS, 2022, DOI: 10.1073/pnas.2115248119 | CC BY-NC-ND 4.0
В мангровых зарослях на побережье Карибского моря нашли гигантскую бактерию, которую видно невооруженным взглядом, — она напоминает нитку длиной до 2 см. Ее предложили назвать Thiomargarita magnifica. Ученые полагают, что достигнуть таких размеров бактерии помогли два мембранных мешка, один из которых содержит генетический материал, а второй — предположительно, воду.
Международный консорциум BioRescue пытается сохранить на нашей планете северного белого носорога. Осталось всего две особи этого вида, и обе — самки, так что без помощи ученых тут не обойтись. Сначала из фибробластов кожи носорога получили плюрипотентные стволовые клетки, а уже в декабре из них вырастили первичные половые клетки. Следующий шаг — зрелые гаметы.
Все больше внимания ученые уделяют микробиоте человека, в частности, микробиоте кишечника и ее влиянию на высшую нервную деятельность. Кишечные бактерии мышей повышали у них желание бегать, воздействуя через сенсорные нейроны на дофаминовый сигналинг и активацию полосатого тела. В другой работе, уже на людях, ученые показали связь 12 родов и одного семейства бактерий с симптомами депрессии. Может, они и мысли нам внушать могут?
Ученые из Великобритании увидели, как синегнойная палочка плывет в сторону увеличения концентрации антибиотика. При этом бактерии погибают, лизируются и выпускают свои антибактериальные вещества. Исследователи предположили, что бактерии просто повторяют поведение, характерное для них в природе — двигаются к колонии бактерий-конкурентов, чтобы атаковать их.
 Гигантская бактерия. Credit: Jean-Marie Volland |
Пресс-релиз
Гигантская бактерия. Credit: Jean-Marie Volland |
Пресс-релиз


 Меню
Меню





 Все темы
Все темы




 0
0








